FUNCTIONAREA BATERIEI DE ACUMULATOARE
O baterie
ĭnmagazineaza energie pentru uz ulterior.
Ea produce tensiune dintr-o reactie
chimica produsa intre doua materiale diferite (placa
pozitiva si cea negativa) care sunt introduse ĭn electrolit.
Electrozii sunt cufundati intr-o solutie
apoasa de acid sulfuric. Prin asa-nimita operatie de "formare"
(a carei retea difera de la un mod de fabricatie la altul), care
consta in principal in alimentarea cu curent a acumulatorului, electrozii se
transforma, placile pozitive ajung de culoare cafenie si acoperite cu
PbO2, iar placile negative cenusii si acoperite cu plumb
negricios.
Intr-un acumulator
normala acid-plumb, tensiunea aproximativa este de 2V /celula, deci un total de
12V. Curentul este degajat de baterie cu atat mai repede cu cat
exista un circuit intre borna pozitiva si cea negativa.
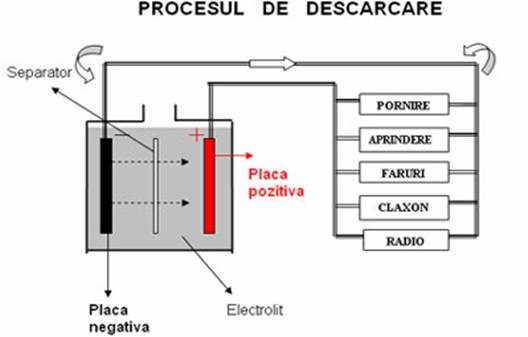
Procesul de descarcarea a acumulatoarelor cu plumb
Descarcarea
acumulatoarelor cu plumb comporta urmatoarele reactii chimice
globale:
Situatia ĭnainte de descarcare:
Electrod pozitiv (PbO2) H2SO4 Electrod negativ (Pb)
Sensul curentului ĭn element:

Circulatia ionilor:

 H2+ + SO4
- -
H2+ + SO4
- -
Reactii chimice la electrozi:
PbO2 + H2 + H2SO4
= PbSO4 + 2H2O Pb + SO4 = PbSO4
Situatia finala a electrozilor:
PbSO4 PbSO4
Cele
doua placi fiind identice, acumulatorul nu mai poate debita curent.
Placile se sulfateaza, concentratia acidului descreste.
Cei mai multi dintre oameni nu realizeaza ca un acumulator cu
plumb functioneaza pe baza unui proces continuu de
ĭncarcare-descarcare. Atunci cand o baterie este
conectata la o sursa ce are nevoie de curent, cum ar fi un
autoturism, curentul iese din baterie si bateria incepe sa se descarce.
Un acumulator cu plumb ĭncarcat are o t.e.m. de circa 2,2V. Ĭn
functionare, tensiunea scade destul de repede la Ud = 1,95V,
apoi ramane catva timp aproape canstanta, scazand apoi
din nou brusc. Cand tensiunea a ajuns la 1,8V, descarcarea trebuie
ĭntrerupta, deoarece sub aceasta valoare reactiile chimice
nu mai sunt reversibile
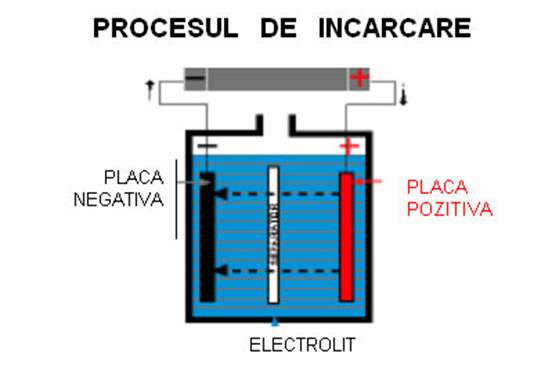
Procesul de ĭncarcare a acumulatoarelor cu
plumb
La ĭncarcare, reactiile chimice sunt
inverse:
Situatia ĭnainte de ĭncarcare:
Electrod pozitiv (PbSO4) H2SO4 Electrod negativ (PbSO4)
Sensul curentului ĭn electrod:

Circulatia
ionilor:

 SO4 -- -- H2+
+
SO4 -- -- H2+
+
Reactii chimice la electrozi:
PbSO4
+ SO4 + 2H2O = PbO2 + 2H2SO4 PbSO4 + H2
= Pb + H2SO4
Situatia finala a electrozilor:
PbO2
Pb
Concluzie:
Prin
ĭncarcarea acumulatorului se restabileste situatia
initiala si concentratia acidului creste.
Acumulatorul devine ĭncarcat
atunci cand primeste iar curent, reinstalind diferentele chimice
dintre placi.
Pe masura ce acumulatorul se
descarca, placile de plumb devin din punct de vedere chimic
asemanatoare, acidul devine mai slab si tensiunea scade.
Acumulatorul se poate
reĭncarca total atunci cand se reinstaleaza diferentele
chimice dintre placi, iar acumulatorul poate furniza din nou curent.
La ĭncarcare, tensiunea
acumulatorului creste rapid pana la Ui =2,2V, apoi
scade lent pana la 2,3V. La sfarsitul ĭncarcarii,
tensiunea este de 2.6-2,7V.
Din punct de vedere tehnic, bateriile se
caracterizeaza prin:
a) tensiune, determinata de numarul elementelor ĭn serie;
b) capacitatea elementului (acumulatorului) (ĭn Ah) pentru o anumita
durata
de descarcare
c) curentul de lucru maxim
admisibil (care nu trebuie mult depasit nici pentru un timp foarte scurt,
putand duce prin efectele lui mecanice la distrugerea placilor);
d) randamentul energetic
ηw = Wdesc/Winc,
care este de ordinul 70-80%, din cauza pierderilor de energie prin reactii
chimice secundare (care determina si diferenta dintre tensiunea medie
de ĭncarcare si tensiunea medie de descarcare) si prin efect
electrocaloric ĭn rezistenta lui interioara;
e) randamentul ĭn cantitate de electricitate (ĭn sarcina)
ΗQ = Qdesc/Qinc
de ordinul a 85-90%;
f) tipul constructiv (adecvat
conditiilor de utilizare si durabilitatii necesare: acumulatoarele de
dimensiuni mici si durabilitate redusa pentru autovehicule,
acumulatoare de dimensiuni mari si durabilitate mare, pentru instalatii
stationare etc.)



