ECHILIBRUL ACIDO-BAZIC
Procesele metabolice din organism
au loc prin reactii generatoare de ioni H+, ele fiind cu alte
cuvinte procese producatoare de acizi.
Glicoliza, calea
initiala de degradare a glucozei din metabolismul glucidic, conduce
la formarea de acid piruvic sau de acid lactic si fiecare din acesti
acizi pot elinera prin disocierea gruparii
carboxil, in conditiile unui mediu alcalin, ioni de hidrogen. Continuarea
procesului catabolic prin intrarea in ciclul acizilor tricarboxilici, determina
elinerarea suplimentara de protoni.
Degradarea trigliceridelor are ca
rezultat eliberarea de acizi grasi si glicerol (atat acizii grasi cat si
glicerolul fiind substante capabile de a ceda hidrogen). Ulterior, degradarea β-oxidativa
a acizilor grasi duce la formarea corpilor cetonici (acidul β hidroxibutiric
si acidul acetoacetic) precum si CO2 care formeaza cu apa
H2CO3 pentru a disocia apoi in HCO3 si H+.
Metabolismul proteinelor implica
de asemenea reactii producatoare de ioni de H - procesele de decarboxilare, gluconeogeneza din aminoacizi,
catabolismul protidic cu folosirea acestui substrat ca material energetic in
ciclul Krebs si neutralizarea amoniacului cu formarea ureei ca produs final de
catabolism.
 2NH4+ + HCO3- H2N - C - NH2 + 2H2O
+ H+
2NH4+ + HCO3- H2N - C - NH2 + 2H2O
+ H+
Semnificatia parametrilor de echilibru acido-bazic
Cation - particula
ionizata pozitiv care sub actiunea campului electric se deplaseaza spre catod
Anion - particula ionizata
negativ care sub actiunea campului electric se deplaseaza spre anod
Acid - substanta donoare de
ioni de H (acid puternic - se disociaza
rapid si elibereaza cantitati mari de H, acidul slab se discociaza si
elibereaza H doar cand concentratia acestuia in solutie este redusa sau daca
solutia este alcalina)
Baza - substanta disociabila
care are capacitatea de a se combina cu H
Pereche tampon - este formata
dintr-un acid slab si o sare slaba a aceluiasi acid. Solutia tampon este acea
solutie care reduce modificarea aciditatii unei solutii (daca solutia are
aciditate mare, componenta acida reactioneaza cu sarea rezultand o sare neutra
si un acid slab, scazand astfel cantitatea de ioni de H ce ar fi fost eliberati
de acidul puternic; daca solutia este bazica, acidul « tampon »
elibereaza ioni de H si readuce pH-ul la normal).
Tamponul
pentru :
mediul
extracelular este reprezentat de sistemul bicarbonat - acid carbonic
mediul
intracelular este reprezentat de proteine si fosfatii organici
urina este
reprezentat de fosfati in formele mono/dihidrogenate si NH4
Gaura anionica
Reprezinta diferenta intre suma
cationilor si suma anionilor :
D = (Na+K) - (Cl+HCO3) =
14,1 - 18,1 mmol/l
Are valori crescute in acidoze
(lactica), alcoolism, coma hepatica, cetoacidoza diabetica, IRC, intoxicatii
(CO, salicilati, alcool metilic) si valori scazute in stari inductoare de
alcaloza.
Hiatusul anionic este util in principal pentru a vedea
mecanismul aparitiei acidozei / alcalozei metabolice.
Daca D
creste peste 18 mmol/l semnifica un consum crescut peste normal de
HCO3 pentru ca se produc mai multi acizi. Mecanismul este
consumul crescut de HCO3 de exemplu prin hiperproductia de ac.
lactic, cand se intensifica glicoliza anaeroba (nefiind suficient
oxigen) sau cand apar corpii cetonici, de exemplu in diabetul zaharat.
O acidoza
metabolica insa poate avea si D este normal - in situatia in care desi HCO3
este redus, valoarea Cl este crescuta (in acidoze hipercloremice - la nivelul
tubului contort proximal cu reabsorbtie crescuta de Cl).
Valori reduse ale D se coreleaza cu exces de HCO3, prin consum redus
de bicarbonat ca urmare a scaderii nivelului de ioni de H plasmatici sau prin
aport crescut de HCO3 (care depaseste necesitatile statusului de
echilibru acido-bazic). Pentru o interpretare corecta a D, trebuie si in
aceasta situatie analizate valorile cloremiei, deoarece acestea pot masca o
alcaloza metabolica (cloremia scazuta).
pH reprezinta logaritmul cu
semn schimbat al concentratiei ionilor de hidrogen.
Sursele
de ioni de H din organism sunt reprezentate de acizii volatili (H2CO3)
si nevolatili (lactic, cetoacizi, acizi alimentari).
Ionii
de H sunt tamponati in proportie de 95% de HCO3 si numai in
proportie de 5% de proteine si fosfati, valorile acestora fiind anormale numai
cand raportul HCO3*H2CO3 = 20*1 este
modificat..
Nivelul
bicarbonatului este controlat de rinichi, iar cel al acidului carbonic este
controlat de plamani, astfel :
pH
crescut = alcaloza
hiperventilatie
(eliminare crescuta de CO2/a.carbonic
hipokaliemie
pierderia cide
medicamente
(bicarbonat, furosemid, fenilbutazona)
pH scazut = acidoza
hipoventilatie
(eliminare scazuta de CO2/a.carbonic)
diabet
zaharat
intoxicatii
(acetona, eter, etilen glicol, metanol)
medicamente
(etanol, izoniazida, aspirina, CaCl2, spironolactona, tetraciclina,
a.nalidixic)
Valori fiziologice de
repaus sunt 7,35-7,45 ceea ce corespunde la 45-35 nEq/l H
pH = 6,1 + log HCO3 /
(0,03 X pCO2)
Limitele
compatibile cu viata ale pH-ului sunt considerate 6,7 si 7,8 corespunzand la
200 respectiv 16 nEq/l.
La un
pH de 7,4 concentratia ionilor de H este de 40 nEq/l. La fiecare crestere a
pH-ului cu 0,1 unitati acesti nEq se inmultesc cu 0,8 astfel la un pH de 7,5
vom avea 40 X 0,8 = 32 nEq/l. In cazul in care pH-ul scade, pentru fiecare
scadere a pH-ului cu 0,1 unitati, concentratia ionilor de H se inmulteste cu
1,25 astfel la un pH de 7,3 vom avea 40 X 1,25 = 50 nEq/l
TCO2 reprezinta suma bicarbonatului actual cu
bioxidul de carbon dizolvat in sange. Se masoara in mmol/l.
TCO2 = 0,03 x pCO2 + HCO3-, unde
0,03 reprezinta constanta
Bunsen
Valori fiziologice de
repaus:
femei:
21-25 mmol/l.
barbati:
23-25 mmol/l.
pCO2 reprezinta presiunea partiala a dioxidului de
carbon dizolvat in sange. Se masoara in mmHg. In functie de ventilatia
pulmonara, nivelele pot fi crescute (insuficienta pulmonara) sau scazute (stari
hiperventilatorii). Pentru a exprima valorile in mEq/l, se inmulteste valoarea
presiunii in mmHg cu 0,03.
Valori crescute -
hipercapnie :
RAC
MAL
Astm
bronsic
BPOC
Fibroza
pulmonara
Defecte
cardiace
Sdr.
hpoventilatorii (atelectazie, pleurezie, pneumotorax)
Poliomielite
Valori scazute - hipocapnie:
RAL
MAC
Acidoza diabetica
Embolie pulmonara
Hiperventilatie
Hipoxie
Pneumonii
Pneumoconioze
Altitudini ridicate
Valori fiziologice de
repaus:
femei:
32-42 mmHg (4,3 - 6 kPa)
barbati:
35-45 mmHg (4,7 - 6,4 kPa)
pO2
reprezinta presiunea partiala a oxigenului gazos dizolvat in sange. Se masoara
in mmHg.
Valori fiziologice de
repaus: 75-100 mmHg:
SAT (saturatia cu oxigen a
hemoglobinei) reprezinta totalitatea oxigenului ce este combinat cu hemoglobina
impartit la totalitatea oxigenului ce ar putea fi combinat cu hemoglobina. Se
masoara in procente si in general, valorile de repaus sunt cuprinse intre 85 -
99% cu valori reduse la nou nascuti (85-90%) si valori mai ridicate la adulti
(95-99%)
Valori
crescute se inregistreaza la :
Efort fizic
crescut
Hiperventilatie
Policitemie
Oxigenoterapie
Valori scazute se inregistreaza in :
Anemii
Astm bronsic
Atelectazii
Bronsiectazii
EPA
Embolie pulmonara
Emfizem pulmonar
BPOC
Insuficienta
cariaca
Pneumonii
Pleurezii,
penumotorax
Sunturi
dreapta-stanga
Nu trebuie confundata notiunea de
saturatie a O2 cu cea de presiune partiala a O2, astfel
in conditiile unei saturatii constante a O2, putem avea :
pO2
redusa - asociata cu pH , temperatura pCO2 si 2,3 DPG
pO2
crescuta - asociata cu pH , temperatura , pCO2 si 2,3 DPG
HCO3 (bicarbonat standard) reprezinta continutul
in bicarbonati din sangele circulant in momentul recoltarii si depinde de pCO2,
adica de functia respiratorie. Se masoara in mmol/l. Bicarbonatul standard este
echilibrat la 37 grade cu valori de 40mmHg CO2 si 100mm HgO2
Valori sunt
calculate indirect, din masurarea valorilor pH-ului si pCO2,
folosind formula Henderson-Hasselbach:
femei:
20-24 mmol/l.
barbati:
22-26 mmol/l.
Bicarbonatul
este filtrat la nivel glomerular si reabsorbit in TCP si TCD.
In
ultrafiltratul glomerular NaHCO3 se descompune in Na care trece in
celula tubulara si HCO3. Acesta in continuare se cupleaza cu un ion
de H, formand acidul carbonic, care se descompune in H2O si CO2.
CO2 se absoarbe in celula tubulara, unde se cupleaza cu apa
reformand acidul carbonic. Datorita mediului predominent alcalin din celula,
acidul carbonic disociaza in HCO3 si H. Ionii de hidrogen sunt
reexcretati in lumenul tubular unde se recupleaza cu HCO3, iar HCO3
din celula este absorbit in sange.
Lumen
tubular Celula
tubulara Capilar
sangvin
Na+
HCO3 -
 Na 3 X
Na
Na 3 X
Na
 2 X K
2 X K
 HCO3
- + H+
HCO3
- + H+


 H+ + HCO3 - HCO3 -
H+ + HCO3 - HCO3 -
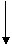 H2CO3 H2CO3
H2CO3 H2CO3
 H2O
+ CO2 CO2 + H2O
H2O
+ CO2 CO2 + H2O
La nivelul TCP, este reabsorbit alaturi de HCO3
si Na (pentru fiecare 3 Na reabsorbiti sunt excretati 2 K).
La
nivelul tubilor distali ionul H+ excretat de celula tubulara nu se
va mai combina cu HCO3 -, ci cu NH3, fiind eliminat apoi
ca NH4+ sau cu HPO4 2- , fiind eliminat ca H2PO4-.
HCO3 reprezinta principalul element de
neutralizare a ionilor de H, avand o pondere de aproximativ 95% in tamponarea
aciditatii sangvine. Elementul
« tampon » este reprezentat de perechea HCO3*H2CO3
(CO2 dizolvat), intr-un raport de 20*1. Cat timp acest raport ramane
constant, pH-ul sangvin ramane la 7,4, chiar daca valorile absolute ale ionilor
se schimba.
Valori
crescute se pot intalni in :
RAC
- boala membranelor alveolare, emfizem pulmonar, IC cu congestie pulmonara
MAL -
hipokalemie, ingestie de NaHCO3, stenoza pilorica
Hiperaldosteronism
Aspiratii
gastrice
Insuficienta
renala
Insuficienta
respiratorie
Boala
Cushing
Valori scazute se pot intalni
in :
MAC -
acidoza diabetica, malnutritie, efort prelungit
RAL -
hiperventilatie
Deshidratare
Diaree
Hipotensiune
Insuficienta
renala
Boala
Addison
Intoxicatii
cu salicilati, metanol
BE (excesul de baze)
reprezinta capacitatea totala a anionilor (HCO3, Hb, proteinele
plasmatice si fosfatii) de a tampona
ionii de H si de a restabili echilibrul acido-bazic intr-un litru de sange la
pCO =40 mmHg, pH=7,40 si la 37o C.
Aceasta este expresia IN VITRO
utilizata pentru a putea descrie situatiile de dezechilibru metabolic. Se
masoara in mmol/l.
La
nou-nascuti valorile sunt mult reduse (-10 -2), la copiii mici -7 -1, iar la adolescenti cresc spre -4 +2, pentru ca valorile la adulti sa fie
de -2,4 pana la +2,3 la femei si -3 pana la +3 la barbati.
BE este
scazut in cazul pierderii de substante alcaline (MAC, MAC+RAL, RAC,
cetoacidoza, RAL compensata) si crescut in RAC compensata, MAL+RAC, MAL.
Valori fiziologice de
repaus: 22-26 mmol/l.
In medicina clinica,
variatia si raporturile intre acesti parametrii determina clasificarea
acidozelor si alcalozelor. Atat acidozele cat si alcalozele pot fi respiratorii
sau metabolice si fiecare dintre ele pot fi compensate sau decompensate.
|
Dezechilibru
|
Tip
|
pCO2
|
pH
|
SB
|
compensare
|
|
MAC
(HCO3
|
decompensata
|
|
<
|
<
|
|
|
compensata
|
<
|
|
<
|
hiperventilatie
|
|
MAL (HCO3
|
decompensata
|
|
>
|
>
|
|
|
compensata
|
>
|
|
>
|
hipoventilatie
|
|
RAC
(CO2
|
decompensata
|
|
<
|
|
|
|
compensata
|
>
|
|
|
acidurie
|
|
RAL (CO2
|
decompensata
|
|
>
|
|
|
|
compensata
|
<
|
|
|
urina
alcalina
|
Modificarile de acidoza/alcaloza
nu sunt izolate ci apar de obicei in diferite combinatii in functie de statusul
patologic existent, astfel pot exista :
|
MAC - RAC
|
SB
|
CO2
|
pH
|
|
MAL -
RAL
|
SB
|
CO2
|
pH
|
|
MAC -
RAL
|
SB
|
CO2
|
pH
|
|
MAL -
RAC
|
SB
|
CO2
|
pH
|
ACIDOZA METABOLICA
Acidoza
metabolica reflecta o productie crescuta de acid sau o pierdere crescuta de
bicarbonat, avand ca rezultat o scadere a pH-ului. Raspunsul imediat al
organismului e reprezentat de cresterea ventilatiei, cu eliminare crescuta de
CO2, iar tardiv de cresterea excretiei de acizi si retentia de HCO3
la nivel renal.
Regula : pCO2
scade compensator cu 1-1,3mm Hg pentru fiecare 1mEq HCO3 scazut (cu
limita la 10 mmHg)
Stari asociate cu productii crescute de acid :
Anemia
Acidoza diabetica
Ciroza hepatica
Etilismul
Malnutritia
Hipoxia
IRA, IRC
Sdr. Fanconi
Diaree
Intoxicatii (CO, arsenic)
Stari asociate cu eliminare scazuta de acizi:
Acidoza
tubulara renala (distala tip II)
Defecte enzimatice ereditare
Hipoaldosteronism
IRA
Stari asociate cu eliminare crescuta de bicarbonati:
Acidoza
tubulara renala (proximala tip I)
Fistule
Diaree
Ileostome
colostomie
In afara de
situatiile prezentate mai sus, asociate in principal cu modificari in sistemul
bicarbonat sau al ionilor de H, acidozele pot apare si la variatii ale
celorlalte elemente participante la homeostazia acido-bazica, astfel :
Acidoza metabolica hipercloremica :
Adenom vilos
hipoaldosteronism
fistule gastro-intestinale
hiperpotasemie
IR avansata
Acidoza metabolica hiperpotasemica
Amiloidoza renala
Siclemie
Hipoaldosteronism
Nefrite interstitiale
Nefropatie diabetica
Uropatie obstructiva
Acidoza lactica
Cu hipoxie
v
Anemie
v
Hemoragie
v
Asfixie
v
hTA
v
Soc
v
Efort crescut
Fara hipoxie
v
Diabet
zaharat
v
Boli
infectioase
v
I
Renala
v
Uremie
v
Alcaloze
v
Deficite
enzimatice (piruvat dehidrogenaza, piruvat carboxilaza, fructozo 1,6 difosfataza)
ALCALOZA METABOLICA
Apare la
administrarea sau productia unor cantitati crescute de substante alcaline sau
la pierderea de acizi - urmate de cresterea pH-ului sangvin. Raspunsul imediat
al organismului e reprezentat de scaderea ventilatiei, cu cresterea nivelului
sangvin de CO2, iar tardiv o crestere a excretiei de HCO3
si scaderea eliminarii de acizi la nivel renal.
Regula : pCO2
creste compensator cu 0,5 - 1mm Hg pentru fiecare crestere cu 1mEq HCO3
(cu limita la 55 - 60 mmHg)
HCO3 crescut la
Administrarea
de antiacide - perfuzii cu bicarbonat
Eliminare
scazuta de bicarbonat
Metabolizarea
cetonelor si lactatilor
Pierderi de acizi
Hipopotasemie
severa
Administrarea
de diuretice (furosemid, tiazidice)
Corticosteroizi
b.
Cushing
b.
Conn
aspiratii
nazo-gastrice
Alte cauze :
diaree, hiperaldosteronism, hipoproteinemie, voma
ACIDOZA RESPIRATORIE
Are trei
mecanisme principale : scaderea ventilatiei, scaderea ritmului respirator,
productie de cantitati crescute de CO2.
In urma scaderii schimbului de gaze la nivel pulmonar are
loc o crestere a CO2 plasmatic ceea ce determina alterarea
raportului H2CO3*HCO3, urmata de scadearea
pH-ului. Raspunsul rapid al
organismului e reprezentat de cresterea ventilatiei pulmonare si consecutiv o
eliminare crescuta de CO2, iar tardiv retentie de HCO3 si
cresterea eliminarii de acizi la nivel renal.
Regula : HCO3
creste compensator cu 1mEq pentru fiecare crestere a pCO2 cu 10
mmHg, limita cresterii fiind la 30 mEq/l.
Dupa 2-4 zile de
la persistenta tulburarii primare, rinichiul creste eliminarea de H si
reabsorbtia de HCO3, crescand astfel valorile la peste 30 mEq/l,
instalandu-se modificarile de acidoza respiratorie cronica. In acest caz HCO3
creste cu 3,5 mEq la fiecare crestere a pCO2 cu 10 mmHg, cu
limita la 45 mEq/l.
Cauzele acidozei
respiratorii pot fi :
Centrale
v
Edem
cerebral
v
Encefalite
v
Tumori
v
Traumatisme
v
Meningite
v
Mixedem
v
Coma
v
Afectarea centrilor respiratorii
Toraco-abdominale
v
Alveolita fibrozanta
v
Astm bronsic
v
Bronsiolita
v
EPA
v
Embolie pulmonara
v
BPOC
v
Spasm laringian
v
Miastenie
v
Mixedem
v
Pneumonie
v
Pneumotorax
v
Pleurezie
v
SDRA
Nervoase
v
Botulism
v
Tetanos
v
Poliomielita
v
Otraviri
(curara, organofosforice)
ALCALOZA RESPIRATORIE
Are loc o
crestere a schimbului de gaze datorita hiperventilatiei, determinand o crestere
a eliminarii de CO2, o crestere secundara a HCO3 ceea ce
determina o valoare crescuta a pH-ului.
Raspunsul
organismului este reprezentat imediat de scaderea ventilatiei cu scaderea
eliminarii de CO2 si tardiv prin cresterea eliminarii la nivel renal
al HCO3 si scaderea eliminarii de cationi.
Regula : HCO3
scade compensator cu 2mEq pentru fiecare scadere a pCO2 cu 10 mmHg,
limita scaderii fiind la 18 mEq/l.
Dupa 2-4 zile de
la persistenta tulburarii primare, rinichiul scade eliminarea de H si o creste
pe cea de HCO3, astfel incat concentratia plasmatica a HCO3
scade sub 18mEq/l, cu instalarea alcalozei respiratorii cronice. In acest caz,
HCO3 scade cu 5 mEq/l pentru fiecare scadere a pCO2 cu
10mm Hg, cu limita la 12 mEq/l.
Cauzele pot
fi :
Centrale
v
Hiperventilatia
psihogenica
v
Isterie
v
Hipoxemie
v
SAH
v
Encefalite
v
Tumori
v
AVC
Toracice
v
Astm bronsic
v
EPA
v
Embolie pulmonara
v
IMA
v
Sunturi stanga-dreapta
v
Corp strain pulmonar
v
Hipertensiune pulmonara
Alte cauze: anemie, ciroza hepatica, hipertiroidism,
sarcina, insuficienta hepatica, boli infectioase.
A. Metoda
echilibrului acido-bazic (metoda micro-Astrup)
Metoda Astrup (Astrup P., 1961; Siggaard Anderson O., 1966) se bazeaza pe
relatia invers proportionala care exista intre presiunea partiala a CO2
(pCO2) si pH-ul sangelui. Cu cat pCO2 este mai mare, cu atat pH-ul va scadea (va devia
spre latura acida). Metoda presupune efectuarea a trei determinari din sangele
recoltat si anume:
- o determinare de
pH din sangele arterial sau capilar recoltat in conditii anaerobe. Aceasta
valoare reprezinta pH-ul actual sau real al sangelui;
- o determinare
de pH din sangele care a fost in prealabil echilibrat cu un amestec de oxigen
si bioxid de carbon, in care valoarea pCO2 este cunoscuta si
prezinta valori ridicate (de regula 60 mmHg);
- o determinare de pH in sangele
care a fost in prealabil echilibrat cu un amestec de oxigen si bioxid de
carbon, in care valoarea cunoscuta a pCO2 este joasa (de obicei 30
mmHg).
Valorile obtinute se
inscriu pe o nomograma, avand trecute pe ordonata valorile de pH, iar pe abscisa
valorile logaritmice ale pCO2 (Nomograma Siggaard-Andersen). Dreapta
care se traseaza prin unirea celor doua valori obtinute prin determinari de pH
la pCO2 cunoscute, indica relatia intre pCO2 si pH.
Valoarea pH-ului actual se interpoleaza pe aceasta dreapta, iar valoarea
actuala a pCO2, in sangele de cercetat, se determina ducand o verticala
din punctul care inscrie pH-ul actual (prima determinare de pH efectuata in
sangele recoltat in conditii anaerobe), pana pe abscisa pe care sunt inscrise
valorile pCO2.
Daca avem de-a
face cu un caz de MAL sau MAC pure, nu este necesara efectuarea punctiei
arteriale, pH-ul putand fi apreciat din sangele venos. In situatia in care
exista o intricare de acidoza/alcaloza metabolica si respiratorie, este nevoie
insa si de aprecierea parametrilor din sangele arterial.
B. In absenta ASTRUP sunt necesare
- parametru
care sa defineasca reactia EAB - pH - normo/hiper/hipohidrogenie
- parametru
care sa defineasca, componenta respiratorie a EAB - pCO2 -
normo/hipo (RAL, MAC) / hipercapnie (RAC, MAL)
- parametru
care sa defineasca, componenta metabolicaa EAB - HCO3, BE, BT -
normo/ hipo (MAC, RAL)/ hiperbazemie (MAL, RAC).
C. Determinarea rezervei alcaline
O a 3-a metoda este determinarea rezervei alcaline prin
titrarea sangelui cu un acid, proces in care se degaja CO2, care
este captat si masurat. Valoarea
normala este de 58-60 de volume CO2/100ml.
Poate fi astfel
calculat HCO3 plasmatic prin formula HCO3 = rezerva
alcalina/2,2
Pentru calcularea
pH-ului se poate folosi fie nomograma, fie se poate aplica formula de calcul
prescurtat, astfel :
pH =
7,valoareaHCO3 + 0,15
Exemplu - la HCO3
= 10 mEq/l avem un pH de 7,10 + 0,15 = 7,25
In continuare pentru a determina presiunea partiala a CO2,
introducem valoarea HCO3 in formula : pCO2 = (1,5 X
HCO3) + 8
Celula tubulara
renala realizeaza un gradient de concentratie al ionilor de H de 1/1000,
scazand pH-ul urinii de la 7,4 la 4,4 si se elimina ca aciditate titrabila sub
forma de fosfati de Na si NH4.
La nivelul
filtratului glomerular raportul intre di si monofosfatii de Na este de
5 :1, predominand forma bibazica, iar in urina finala se ajunge la un
raport de 1 :400, predominand forma monobazica.
In mod normal aciditatea titrabila este de 15-25 mEq/24h, in cazul acidozelor
ajungand la 100-250 mEq.24h.
Titrarea ionilor
de amoniu are valori normale de 40-60 mEq/24h, putand ajunge la 200-250 mEq/zi
in acidoze.
Testul
incarcarii cu clorura de amoniu
Se efectueaza in cazul suspicionarii unei acidoze tubulare
renale tip I, cu deficienta in excretia de acizi.
La inceputul
testului se recolteaza o proba de urina pentru masurarea pH-ului si o proba de
plasma pentru masurarea bicarbonatului. Datorita modificarii rapide a pH-ului
daca este expus la aer, recipientul de recoltare trebuie sa fie etans.
Daca pH-ul urinar
este sub 5,4, releva o capacitate normala de acidifiere a urinii si nu e
necesara continuarea testului.
Daca bicarbonatul
sangvin este scazut, corelat cu un pH urinar peste 5,4, este confirmat
diagnosticul de acidoza tubulara renala.
Daca niciuna din
aceste conditii nu este indeplinita, se administreaza pacientului clorura de
amoniu, 0,1g/kg po. Sunt colectate ulterior probe de urina in fiecare
ora in urmatoarele 6-8 ore. Daca oricare dintre probe are un pH sub 5,4, testul
poate fi oprit deoarece indica o capacitate normala de excretie acida a tubilor
distali renali. La 3 ore dupa
ingestie, trebuie recoltata de asemenea o proba de sange pentru determinarea
bicarbonatului plasmatic, pentru a fi siguri de aparitia acidemiei.
Testul
incarcarii cu bicarbonat
Este metoda
utilizata pentru diagnosticul acidozei tubulare renale tip II, caracterizata
prin scaderea reabsorbtiei de bicarbonat.
Se administreaza
bicarbonat sodic intravenos 0,5-1 mmol/kg/ora. Dupa 60 min se masoara nivelul
plasmatic al bicarbonatului pentru a se confirma daca a depasit valoarea de 20
mmol/l. In fiecare ora se masoara pH-ul urinar si nivelul urinar de bicarbonat,
pentru a permite calcularea fractiei de excretie a bicarbonatului :
FEHCO3 = x urina [creatinina])} X 100%
In mod normal FEHCO3 este sub 15%. Un nivel peste 20% confirma acidoza tubulara
renala tip II.
Buletine :
HCO3 =
24 mEq/l
H2CO3
= 0,6 mEq/l
HCO3/H2CO3
= 40/1
pH= 7,6
pCO2 =
29
R: alcaloza
respiratorie decompensata
HCO3 = 45 mEq/l
H2CO3 = 1,35
HCO3/H2CO3 = 33/1
pH = 7,59
pCO2 = 40
R: alcaloza metabolica decompensata
HCO3 = 16
H2CO3 = 1,35
HCO3/H2CO3 = 11/1
pH = 7,25
pCO2 = 40
R: acidoza metabolica decompensata
HCO3 = 24
H2CO3 = 2,9
HCO3/H2CO3 = 8,2/1
pH = 7,1
pCO2 = 62
R: acidoza respiratorie decompensata
HCO3 = 24
H2CO3 = 2,95
HCO3/H2CO3 = 8,7/1
pH = 6,66
pCO2 = 86
R: acidoza respiratorie decompensata
HCO3 =
15
pH de
calculat = 7,15 + 0,15 = 7,30
pCO2 =
(1,5 X 15) + 8 = 30,5
HCO3 a
scazut de la 22 la 15, cu 7
R: acidoza metabolica decompensata
HCO3 = 20
pH de calculat = 7,20 + 0,15 =
7,35
pCO2 = (1,5 X 20) + 8 = 38
HCO3 a
scazut de la 22 la 20, cu 2, deci pCO2 poate sa scada cu 2 sau 2 X
1,3 = 2,6
R : acidoza
metabolica, compensata respirator
HCO3 = 15
pH = 7,30
pCO2 = 37
pCO2
trebuia sa scada cu 40-7 sau cu 40 - 7 X 1,3, dar are valoarea de 37, crescuta,
deci este acidoza respiratorie
R : acidoza
metabolica+acidoza respiratorie
HCO3 = 15
pH = 7,38
pCO2 = 24
pCO2
trebuia sa scada cu 40-7 sau cu 40 - 7 X 1,3, dar are valoarea de 24, crescuta,
deci este alcaloza respiratorie
R : acidoza metabolica + alcaloza respiratorie
pH-ul nu are
valoare diagnostica (are valoare diagnostica numai cand avem 2 acidoze sau 2
alcaloze nu si la alcaloza+acidoza)
HCO3 =
37
pH de
calculat 7,37 + 0,15 =
7,52
pCO2 de
calculat =40 + 13 sau
+6,5 = 53 sau 46,5
R : alcaloza
metabolica decompensata
HCO3 =
30
pH de
calculat 7,30 + 0,15 =
7,45
pCO2 =
46
R : alcaloza metabolica, compensata respirator
HCO3 = 37
pH = 7,40
pCO2 = 61
R : alcaloza metabolica + acidoza respiratorie
pH-ul nu are valoare diagnostica
pCO2 = 76 a crescut cu 36
HCO3 = 28 trebuia sa creasca, cu 3,6
pH = 7,34
H= 20
R : acidoza respiratorie acuta decompensata
pCO2 = 60 a crescut cu 20
HCO3 = 26 trebuia sa creasca, cu 2
pH = 7,35
H= 24
R : acidoza
respiratorie acuta compensata
pCO2 = 80 a crescut cu 40
HCO3 = 34 trebuia sa creasca, cu 4; 24+4=28
pH = 7,37
H= 27
R: acidoza respiratorie acuta + alcaloza metabolica
pH-ul nu are valoare diagnostica
pCO2 = 65 a crescut cu 25
HCO3 = 34 trebuia
sa creasca, cu 2,5 ; 24+2,5=26,5
pH = 7,28
H= 29
R: acidoza respiratorie acuta + acidoza metabolica
pCO2 = 70 a crescut cu 30
HCO3 = 34,5 (24+ 3X3,5 = 34,5)
pH = 7,34
H = 249
NH4 = 219
R: acidoza respiratorie cronica compensata
pCO2 = 75 a crescut cu 35
HCO3 = 37 (24+ 3,5X3,5 = 36,25)
pH = 7,34
H = 200
R: acidoza respiratorie cronica decompensata
pCO2 = 68 a crescut cu 28
HCO3 = 20 (24+ 2,8X3,5 = 33,8)
pH = 7,24
H = 200
R: acidoza respiratorie cronica + acidoza metabolica
pCO2 = 68 a crescut cu 28
HCO3 = 44 (24+ 2,8X3,5 = 33,8)
pH = 7,40
H = 200
R: acidoza respiratorie cronica + alcaloza metabolica
pH-ul nu are valoare diagnostica
pCO2 = 20 a scazut cu 20
HCO3 = 18 (22 - 2x2 = 18)
pH = 7,48
H = 25 - normal pt ca nu a aparut compensarea renala
R : alcaloza respiratorie acuta decompensata
pCO2 = 30 a scazut cu 10
HCO3 = 20 (22 - 2x1 = 22)
pH = 7,45
H = 20
R : alcaloza respiratorie acuta compensata
pCO2 = 20 a scazut cu 20
HCO3 = 13 (22 - 2x2 = 18)
pH = 7,38
H = 20
R: alcaloza respiratorie + acidoza metabolica
pH-ul nu are valoare diagnostica
pCO2 = 20
HCO3 = 32
pH = 7,52
H = 18
R: alcaloza respiratorie + alcaloza metabolica
pCO2 = 20 a scazut cu 20
HCO3 = 12 (22 - 5X2 = 12)
pH = 7,45
H = 0,2
R: alcaloza respiratorie cronica, compensata
pCO2 = 30 a scazut cu 10
HCO3 = 18 (22 - 5X1 = 17)
pH = 7,46
H = 0,3
R: alcaloza respiratorie cronica decompensata
pCO2 = 20 a scazut cu 20
HCO3 = 24 (22 - 5X2 = 12)
pH = 7,5
H = 0,1
R: alcaloza respiratorie conica + alcaloza metabolica
pCO2 = 20 a scazut cu 20
HCO3 = 8 (22 - 5X2 = 12)
pH = 7,38
H = 0,1
R: alcaloza respiratorie cronica + acidoza metabolica
pH-ul nu are valoare diagnostica


