DETERMINAREA POTENTIALULUI
STANDARD DE ELECTROD
Principiul lucrarii:
La limita de separare dintre metal si
electrolit apare o
diferenta de potential, care poarta denumirea de potential de electrod si se
noteaza cu litera φ sau є.
Potentialul de electrod depinde atat de natura metalului, cat si de
natura si concentratia solutiei de electrolit. Electrozii pot fi
reversibili si ireversibili.
Electrozii reversibili sunt caracterizati de reactii de
echilibru la interfata metal /solutie de electrolit. Mecanismul
aparitiei potentialului de electrod (de echilibru) se explica
prin tendinta spontana a metalelor de a transmite ioni in
solutie si a ionilor metalici din solutie de a se depune pe
metal. Metalele care trimit
ioni pozitivi in solutie se incarca negativ, iar cele pe care se
depun ionii metalici pozitivi din solutie se incarca pozitiv. Prin
urmare, solutia ramane cu un exces de sarcini pozitive in primul caz
si negative in cel de-al doilea, iar la suprafata metal-solutie
se formeaza un dublu strat electric. Conform conventiei Europene, cu
care lucram, se atribuie electrodului M/solutie de electrolit
polaritatea metalului.
Potentialul standard de electrod reprezinta potentialul de echilibru al sistemului
metal-solutie de electrolit ce contine ionii sai, cu activitatea
egala cu unitatea (a=1), la temperatura de 250C si
presiunea de 1 atm. Potentialul
de electrod al unui metal este dat de relatia lui Nernst:
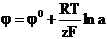 (3.29.1)
(3.29.1)
unde:
R - constanta universala a gazelor (8,3166
J/mol K)
T- temperatura absoluta (K)
F - numarul lui Faraday (96500 C)
z - numarul de electroni implicati in
reactia de ionizare a metalului
a - activitatea ionilor metalului in
solutie
Pentru a= 1, 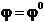 si potentialul de electrod devine egal
cu potentialul standard.
si potentialul de electrod devine egal
cu potentialul standard.
Valoarea
absoluta a potentialului de electrod nu poate fi determinata, de
aceea se alege in mod arbitrar un electrod al carui potential
standard 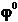 sa fie considerat egal cu zero. Acesta
este electrodul normal de hidrogen.
sa fie considerat egal cu zero. Acesta
este electrodul normal de hidrogen.
In
practica, electrodul de hidrogen este incomod de utilizat si de aceea
se utilizeaza asa-numitii electrozi de referinta,
electrozi care au potential de electrod cunoscut si constant in timp.
Asociind electrodul de studiat cu un electrod de referinta se
realizeaza un element galvanic a carui t.e.m. se determina.
Stiind ca: 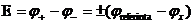 si cunoscand
si cunoscand 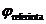 se poate calcula
se poate calcula 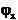
Scopul lucrarii: in aceasta lucrare se
determina potentialul standard de electrod al Zn si Cu,
utilizand ca electrod de referinta electrodul de calomel - 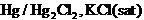 - al
carui potential in raport cu electrodul standard de hidrogen este
- al
carui potential in raport cu electrodul standard de hidrogen este 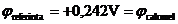
Aparatura si substante:
Aparatura: electrod de calomel, Zn, Cu
si voltmetru electronic
Substante: solutii de 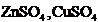 (1M)
(1M)
Modul de lucru:
Se vor alcatui doua elemente galvanice:
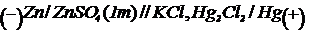
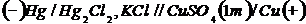
- se introduc placutele de Zn,
respectiv de Cu in paharul Berzelius, care contine solutia de ZnSO4,
respectiv CuSO4 1M;
- cu ajutorul unei fasii de hartie de
filtru imbibata cu solutie de KCl se realizeaza legatura
intre solutia saturata de KCl in care este cufundat electrodul de
calomel si solutia de ZnSO4
sau CuSO4 in care este cufundata placuta de Zn,
respectiv placuta de Cu ;
- tensiunea electromotoare a elementului galvanic astfel obtinut se
masoara direct prin conectare la voltmetrul electronic.
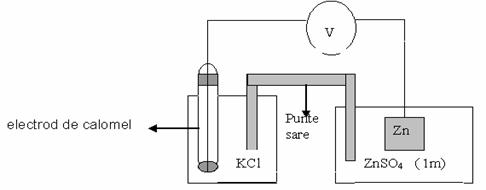
Fig. 3.29.1. Element
galvanic
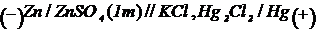
Tinand seama de semnul
electrozilor implicati vom avea:
pentru primul element galvanic: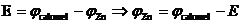
pentru cel de al doilea element
galvanic 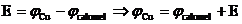
Zn tab = - 0,763V; Cu tab = + 0,34 V
Calcule si rezultate:
Se va alcatui urmatorul tabel:
Tabelul
3.29.1
|
Pila
electrica
|
E(V)
Exp
|
(V)
calc.din
E exp.
|
0
(V)
seria Volta
|
(V)
|
|

|
|
|
|
|
|
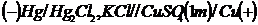
|
|
|
|
|
Tema:
Sa se scrie reactiile de echilibru la
interfata Al /Al2 (SO4)3,
Ni /NiCl2, Ag/AgNO3
Sa se determine potentialul standard al
plumbului, daca se cunoaste t.e.m. a pilei galvanice:
(-)Pb/Pb(NO3)2
0,01M//KCl, Hg2Cl2/Hg(+) este egala cu 0,469V,
coeficientul de activitate (f) al solutiei de Pb(NO3) este egal
cu 0,53, iar potentialul electrodului de referinta este egal
cu 0,242V.
Sa se determine activitatea
ionilor de cupru din solutia de CuSO4 din pila galvanica:
Cu/CuSO4 //KCl, Hg2C2/Hg, care la 20 oC are o tensiune
electromotoare E =0,04 V, potentialul electrodului de calomel jcal = 0,244V, iar potentialul standard al
cuprului este j Cu = 0,34V.
. Sa se calculeze potentialul
electrodului format din cupru imersat intr-o solutie de 10-6 m ioni
de cupru monovalent, daca se cunoaste potentialul standard j Cu+/Cu=O,504V. Stiind ca electrodul de Cu este catod
in pila electrica cu un electrod de Zn si unul de Cu scrieti lantul
electrochimic al pilei ce se formeaza.
. Sa se calculeze tensiunea electromotaoare
standard a unei pile cu un electrod din Al si altul din Ni. Scrieti lantul
electrochimic al pilei astfel formate.( j Al3+/Al = -1,69V, j Ni +/Ni= -0,250 V)
Se dau urmatorii electrozii si
potentiale relative de electrod: Fe/FeSO4(-0,43 V), Hg/Hg2Cl2/KCl
(+242 mV),Ag/AgCl (0,8V). Scrieti lantul electrochimic al pilelor pe
care le puteti forma cu acesti electrozi, si precizati in
fiecare caz, tem a pilei.


