DETERMINAREA POTENTIALULUI DE COROZIUNE
Principiul lucrarii:
Se defineste drept electrod sistemul electron neutru metal
/solutie de electrolit. Electrozii pot fi reversibili si
ireversibili. Electrozii reversibili sunt caracterizati de reactii de
echilibru la interfata metal /solutie de electrolit. Cand
solutia reprezinta un mediu coroziv reactiile la interfata
metal /solutie de electrolit sunt ireversibile. Ca urmare a
desfasurarii simultane a proceselor de ionizare a metalului
(procese anodice) si depolarizarii,
reducerii agentilor corozivi din solutia de electrolit (procese
catodice) pe aceeasi suprafata metalica, la interfata
metal/mediu coroziv apare spontan o diferenta de potential
numita potential de coroziune.
Procesul global al
coroziunii cu depolarizare de hidrogen/oxigen se obtine prin insumarea
algebrica a reactiilor de ionizare a metalului (oxidare) si a
reactiei de depolarizare (reducere) a ionilor sau moleculelor din mediul
coroziv.
Reactiile chimice in coroziunea cu depolarizare de hidrogen sunt:
In
medii acide
|
exemplu
|
|
(-) M M+z + ze-;
Reactie de ionizare a metalului (oxidare)
|
(-) Fe Fe+2 + 2e-
|
|
(+) zH++ze-
z/2H2; Reactie
de depolarizare (reducere)
|
(+) 2H+ + 2e- H2
|
|
M+ zH+ M+z + z/2 H2; Reactie globala
|
Fe + 2H+ Fe+2 + H2
|
In medii neutre
si alcaline
|
exemplu
|
|
(-) M M+z + ze-; Reactie de ionizare a
metalului (oxidare)
|
(-) Fe Fe+2 + 2e-
|
|
(+) zH2O+ze zOH-+z/2H2;
Reactie de depolarizare (reducere)
|
(+) 2H2O+2e- 2OH-+ H2
|
|
M + zH2O M+z + zOH- +
z/2 H2 Reactie globala
|
Fe + 2H2O Fe+2 + 2OH- +
H2
|
Reactiile chimice in coroziunea cu depolarizare de oxigen sunt:
In medii acide
|
exemplu
|
|
(-) M M+z +ze- Reactie de ionizare a
metalului (oxidare)
|
Fe Fe+2 + 2e
|
|
(+) zH++z/4O2
+ze- z/2H2O;
Reactie de depolarizare (reducere)
|
(+) 2H++1/2 O2
+2e- H2O
|
|
M+ zH++z/4O2 M+z +z/2H2O;
Reactie globala
|
Fe+ 2H++1/2 O2
Fe+2 +2H2O
|
In
medii neutre si alcaline
|
exemplu
|
|
(-) M M+z +ze-; Reactie de ionizare a
metalului (oxidare)
|
Fe Fe+2 + 2e-
|
|
(+) z/2 H2O +z/4O2+ze zOH-; Reactie de depolarizare
(reducere)
|
(+) H2O +1/2O2+2e- 2OH
|
|
M+z/2 H2O +z/4O2 M(OH); Reactie globala
|
Fe+ H2O +1/2O2
Fe(OH)2
|
Supratensiunea se defineste matematic
astfel: 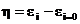 (8.6)
(8.6)
unde i este potentialul electrodului metalic
strabatut de un curent electric (curent de descarcare, curent de
electroliza, curent de coroziune), iar i=o reprezinta potentialul de coroziune in
circuit deschis, i=0.
In cazul coroziunii electrochimice : i= cor si i=o o sau i=o o
Intre potentialele de electrod (de echilibru) si
potentialul de coroziune la care se desfasoara simultan
procesul anodic sau catodic al metalului, exista relatiile:
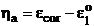 (8.7)
(8.7)
 (8.8)
(8.8)
in care: a - supratensiunea anodica ( a>0), iar c - supratensiunea catodica( c<0)
Potentialul de coroziune si supratensiunea depind de natura
chimica si starea suprafetei metalului, de natura
chimica si pH-ul mediului coroziv.
Scopul lucrarii
Se va determina potentialul de coroziune si se vor calcula
supratensiunea anodica si catodica pentru Fe, Zn, Al supuse
coroziunii in mediu acid (solutie H2SO4), in mediu
bazic (solutie NaOH) si in mediu neutru (solutie NaCl).
In general in mediu acid are loc
coroziunea cu depolarizare de hidrogen, iar in mediul neutru si alcalin -
coroziunea cu depolarizare de oxigen.
Aparatura si
substante: cuve cu solutii de acid sulfuric, hidroxid de sodiu si
clorura de sodiu, electrozi de fier, zinc, aluminiu, instrument de
masura.
Modul de lucru:
Se curata placutele metalice (electrozii) cu
hartie metalografica inaintea fiecarei masuratori. Se
alcatuiesc pile galvanice in care un electrod este metalul introdus in
mediul coroziv, iar celalalt electrodul de referinta:
(-) Me/H2SO4//electrod de
referinta (+)
(-) Me/NaOH//electrod de referinta (+)
(-) Me/NaCl//electrod de referinta (+)
Ca electrod de referinta se poate folosi electrodul de Cu/CuSO4(1N),
cu 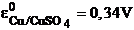
Electrodul de referinta se conecteaza la bornele instrumentului
de masura a tensiunii electromotoare si se noteaza valoarea
t.e.m. indicata de afisajul electronic dupa doua minute cand se
considera ca a atins o valoare relativ constanta.
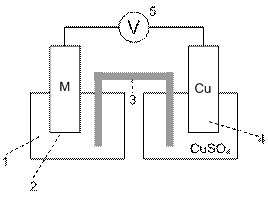
Fig. 8.3. Schema instalatiei pentru
determinarea potentialului de coroziune
1 - celula
electrolitica
2 - M - Zn, Al sau Fe
3 - punte
electrolitica
4 - electrod de Cu/CuSO4
5 - multimetru
Rezultate:
Se calculeaza
potentialul de coroziune stiind ca tensiunea electromotoare
masurata este diferenta dintre potensialul catodului
si cel al anodului:
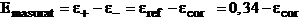 (8.9)
(8.9)
Supratensiunea
se calculeaza pentru fiecare caz folosind relatiile (8.7) si
(8.8).
Se cunosc
urmatoarele valori ale potentialelor standard de electrod: 
Tabel 8.2 Prelucrarea
rezultatelor experimentale
Nr.
|
Pila de coroziune
|
Emas.
(V)
|
cor
(V)
|
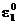 (V) (V)
|
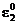 (V) (V)
|
a
(V)
|
c
(V)
|
|
(-)Fe/H2SO4//CuSO4/Cu +)
|
|
|
|
|
|
|
|
(-)Zn/H2SO4//CuSO4/Cu (+)
|
|
|
|
|
|
|
|
(-)Al/H2SO4//CuSO4/Cu
(+)
|
|
|
|
|
|
|
|
(-) Fe/NaOH//CuSO4/Cu (+)
|
|
|
|
|
|
|
|
(-)Zn/NaOH//CuSO4/Cu (+)
|
|
|
|
|
|
|
|
(-)Al/NaOH//CuSO4/Cu (+)
|
|
|
|
|
|
|
|
(-)Fe/NaCl//CuSO4/Cu (+)
|
|
|
|
|
|
|
|
(-)Zn/NaCl//CuSO4/Cu (+)
|
|
|
|
|
|
|
|
(-)Al/NaCl//CuSO4/Cu (+)
|
|
|
|
|
|
|
Interpretarea rezultatelor:
Se vor face observatii comparand
potentialul de coroziune in diferite medii corozive urmarindu-se daca
ecor are valori intre
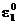 si
si 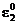 .
.
Tema:
Sa
se scrie reactiile care intervin in procesul de coroziune al
urmatoarelor metale: Ni (bivalent), Al (trivalent), Sn (tetravalent), atat
in mediu acid, cat si in mediu neutru si alcalin.
. In
urma coroziunii unui otel aliat, introdus intr-o solutie de pH 3,5 se
degaja un volum de 1mL H2 masurat in conditii
normale. Sa se scrie reactiile chimice care au loc si sa se
calculeze masa de Fe corodata.
In urma
coroziunii unei bare de zinc intr-o solutie de NaOH 3N s-au degajat 2,2 mL
H2 (c.n). Sa se scrie ecuatia reactiei globale de
coroziune si sa se calculeze cantitatea de zinc corodata. (MZn = 64)
Reactiile care au loc la coroziunea Al in mediu basic sunt: a) Al3+
+ 3e Al, b)H+
+ 1e 1/2H2,
c) 2OH- -2e H2O+
1/2O2 , d) Al
Al3+ + 3e, e)1/2O2 + H2O + 2e 2OH-
.
Calculati suparatensiunile anodice si catodice stiind ca potentialul de
coroziune al Al este -1,69V. Scrieti reactiile ce au loc la cufundarea Al in
mediu neutru si in mediu acid.
. Ce
cantitate de Fe(OH)2 se obtine in urma coroziunii a 112 g Fe in mediu neutru. Scrieti reactia
globala de coroziune (prin insumarea reactiei anodice cu cea catodica).
MFe= 56 g



