Terminologia utilizata in termotehnica
1. Sisteme termodinamice.
Clasificare
Prima
etapa in desfasurarea unei analize termodinamice consta in
precizarea entitatii
ce urmeaza a fi
supusa cercetarii, respectiv precizarea sistemului termodinamic. Sistemul termodinamic reprezinta
un domeniu finit din spatiu delimitat de corpurile inconjuratore
printr-o suprafata reala sau imaginara numita frontiera sistemului. Tot ceea ce se
afla in afara frontierei sistemului selectat, dar in imediata
apropiere si in posibila interactiune cu acesta, constituie
mediul inconjurator sau mediul ambiant. Ca o observatie, se
spera utila, trebuie subliniat faptul ca frontiera fiind o
suprafata, deci de grosime zero, nu poate contine materie. Ca
exemplu se considera un gaz inchis intr-un cilindru obturat etans de
un piston. Daca frontiera coincide cu suprafata interioara a
cilindrului si a pistonului, atunci sistemul termodinamic contine
doar gazul din interior. Daca frontiera este plasata in exteriorul
cilindrului, sistemul este reprezentat de gaz dar si de peretii
cilindrului care-l contin.
Dupa natura interactiunilor dintre sistem
si mediul sau exterior sistemele pot fi : inchise, deschise si
izolate.
Sistemele
termodinamice inchise sunt sistemele a caror frontiera nu permite
schimbul de materie cu mediul exterior. Totusi, prin frontiera sistemului
poate fi transferata energie sub forma de caldura si
lucru mecanic. Frontiera poate fi rigida, lucrul mecanic schimbat cu
exteriorul fiind nul, sau deformabila, diaterma sau adiabatica
in functie de permeabilitatea pe care o prezinta la transferul de
caldura. In exemplul prezentat mai sus, gazul din interiorul
cilindrului constituie un sistem termodinamic inchis, frontiera fiind
reprezentata de suprafata interioara a cilindrului. Prin
intermediul pistonului mobil si a peretilor cilindrului se poate
transfera energie sub forma de caldura.
Sistemele
termodinamice izolate au frontierele impermeabile la schimbul de energie
si substanta. Un exemplu sugestiv de sistem izolat este cel
considerat anterior la care impunem suplimentar conditia frontierei
nedeformabile - piston blocat, pereti rigizi- si conditia de
frontiera adiabatica, fara schimb de caldura cu
exteriorul. si lucru mecanic.
Sistemele
termodinamice deschise sunt
sistemele ale caror frontiere pot fi traversate de un flux de materie, in
general un fluid - gaz sau lichid ; frontierele unor astfel de sisteme nu
isi modifica pozitia in timp ( in sensul ca nu sunt
deformabile), astfel incat ele includ un volum constant. Pentru sistemele
termodinamice deschise se utilizeaza o terminologie speciala: volum
de control pentru sistemul propriu-zis, suprafata de control pentru
frontiera sistemului, iar pentru portiunile de frontiera traversate
de fluxul de materie termenul utilizat
este porti de intrare respectiv de iesire.
Exemplu - Motorul termic poate fi considerat , in
diferite faze de functionare, ca un sistem deschis sau inchis. Astfel, in
decursul fazei de comprimare si destindere a gazului din interiorul
cilindrului, cand ambele supape sunt inchise, sistemul poate fi considerat
inchis, iar in decursul admisiei si evacuarii cand sunt deschise alternativ
supapa de admisie, respectiv de refulare, sistemul este inchis.
Compozitia si proprietatile fizice
pot constitui un alt criteriu de clasificare. Astfel, din acest punct de
vedere, sistemele pot fi omogene si eterogene.
Sistemele
termodinamice omogene sunt sistemele ale caror
compozitie chimica si proprietati fizice sunt
aceleasi oriunde in interiorul sistemului sau variaza continuu,
fara salturi, de la un punct la altul. Sistemele omogene pot fi reprezentate
de o substanta pura sau de un amestec de mai multe
substante pure. Exemplu - coloana de aer care se incalzeste
la partea inferioara. Ca urmare a actiunii greutatii,
compozitia si proprietatile fizice variaza continuu de
la un punct la altul. La partea inferioara predomina gazele mai
grele.
Sistemele eterogene
sunt sistemele constituite din doua sau mai multe faze, adica din
doua sau mai multe zone omogene diferite. La limita dintre faze
proprietatile fizice si eventual compozitia pot varia
brusc. Exemplul 1: cazan de abur in interiorul caruia se formeaza un
amestec bifazic de apa lichida care fierbe si abur saturat; cele
doua faze, lichida si gazoasa, au aceeasi
compozitie chimica, H2O, dar proprietatile
fizice sunt total diferite. Exemplul 2: vas ce contine un amestec de
mercur, apa si ulei. Cele trei faze distincte se delimiteaza
clar datorita densitatii diferite a celor trei substante
constituente. De aceasta data, fazele difera atat prin
proprietati fizice cat si prin compozitia chimica.
Toate sistemele termodinamice constituite dintr-o substanta
pura sau un amestec se pot afla in trei stari fizice distincte:
gazoasa, lichida sau solida. Daca ne referim la o
substanta chimic pura, prin fazele ei se intelege , in
general, starile fizice ale substantei.
Starea sistemului termodinamic. Parametrii de stare.
Situatia
in care se gaseste sistemul la un moment dat este denumita starea sistemului;
ea este descrisa de
un ansamblu de proprietati fizice numite marimi de stare. Trebuie subliniat faptul ca nu toate
marimile care intervin in analiza termodinamica reprezenta
marimi de stare ci doar acelea a caror valoare numerica depinde
strict de situatia in care se gaseste sistemul la un moment dat,
fiind independenta de trecutul sistemului.
Din categoria marimilor de stare fac
parte parametrii de stare si functiile de stare. Parametrii de
stare sunt marimi fizice direct masurabile cum ar fi presiunea,
volumul, temperatura. Functiile de stare sunt determinate prin calcul pe
baza masuratorilor efectuate asupra parametrilor de stare. Energia
interna, entropia, entalpia sunt functii de stare.
Marimile
de stare ale caror valori sunt proportionale cu cantitatea de
substanta din interiorul sistemului se numesc marimi extensive
si sunt notate cu majuscule ( volumul ocupat de 10 kg de
substanta este de 0 ori mai mare decat cel ocupat de un kg din acea
substanta, in aceleasi conditii de presiune si
temperatura). In practica adesea marimile extensive sunt
raportate la unitatea de cantitate obtinandu-se marimi specifice
masice sau marimi specifice molare dupa cum cantitatea de
substanta este exprimata in kg sau kmol (v = V/m [m3/kg],
v fiind volumul specific).
Marimile de stare intensive sunt independente de cantitatea de
substanta din interiorul sistemului. Presiunea, temperatura sunt
exemple de astfel de marimi intensive.
Starea de echilibru reprezinta situatia in care sistemul este caracterizat atat de
mentinerea constanta a tuturor marimilor sale de stare cat
si de absenta oricarui flux energetic sau de masa in
interiorul sistemului sau pe frontiera. Atingerea si mentinerea
starii de echilibru presupune indeplinirea conditiilor de echilibru
mecanic (presiune uniforma in interiorul sistemului si egala cu
presiunea mediului exterior), echilibru termic (temperatura uniforma
in interiorul sistemului si egala cu temperatura mediului exterior)
si echilibru chimic (caracterizat de faptul ca in interiorul
sistemului nu au loc reactii chimice, nici transfer de substanta
datorat unor diferente de concentratie). Importanta starii de
echilibru deriva din faptul ca un sistem termodinamic aflat la
echilibru prezinta un set de proprietati fixe, invariabile in timp, care pot fi
masurate cu precizie; in plus, in aceasta situatie marimile
de stare au o valoare unica in intreg sistemul.
Termodinamica
clasica studiaza sistemele aflate in echilibru termodinamic.
Procese termodinamice
Trecerea
sistemului dintr-o stare in alta se numeste proces termodinamic sau transformare
termodinamica. Traiectoria procesului reprezinta succesiunea de
stari prin care sistemul trece de din starea initiala in starea
finala. Cunoasterea procesului presupune atat cunoasterea starii finale cat si a schimburilor energetice sau de
substanta efectuate cu mediul exterior.
Procesele termodinamice sunt caracterizate si prin
asa numitele marimi de proces
(caldura si lucrul mecanic transferate intre sistem si mediul
exterior) care depind nu numai de starile extreme ci si de natura
procesului, respectiv de modul in care se face trecerea din starea
initiala in starea finala. Diferenta intre marimile de
stare si cele de proces este sugerata atat de terminologia
utilizata cat si de notatiile aplicate celor doua categorii
de marimi. Astfel, se vorbeste de variatia unei marimi de
stare in timpul unui proces termodinamic si respectiv de cantitatea unei
marimi de proces implicate in evolutia respectiva (cantitatea de
caldura, cantitatea de lucru mecanic). Din punct de vedere matematic,
marimile de stare admit diferentiale totale exacte, pentru care se
foloseste semnul "d" (dV, dp) ce exprima variatia infinitezimala a marimii respective in
decursul unui proces elementar (cu starile extreme foarte apropiate). In
cazul marimilor de proces, semnul utilizat este "d" si
reprezinta nu variatia marimii ci chiar valoarea (cantitatea)
elementara a marimii respective (dQ, dL).
Pentru o transformare finita 1-2,
variatia totala a unei marimi de stare si cantitatea
marimii de proces se determina prin integrare. Spre exemplu pentru
variatia de energie interna si pentru cantitatea de
caldura schimbata cu exteriorul relatiile de calcul sunt:
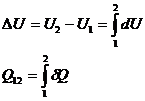
In
functie de pozitia relativa a starilor initiala
si finala procesele termodinamice sunt inchise (starea
initiala coincide cu starea finala) si deschise (
starile initiala si finala sunt distincte). Procesele
inchise repetate periodic poarta numele de cicluri termodinamice.
Procesul in decursul caruia sistemul parcurge o
succesiune de stari de echilibru, de fapt stari foarte aproape de
echilibru, se numeste proces de echilibru sau proces cvasistatic. Trecerea
sistemului dintr-o stare in alta presupune existenta unui dezechilibru
intern sau extern. In conditiile in care nivelul acestui dezechilibru este
foarte mic, infinitezimal, starile succesive parcurse de sistem pot fi
considerate stari de echilibru. Exemplu. Sistemul este reprezentat de un
gaz inchis intr-un cilindru cu piston. Pe suprafata exterioara a
pistonului se exercita o presiune a carei valoare trebuie sa o
depaseasca pe cea a presiunii gazului din interiorul cilindrului
pentru a se realiza comprimarea. Pe masura ce pistonul se
deplaseaza in interiorul cilindrului, straturile de gaz din imediata
apropiere a acestuia sunt primele comprimate. Energia cinetica a acestor
straturi ce se deplaseaza este consumata pentru invingerea
fortelor de frecare manifestate intre particule si intre particule si
peretii cilindrului. In urma comprimarii presiunea din aceasta
zona devin mai mare decat presiunea medie din interiorul cilindrului.
Aceasta perturbatie se propaga in intreg volumul, cu o
viteza bine determinata, respectiv viteza sunetului in mediul considerat,
si nu instantaneu. Intre timp, pistonul si-a modificat din nou
pozitia si straturile de gaz limitrofe sunt suplimentar comprimat. In
decursul comprimarii lipseste atat echilibru intern (in interiorul
gazului presiunea fiind diferita de la un punct la altul), cat si cel
extern ( presiunea exterioara aplicata pistonului este mai mare decat
presiunea medie din interiorul cilindrului). Cu cat diferenta dintre
presiunile exercitate pe cele doua fete ale pistonului este mai mare
cu atat viteza de desfasurarea a procesului de comprimare este mai
mare si gradul de dezechilibru este mai ridicat. In cazul expus,
comprimarea este un proces de neechilibru sau nonstatic.
In conditiile in care presiunea exterioara este
cu putin mai mare decat presiunea gazului din interiorul cilindrului,
viteza de deplasare a pistonului este foarte mica si diferentele
de presiune din interior sunt nesemnificative. Procesul de comprimare se
apropie de un proces de echilibru.
In lipsa altor precizari, prin proces termodinamic
se va intelege un proces de echilibru. Doar un astfel de proces poate fi
reprezentat in planul unei diagrame, sistemul fiind caracterizat de
parametrii de stare uniformi.