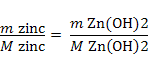Fluxul
procesului de tratare a epelor reziduale din industria mecanica
In procesul de tratare a apelor
uzate industriale incarcate cu metale grele (cupru, zinc, fier, plumb) se urmareste scaderea concentratiei
metalelor grele din apa sub limita admisa de legile aflate in
vigoare.
In figura 24 este detaliat fluxul
procesului de tratare a apei reziduale.
Fig.24. Fluxul tehnologic in procesul de tratare al
apelor uzate incarcate cu metale grele
H2O


 NaOH H2SO4
NaOH H2SO4

Apa epurata pentru recirculare
|
|
piese brute

 H2O
H2O
namol uscat
emisar
1.Continutul de metale grele
in apa uzata
In procesul de tratare a apei
uzate se urmareste indepartarea cationilor metalelor grele prin precipitare
cu NaOH, conform ecuatiilor reactiilor chimice:
Cu2+ +2 NaOH = Cu(OH)2
+ 2 Na+
Zn2+ +2 NaOH = Zn(OH)2
+ 2 Na+
Fe2+ +2 NaOH = Fe(OH)2
+ 2 Na+
Pb2+ +2 NaOH = Pb(OH)2
+ 2 Na+
In aplicarea practica la SC
Romradiatoare SA s-a determinat o concentratie a ionilor de metale grele
de:
Cu2+ = 500 mg/20 m3
Zn2+ = 50.000 mg/20 m3
Fe2+ = 7000 mg/20 m3
Pb2+ = 750 mg/20 m3
Conform normativelor in vigoare
se urmareste reducerea concentratiei de ioni metalici la
valorile:
Cu2+ = 0,5 mg/dm3
Zn2+ 50 mg/dm3
Fe2+ = 7 mg/dm3
Pb2+ = 0,75 mg/dm3
2.Calculul cantitatii de namol rezidual
Conform reactiilor chimice ce au loc in procesul de tratare al apei
uzate se determina masele precipitatelor rezultate care se regasesc
in namolul rezidual:
MCu(OH)2 = ACu
+ 2×AO +2×AH
= 64 + 2×16 + 2×1
= 98
MZn(OH)2 = AZn
+ 2×AO +2×AH
= 65 + 2×16 + 2×1
= 99
MFe(OH)2 = AFe
+ 2×AO +2×AH
= 56 + 2×16 + 2×1
= 90
MPb(OH)2 = APb
+ 2×AO +2×AH
= 207 + 2×16 + 2×1
= 241
Pentru fiecare ecuatie a
reactiilor chimice se aplica bilantul de masa din care se
determina cantitatea de precipitat care se regaseste sub
forma de namol:
Cu2+ +2 NaOH = Cu(OH)2
+ 2 Na+
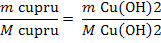
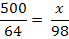
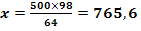 mg Cu(OH)2 / 20 m3 H2O (1)
mg Cu(OH)2 / 20 m3 H2O (1)
Zn2+ +2 NaOH = Zn(OH)2
+ 2 Na+
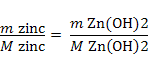
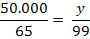
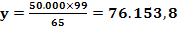 mg Zn(OH)2
/ 20 m3 H2O (2)
mg Zn(OH)2
/ 20 m3 H2O (2)
Fe2+ +2 NaOH = Fe(OH)2
+ 2 Na+
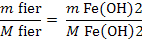
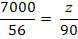
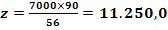 mg Fe(OH)2
/ 20 m3 H2O (3)
mg Fe(OH)2
/ 20 m3 H2O (3)
Pb2+ +2 NaOH = Pb(OH)2
+ 2 Na+
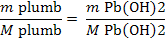
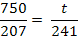
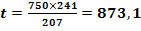 mg Pb(OH)2
/ 20 m3 H2O (4)
mg Pb(OH)2
/ 20 m3 H2O (4)
Masa totala de namol
rezidual rezultata in urma precipitarii metalelor grele este:
mnamol = x y z t
= 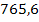 +
+ 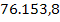 +
+ 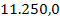 +
+ 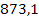
= 89.042,5 mg namol rezidual rezultat
Namolul rezidual rezultat
are o umiditate initiala de 40% care trebuie indepartata
prin uscare.
unamol = 40%
DH2O = 20 m3/h apa uzata
Fig. 25. Schita
procesului de uscare a namolului
H2O

 W= ?
W= ?
 namol umed
namol umed
 G= 89.042,5 mg
G= 89.042,5 mg
uinitiala=
40%

 namol uscat
namol uscat
F= ? ; ufinala = 2%
ui= umiditate initiala;
uf= umiditate finala;
G= masa de namol 40%;
W= masa de apa;
F= masa de namol 2%.
G = F + W
(6)
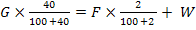
= F+ W
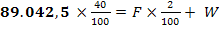
= F+ W
F = 34.526,6 mg
namol uscat 2%
= 34.526,6 + W
W = 54.515,8 mg H2O
rezultate prin uscarea namolului
Datorita faptului ca namolul uscat rezultat
are o umiditate de 2%, cantitatea de apa rezultata din namolul
uscat este reintrodusa in procesul de tratare al apei pentru
indepartarea continutului ridicat de metale grele:
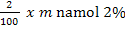
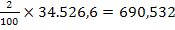 mg H2O reintrodusa in proces
mg H2O reintrodusa in proces
3.Calculul maselor de reactivi folositi
Cantitate de reactivi folositi in procesul de tratare a
apei este:
Cantitatea de H2O care iese practic din sistem
prin uscarea namolului si indepartarea cantitatii de
2% H2O, care este reintrodusa in procesul de tratare al apei
uzate este de:
mW
- mapa reintrodusa in proces
54.515,8 - 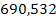 = 53.852,2 mg H2O rezultata la
uscarea namolului
= 53.852,2 mg H2O rezultata la
uscarea namolului
Cantitatea de reactiv, NaOH 15% (n) folosita in proces
conform reactiilor chimice este:
MNaOH = ANa + AO + AH
= 23 + 16 +
1
= 40
Cu2+ +2 NaOH = Cu(OH)2
+ 2 Na+
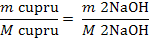
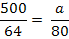
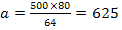 mg NaOH
reactionat cu Cu2+
(9)
mg NaOH
reactionat cu Cu2+
(9)
Zn2+ +2 NaOH = Zn(OH)2
+ 2 Na+
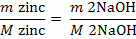
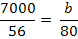
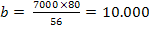 mg NaOH reactionat cu Fe2+ (10)
mg NaOH reactionat cu Fe2+ (10)
Fe2+ +2 NaOH = Fe(OH)2
+ 2 Na+
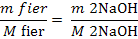
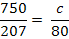
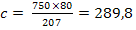 mg NaOH
reactionat cu Pb2+ (11)
mg NaOH
reactionat cu Pb2+ (11)
Pb2+ +2 NaOH = Pb(OH)2
+ 2 Na+
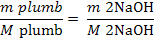
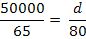
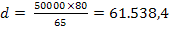 mg NaOH reactionat cu Zn2+ (12)
mg NaOH reactionat cu Zn2+ (12)
nNaOH = a b c d
= 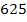 +
+ 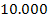 +
+ 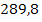 +
+ 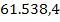
= 72.453,2
mg NaOH 15% folosita la tratarea apei uzate
Cantitatea de NaOH pur folosita la tratarea apei este
de:

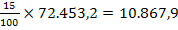 mg NaOH
pur
mg NaOH
pur
o = 72.453,2 - 10.867,9
= 61.585,2 mg H2O folosita la prepararea
solutiei de NaOH 15%
Pentru corectarea pH in procesul de tratare al apei se
foloseste o cantitate de 35 mg H2SO4 15% .
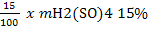
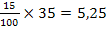 mg H2SO4 pur
mg H2SO4 pur
p = 35 - 5,25
= 29,75 mg H2O
folosita la prepararea solutiei de H2SO4 15%
In procesul de tratare a apei se folosesc de asemenea in
scopul precipitarii metalelor grele:
mfloculant = 1 mg
floculant folosit
mcoagulant = 1,9 mg coagulant folosit
4.Bilant H2O:
∑
mintrate = ∑ miesite
mintrataapa + mNaOH15%apa + mH2SO415%apa
= mieseapa + mnamolapa
V = 20 m3/ h H2O uzata
δH2O = 1000 kg/ m3
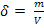 (17)
(17)
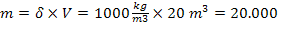 kg H2O
uzata
kg H2O
uzata
20.000.000 + 61.585,2
+ 29,75 = ? + 54.515,8
mg H2O care iese
din sistem
5.Eficienta indepartarii maselor de metale
grele
Eficienta
indepartarii metalelor grele prin
tratarea cu NaOH este :
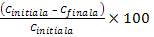 (18)
(18)
Concentratiile metalelor grele din apa uzata sunt:
Cu2+= 500 mg/ 20 m3
Zn2+= 50.000 mg/ 20 m3
Fe2+= 7.000 mg/ 20 m3
Pb2+= 750 mg/ 20 m3
Concentratiile metalelor grele dupa procesul de
tratare sunt:
Cu2+= 100 mg/ 20 m3
Zn2+= 500 mg/ 20 m3
Fe2+= 5.000 mg/ 20 m3
Pb2+= 200 mg/ 20 m3
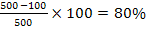 indepartare continut Cu2+
indepartare continut Cu2+
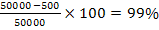 indepartare continut Zn2+
indepartare continut Zn2+
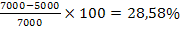 indepartare
continut Fe2+
indepartare
continut Fe2+
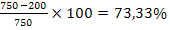 indepartare
continut Pb2+
indepartare
continut Pb2+
Confom reactiilor chimice s-a folosit o masa
practica de 72.453,2 mg NaOH, dar in procesul de tratare al apei uzate
incarcate cu metale grele se foloseste un exces de reactiv, masa
reala folosita fiind de 100.000,0 mg NaOH/ 20 m3 H2O.
6.Calculul bilantului total
Bilantul total al procesului de tratare al apei uzate
industriale este:
floculant coagulant




 NaOH
apa tratata
NaOH
apa tratata



 apa uzata
apa uzata


 namol
namol
H2SO4 reziduu
∑ mintrate =
∑ miesite
m NaOH + m H2SO4
+ m floculant + m coagulant + m apa uzata =
m apa tratata + m namol + m reziduu
72.453,2 + 35 + 1
+ 1,9 + 20.000.000 = 20007099,2 + + m reziduu
20.072.491,1= 20.096.141,7 + m reziduu
m reziduu = 23.650,6 mg reziduu depus in decantor
la tratarea apei
Calitatea apei tratata in statia de neutralizare a
apelor incarcate cu metale grele respecta toate legile de aceea ea
poate fi reintrodusa in procesul de fabricare al radiatoarelor.
De asemenea si namolul rezultat ca reziduu din
tratarea apei se incadreaza sub limitele de poluare asupra mediului, deci
se poate depozita in siguranta la groapa de gunoi.
In tabelul 10 sunt prezentate materiile prime necesare
procesului de tratare a apelor reziduale din industria de radiatoare.
Tabelul
10. Necesarul de materii prime folosite
|
Materiile prime folosite folositi
|
Cantitatea de materii prime folosite
mg/20 m3
|
|
NaOH
15%
|
|
|
H2SO4
15%
|
|
|
Floculant
|
|
|
Coagulant
|
|