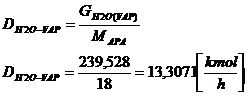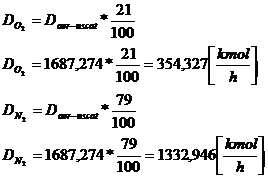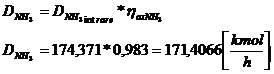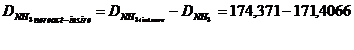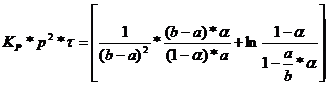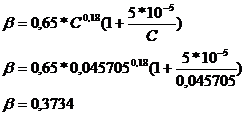TEMA DE PROIECT
Pentru x=1, y=0,001, z=0,001,
z`=0,001, u=0,001
Sa se dimensioneze o fabricaa de acid azotic cu o
capacitate de 100.000 + x tone /an. Se va folosi ca materie prima NH3
de concentratie 9 + y
Date - capaciatea fabricii = 100.003 tone/an
- concentratia HNO3= =
concentratia de NH3 = 9+0,3= 9,3 %
gradul de oxidare al NH3 la NO =
0,97+0,003=0,973
gradul de oxidare al NO la NO2 = 0,98+0,003=
0,983
gradul de oxidare al NO2
=0,99+0,003=0,993
I.BAZELE
TEORETICE ALE FABRICARII HNO3
Oxidarea
catalitica a amoniacului
Reactiile
principale sunt:
4NH3 +5O2
→ 4NO + 6H2O (1)
4NH3 +4O2 →
2N2O + 6H2O (2)
4NH3 +3O2 →
2N2 + 6H2O (3)
Reactii
secundare:
2NH3 → N2+
3H2 (4)
2NO → N2 +O2 (5)
4NH3 + 6NO → 5N2
+ 6H2O (6)
Echilibrul celor 3 reactii este
complet deplasat spre dreapta, ceea ce inseamna ca reactiile sunt ireversibile pentru
domeniul de temperatura 500-1000oC. Concluzia ar fi ca
amoniacul se poate transforma complet in produsi finiti.
Oxidarea amoniacului dupa
prima reactie se poate face cu ajutorul catalizatorilor. In domeniul de
temperatura 660-10000C catalizatorul folosit poate fi: platina
sau aliaje din platina.
Oxidarea catalitica a
amoniacului este un process ce consta din mai multe faze:
difuzia substantelor reactante la
suprafata catalizatorului
adsorbtia activa a O2
interactiunea chimica a moleculelor
activate adsorbite cu una sau mai multe
molecule aflate in stratul adsorbant
desorbtia produsilor de reactie
de la suprafata catalizatorului
difuzia produsilor de reactie in
volumul gazos
Pe suprafata
catalizatorului se mai formeaza si produsi intermediari.
Acestia pot fi: imida, diimida, amida, nitroxil, hidroxil
amina.
Gradul de transformare a
amoniacului in NO depinde de:
catalizatorii folositi
temperatura
compozitia amestecului gazos
viteza amestecului gazos
timpul de contact
presiunea
constructia aparatului de contact
Catalizatori folositi la oxidarea
NH3
a)
compozitia catalizatorilor
Se folosesc catalizatori platinici
cu urmatoarele caracteristici:
scumpi
selectivitate mare
activitate indelungata
stabilitate chimica ridicata
rezistenta mecanica buna
se aduc usor la temperatura de regim
permit obtinerea unui grad inalt de
transformare a NH3 in oxizi de azot
Catalizatorii din platina se folosesc sub forma de site
ceea ce duce la o suprafata mare a catalizatorului si la un
consum relativ mic de platina.
Gradul de transformare a NH3
in NO este influentat de numarul sitelor.
Presiunea atmosferica se
foloseste pentru 2-4 site catalitice, pentru o presiune de 5-7 atm se
folosesc 12 site iar pentru 8-9 atm se folosesc 18-20 site.
b) pierderile de catalizator si
recuperarea lor
Pierderile de catalizatori sunt pierderi mecanice sub
forma de pulbere si pierderi chimice sub forma de
compusi volatili ai platinei antrenati de gazele de reactie.
Pierderile de catalizator
sunt influentate de:
compozitia catalizatorului
temperatura de lucru
presiunea
durata de fictiune
forma catalizatorului
viteza curentului gazos
prezenta
impuritatil
Pentru un catalizator
de aceeasi compozitie pierderile sunt cu atat mai mari cu cat
temaperatura de contact este mai ridicata, creste cu marirea
presiunii amestecului gazos. Pierderile sunt foarte mari la primele si la
ultimele site.
Recuperarea platinei
prin aliere cu Ag depus intr-o masa de adsorbtie se foloseste la
o temperatura mai mica de 650oC.
Pentru recuperarea
platinei prin aliere cu Au sau Ag, gazele obtinute la oxidarea NH3
trec peste un strat care are Au sau aliaj bogat (600-700oC) apoi
peste un strat de Ag sau aliaj (500-600oC).
Randamentul de recuperare depinde de
numarul de site Au-Ag, la presiune mica pentru o singura sita
randamentul este de 60-70%, la presine medie pe doua site randamentul este
de 60-65%, la presiune ridicata pe 6-7 site randamentul este de 37-42%.
La recuperarea Pt cu vata de
sticla se folosesc filter cu vata se sticla asezate pe
conducta de evacuare a gazelor nitroase si pe conducta de acid.
Procedeul
Hereules-Beker foloseste o tesatura de sticla sau un
filtru ceramic pentru retinerea Pt din curentul gazos. Filtrele mecanice
retin 25-30%. Nu se folosesc la presiuni mari.
La recuperarea Pt cu var( procedeul DSW) se
foloseste un strat de CaO asezat dupa catalizator(
bucati de marmura de 3-5 mm sau 7-10 mm) avand un randament de
recuperare de 70-94%. Se foloseste CaO de inalta puritate avand un
randament de 90%. O tona de var poate retinepeste 3kg de Pt si
Pd .
c) otravirea si regenerarea sitelor de
catalizatori
In aerul enzimelor
se gasesc: acetilena, hidrogen fosfat, monoxid de carbon, vapori de
apa, praf (1,5-25,5 mg/m3). Acetilena si hidrogenul fosfat
otravesc catalizatorul ireversibil. CO creste temperatura panzei
catalitice si mareste coroziunea ei. Vaporii de apa nu
reduc activitatea catalitica dar maresc coroziunea.
NH3
sintetic poate avea impuritati mecanice, uleiuri lubrifiante,
substante rasinoase, grasimi.
Regenerarea se face
in functie de amestecul de aer-NH3. Pentru un sistem ce
lucreaza la presiuni mari regenerarea se face la 12-20 zile de
functionare, pentru un sistem ce lucreaza la presiunea
atmosferica regenerarea se face la 2-6 luni iar in cazul unei
purificari bune a gazului sitele se regenereaza o data pe an.
Regenerarea panzelor
se face in bai de cuart sau portelen, se spala cu apa
pentru indepartarea impuritatilor apoi se pun in solutie de
HCl 10-15% care se incalzeste la 60-80oC.
Conditii de temperatura
in procesului de oxidare catalitica a NH3
Ridicarea
temperaturii duce la cresterea grupei de transformare a NH3 in
NO. Odata cu cresterea temperaturii se formeaza pe suprafata
catalizatorului o cantitate mai mare de NO si selectivitatea oxidarii
se deplaseaza in sensul formarii NO. temperatura pana la care se
incalzeste catalizatorul in procesul de oxidare este direct
proportionala cu cantiatea de NH3 din amestecul gazos.
Δt= Q/mc
Q-caldura de
reactie, KJ
m-masa gaz dupa oxidarea
NH3
c-caldura specifica
medie a gazului
Cantitatea de
caldura care se degaja la oxidarea unui mol de NH3
este egala cu diferenta dintre caldura care se degaja la
oxidarea unui mol de NH3 pana la azot elementar si
caldura de formare a NO.
Compozitia amestecului gazos
supus oxidarii
a) capacitatea de explozie
Capacitatea de
explozie este capacitatea amestecurilor supuse oxidarii de a exploda
in contact cu o falcara la un anumit raport al compusilor.
Limita
inferioara de explozie este
concentratia cea mai mica in NH3 la care amestecul poate
exploda la aprindere.
Limita
superioara de explozie este continutul cel mai mare in NH3
la care amstecul mai are capacitatea de a exploda.
Limitele de explozie ale amestecului NH3-aer, NH3-O2
depind de:
forma si dimensiunea aparatului
temperatura si presiunea de lucru
directia flacarii NH3 care
se oxideaza
prezenta unor substante straine in
amestecul de gaze
La
amestecul NH3-aer limita superioara de exlozie este constanta pentru
presiunea de 1-2 atm si o concentratie a NH3 de 15%.
Viteza
reactiei de oxidare a NH3
Gradul de
transformare a NH3 in NO depinde si de viteza curentului gazos
sau de marimea inversa a timpului de contact.
Timpul de
contact se calculeaza:
τ=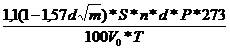 , s
, s
d-diametrul sitelor catalitice, cm
m-nr. de ochiuri, cm2
p-presiunea gaz, atm
V0- viteza volumetrica a gazului in
conditii normale, m2/s
T-temperatura contact , K
q la
presiune obisnuita:
τ=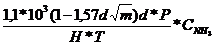
H-solicitarea catalizatorului, kgNH3/m2*24h
q la
presiune ridicata:
=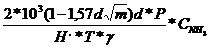
q sita
standard:
=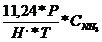
H,-solicitarea
catalizatorului, kgNH3/kg Pt*24h
γ-masa 1m2sita,
kg/m2
Practice se foloseste un timp
de contact mai mic (10-4, 10-3s) si o viteza a
curentului de gaz mai mare decat cea a gradului de transformare a NH3
in NO. Productivitatea aparatului creste cu scaderea timpului de
contact.
Prin solicitarea catalizatorului
se intelege cantitatea de NH3 oxidata in unitatea de timp pe
unitatea de suprafata sau pe unitatea de masa a sitelor
catalitice(kg/m2*24h sau kg/g*24h)
Cu cat creste solicitarea
catalizatorului , pentru aceeasi temperatura, gradul de transformare
scade.
Oxidarea
catalitica a oxidului de azot
Reactia
principala de oxidare a monoxidului de azot la bioxid de azot este:
NO+0,5O2↔NO2
Paralel cu acesta
reactie pot avea loc reactii de asociere a oxizilor de azot:
NO+ NO2↔N2O3
2NO2↔N2O4
Echilibrul procesului
Oxidarea
in faza gazoasa a NO la NO2 este o reactie
exoterma cu micsorare de volum iar echilibrul se va putea deplasa in
sens favorabil prin cresterea presiunii si scaderea temperaturii.
Viteza procesului
O
mare influenta asupra vitezei de oxidare o are solubilitatea celor
doi reactanti, determinata de concentratiile acestora in
faza gazoasa, de concentratia acidului azotic si de
temperatura
Reactiile
oxizilor de azot cu apa
2NO+H2O↔HNO3
N2O4+H2O↔
HNO3+ HNO2
N2O3+ H2O↔2HNO3
Reactiile oxizilor de azot cu
apa au loc in faza lichida, fiind precedate de o etapa de
transfer de masa si de reactiile de descompunere sau de oxidare
ale acidului azotos.
3HNO3↔HNO3+2NO+
H2O
4NO2+0,5O2↔HO3
II.STUDIUL COMPARATIV AL TEHNOLOGIILOR DE FABRICARE A HNO3
Orice tehnologie de obtinere a acidului azotic cuprinde obligatoriu
doua etape: obtinerea gazelor nitroase prin oxidarea amoniacului
si prelucrarea gazelor nitroase prin absorbtie, in acid azotic.
a) Instalatii
la presiune scazuta
Aceasta instalatie
prezinta avantajul realizarii oxidarii amoniacului in
conditii avantajoase, caracterizandu-se prin pierderi de platina
reduse.
Oxidarea si absorbtia
gazelor nitroase se desfasoara mai greu. Se obtine un acid de
concentratie redusa si gaze nitroase reziduale concentrate.
b)
Instalatii la presiuni moderate
Se utilizeaza o
presiune nominala ce
conduce la echilibrarea avantajelor si dezavantajelor provocate in cele 2
etape.
Cresterea presiunii
contribuie la cresterea productivitatii instalatiilor
si imbunatatirea schimburilor de caldura deci
posibilitatea de recuperare a acestora.
c)
Instalatii la presiune inalta
Oxidarea amoniacului are loc la
710 atm si o temperatura de 900-920oC.
Procedeul prezinta avantaje in partea
de prelucrare a gazelor nitroase, datorita vitezei mari a reactiilor
si a procesului de absorbtie. Se obsine un acid de
concentratie 60-65% HNO3 si gaze nitroase diluate sub
0,1%.
Un avantaj important este consumul
de energie scazut. Acest avantaj povine din eficienta recuperarilor de caldura
datorita presiunii ridicate a gazelor, ceea ce le confera o densitate
si o vascozitate mere deci un coefficient de transmitere a caldurii
ridicat.
d)
Instalatii la presiuni mixte
Avantajul acestor tehnologii
consta in valoarea cea mai potrivita a presiunii in fiecare etapa tehnologica, deci
realizarea oxidarii amoniacului cu randament ridicat si cu pierderi minime
de platina si obtinerea unui acid concentrat in utilajele de
inalta productivitate.
Dezavantajul principal al acestor instalatii consta in
etapa de comprimare a gazelor nitroase, turbocompresorul avand o
constructie pretentioasa datorita mediului coroziv in care
lucreaza.
Un alt dezavantaj il
reprezinta costul ridicat al comprimarii gazelor nitroase.
DESCRIEREA TEHNOLOGIEI GHIAP
Acest procedeu se
caracterizeaza prin utlizarea unui amestec aer-NH3 cu 10,2% NH3
si realizarea procesului de oxidare la presiunea atmosferica si
800oC utilizand catalizator platina-rodiu.
Oxidarea catalitica a
amoniacului are loc la presiunea atmosferica ceea ce permite
obtinerea unui randament de oxidare de 96,9% si un consum redus de
platina de 50 mg/t acid azotic 100%.
Oxidarea si absorbtia au
loc la o presiune de 3,5 atm ceea ce permite folosirea unei instalatii
compacte cu un randament de absorbtie de 99,45% si un continut
de oxizi de azot de 2000 ppm in gazele reziduale.
Comprimarea aerului si a
gazelor nitroase se face separate. Aerul se comprima cu ajutorul unei
turbosuflante iar gazele nitroase cu ajutorul unui turbocompresor. Pentru
recuperarea caldurii de reactie este necesar un cazan recuperator
care produce abur energetic de 40 atm si 450oC livrat in
sistemul platformei.
Diversele pompe necesare sunt
actionate de mooare electrice.pentru eliminarea caldurilor de
reactie nerecuperabile se foloseste apa de racire
recirculata in cantiatate de 200m3/t acid azotic 100%.
Amoniacul necesar procesului de
oxidare se obtine din ammoniac lichid prin evaporare la 20oC
pana la 6oC in vaporizatorul de ammoniac.
Amoniacul folosit este ammoniac
gazos alimentat prin intermediul unui gazometru care mentine presiunea constanta. Amoniacul
gazos este filtrat printr-un filtru confectionat din postav de lana,
pentru retinerea impuritatilor si eventualelor
picaturi de apa si ulei. Astfel purificat si cu un debit
reglat amoniacul se amesteca cu aerul in toba de amestec.
Amestecul necesar oxidarii
amoniacului are o umiditate de 25% si este separat din atmosfera cu ajutorul unei
turbosuflante pe aspiratia careia este montat un filtru dublu de aer.
Amestecul format este trecut printr-un filtru care are rolul de a asigura o
retinere inaintata a particulelor mecanice. Amestecul filtrat este
preincalzit cu ajutorul gazelor nitroase ce parasesc sistemul.
Din preincalzitor amestecul intra in elementele de ardere pe la partea
superioara si trece de sus in jos printr-un sistem de
distributie ajungand pe cele trei site ale catalizatorului.
Prin recuperarea caldurii
gazelor nitroase se obtine abur supraincalzit de 40 atm si 450oC
acesta preincalzeste amestecul aer- NH3.
Acidul produs , cu
concentratia de 49,1% este denitrat prin sulfonare cu aer, gazele
rezultate fiind reintroduse in circuit.
Fluxul tehologic al acestei
instalatii prezinta intre etapa de obtinere a gazelor nitroase
prin oxidarea NH3 si etape de prelucrare a acestora prin
absorbtia acida, o etapa de comprimare a gazelor nitroase.
Comprimarea se realizeaza cu
un turbocompresor din otel, de la presiunea de 1 atm pana la 3,5 atm.
Oxidarea NH3 fiind la presiune
atmosferica temperatura sitelor e relativ redusa, 800oC
gazele nitroase obtinute cu 11% NO fiind racite in cateva trepte.
Ultima treapta de
racire, in spalator-racitor, are si rol de a purifica
gazele nitroase de impuritati
ce s-ar acumula in turbocompresor.
Absorbtia are loc intr-o
coloana cu taler, gazele nitroase reziduale fiind reincalzite in vederea
recuperarii energiei de comprimare, prin recuperarea caldurii
degajate la comprimare, precum si la oxidarea oxizilor de azot.
Instalatia
functioneaza in partea de obtinere a gazelor nitroase la
presiuni de 40 atm, iar in partea de absorbtie la 10 atm. Obtinerea
amestecului
aer-NH3 se
caracterizeaza printr-o retinere avansata a
impuritatilor din gaze, prin filtrari avansate. Acesta
purificare a reactantilor contribuie la scaderea cantitatii
de platina, antrenata de pe sitele de catalizatori.
Oxidarea in faza lichida
a NO in doua trepte de presiune prin stropirea cu acid de 55% respective
67% HNO3. Inaintea oxidarii la joasa presiune gazele nitroase se dilueaza cu aerul rezultat
din degajorul de acid. Absorbtia avand loc la la presiune mare 10 atm
rezulta un acid concentrat 60% HNO3 si gaze diluate sub
0,1%.
Acidul rezultat trece printr-un ventil de reglare a nivelului la
baza coloanei, in degazorul de acid, unde cu ajutorul aerului se desoarbe NO2
dizolvat. Aerul aspirat din atmosfera trece in contracurent cu acidul
si amestecul de aer si NO format este aspirat in compresorul de gaz.
Din coloana de degazare, HNO3 se introduce in rezervoarele de
depozitare.
Cazanele recuperatoare
sunt alimentate cu apa demineralizata degazata termic cu
ajutorul aburului de 6 atm si tratate chimic in rezervoarele degazorului.
Din aceste rezervoare apa de alimentare a cazanelor este aspirata de
pompele de alimentare, care ridica presiunea la 75atm. Cu aceasta
presiune si temperatura de 100oC intra in
preincalzitorul de apa unde cu ajutorulaburului de 6 atm se
incalzeste la 130oC. Apa de alimentare parcurge sistemul
cazan-recuperator format din: economozor, fierbator, instalatie de
recuperare a emulsiei apa-abur unde are loc separarea aburului ce trece
prin incalzitor obtinandu-se abur energetic de 40 atm si 450oC.
Apa de incalzire recirculata este utilizata pentru
racire in separatoarele coloanei si racitoarele
spalatoare, racirea lagarelor motoarelor eletrice, a
pompelor suflantei si racitorului de ulei de la compresor.
In urma procedeului
Ghiap se obtine acid azotic de concentratie 51,6%.
III.BILANT DE MATERIALE
Reactiile care stau la baza
procesului tehnologic de obtinere a HNO3 sunt:
NH3 + 5/2O2↔
NO + 3/2H2O
NH3 + 3/4O2↔
1/2N + 3/2H2O
NO + 1/2O2 ↔ NO2
NO2 + 1/3H2O
↔ 2/3 HNO3 + 1/3NO
3N2O4 +2H2O
↔ 4HNO3 + 2NO
Intrarii: NH3, umiditate, aer (N2, O2
)
Iesirii: HNO3, NO, apa, NH3
nereactionat, NO nereactionat, N2 (inert)
Compozitia aerului: 79%N2 si 21%O2.
CALCULUL DEBITELOR DE MATERII PRIME
Intrarii: oxidatorul de amoniac
Se considera 325 zile lucratoare iar M HNO3 = 63
Concentratia acidului azotic se
calculeaza cu relatia:
CHNO3 = 55+0.1*n
CHNO3 = 55,3
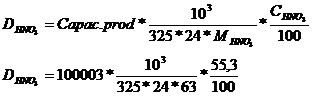 [1]
[1]
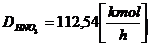
 [2]
[2]
 [3]
[3]
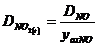
Atunci
calculam numarul de moli de NO2:
3 moli NO2 . . . . . . . . . ..DNO2
2 moli NO2 . . . . . . . . . ..
x
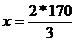 = 113,33 kmol/h= DNO2(t)
= 113,33 kmol/h= DNO2(t)
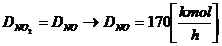
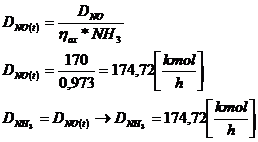 [4]
[4]
Umiditatea
amoniacului este de 0,2%
Debitul de apa din ammoniac se calculeaza astefel:
 [5]
[5]
DNH3 = DNO(t) - DH2O din
NH3
DNH3 =174,72 - 0,349 = 174,371 
Se cunaste ca in amestecul initial amoniac-aer avem
concentratia amoniacului data in tema de proiect si se calculeaza debitul
initial molar ammoniac - aer.
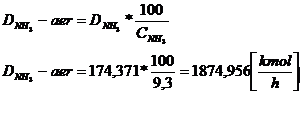
Continutul in apa sub forma de vapori a aerului se
poate calcula stiindu-se umiditatea relative a aerului (25%).
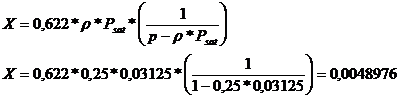 [7]
[7]
X =
0,0048976 kg apa/ kg aer curat
unde:
X = grad de
umezeala [kg apa/kg aer curat]
ρ = 0,25 -
umezeala relative a aerului
p = 1 atm -
presiunea atmosferica
Psat =
0,03125 atm - presiunea vaporilor apa saturate la t = 250C
Dae-umed = DNH3 -aer -DNH3
Dae-umed = 1874,956 - 174,371 = 1700,585
kmol aer umed/ h
DEBITE MASICE
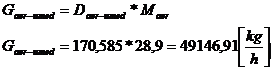
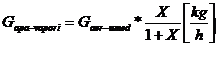 [10]
[10]
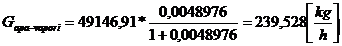

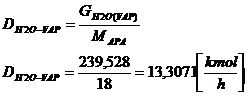 [11]
[11]
Daer-uscat = Daer-umed
- Dapa(vap) [12]
Daer-uscat = 1700,582
- 13,3107 = 1687,274 [kmol/h]
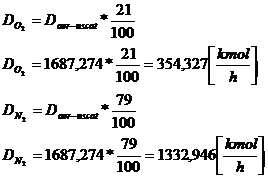 [13]
[13]
DH2O(t) =
DH20(VAP) +DH2O din NH3
DH2O(t) =
13,3071 - 0,349 = 12,9581 [kmol/h]
DEBIT MASIC:
NH3 : GNH3
= 174,371*17 = 2964,307 kg/h
N2 : GN2 = 1332,946 * 28 =
37322,488 kg/h
O2 : GO2 = 354,327 * 32 =
11338,468 kg/h
H2O : GH2O
= 12,9581 * 18 = 233,246 kg/h
DEBITE VOLUMETRICE:
NH3 : VNH3
= 174,371*22,4 = 3905,9104 N*m3/h
N2 : VN2 = 1332,946 * 22,4=
29857,9904 N*m3/h
O2 : VO2 = 354,327 * 22,4 =
7936,9248 N*m3/h
H2O : VH2O
= 12,9581 * 22,4 = 290,262 N*m3 /h
CONCENTRATIA % :
NH3 : 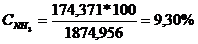
N2 : 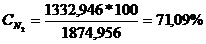
O2 : 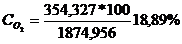
H2O : 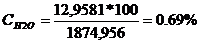
BILANT TOTAL LA IESIRE
I . 4NH3 + 5O2 ↔ 4NO + 6H2O ηox NH3 = 0,973
DNH3 iesire =
DNH3 intrare * ηox NH3
DNH3 iesire =
174,371* 0,973 = 169,6629 [kmol/h]
DNH3 neconsumat
= DNH3 intrare -DNH3 iesire
DNH3 neconsumat
= 174,371 - 169,6629 =4,7081 [kmol/h]
DO2 I = DNH3
iesire *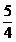
DO2 I =
170 *1,25 = 212,5 [kmol/h]
DNO = DNH3
iesire → 170 [kmol/h]
21%O2 . . . . . . . . . 79%N2
DO2 I . . . . . . . . . . DN2
= y
y=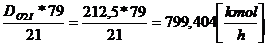
DH2O = DNH3
iesire * 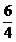
DH2O =170
* 1,5 = 255 [kmol/h]
II. 2NO + O2
↔ 2NO2
ηox NH3 = 0, 983
DNO iesire =
DNH3 intrare * ηox NO
DNO iesire =
170* 0,983 = 167,11 [kmol/h]
DNO neconsumat =
DNH3 intrare -DN0 iesire
DNO neconsumat =
170 - 167,11 =2,89 [kmol/h]
DO2 II =
DNOiesire *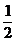
DO2 I =
167,11 *0,5 = 84,055[kmol/h]
DNO2 = DNO
iesire
DNO2
=167,11 [kmol/h]
III. 3NO2
+ H2O ↔ 2HNO3 +
NO
ηox NO2 = 0, 993
2 moli NO2 . . . . . . . .DNO2(rII)
3 moli NO2 . . . . . . . .z
z = 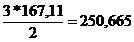
DNO2(z) =
250,665 [kmol/h]
DNO2(t) =
DNO2(z) * ηox NO2
DNO2(t) =
250,655 * 0,993 = 248,9103 [kmol/h]
DNO2 neconsumat
= DNO2(z) - DN02(t)
DNO2 neconsumat
= 250,665 - 248,9103 =1,7547 [kmol/h]
DH2O = DNO
= DNO2*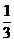
DH2O =
248,9103 *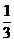 = 82,9701[kmol/h]
= 82,9701[kmol/h]
DHNO3 = DN02(t)
* 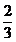
DHNO3 =
248,9103 * 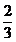 = 165,9402 [kmol/h]
= 165,9402 [kmol/h]
DH2O = DH2O
intrare + DH2O (r.I) - DH2O (r II)
DH2O = 12,9581 + 255 - 82,9701 = 184,998 [kmol/h]
DO2 = DO2
intrare - O2 (r.I) - DO2 (r II)
DO2 =
354,327 - 12,5 - 84,055 = 57,772 [kmol/h]
DNO = DNO
nereactionat + DNO (r III)
DNO =
2,89 + 82,9701 = 85,8601 [kmol/h]
DN2 iesire
= DN2 intrare
DN2 iesire
= 1332,946 [kmol/h]
DEBIT MASIC
IESIRE:
GNH3 neconsumat
= 4,7081 *17 = 80,0377 [kg/h]
GN2 =
1332,946 *28 = 37322,488 [kg/h]
GO2 =
57,772 * 32 = 1848,704 [kg/h]
GH2O =
184,988 * 18 = 3329,784 [kg/h]
GNO2 neconsumat
= 1,7547 * 46 = 80,7162 [kg/h]
GNO =
85,860 * 30 = 2575,8 [kg/h]
GHNO3 =
165,9402 * 63 = 10454,2326 [kg/h]
DEBIT VOLUMETRIC:
VNH3 neconsumat
= 4,7081 * 22,4 = 105,462 [N*m3/h]
VN2 =
1332,946 * 22,4 = 29857,9904 [N*m3/h]
VO2 =
57,772 * 22,4 = 1294,0928 [N*m3/h]
VH2O =
184,988 * 22,4 = 4143,7312 [N*m3/h]
VNO2neconscumat
= 1,7547 * 22,4 = 39,30521 [N*m3/h]
VNO =
85,860 * 22,4 = 1923,264 [N*m3/h]
VHNO3 =
165,9402 * 22,4 = 3717,0605 [N*m3/h]
CONCENTRATIA%:
CNH3 necesar
= 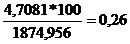
CN2 =
1332,946 * 0,05333 = 72,29
CO2 =
57,772 * 0, 05333 = 3,38
CH2O =
19,988 * 0,05333 = 10,23
CNO2 necesar
= 1,7547 * 0,05333 = 0,11
CNO =
85,860 * 0,05333 = 4,58
CHNO3 =
165,9402 * 0,05333 = 8,85
TABEL BILANT GENERAL
INTRARI
|
Component
|
Debit molar
[ kmol/h]
|
Debit masic
[kg/h]
|
Debit volumetric
[Nm3/h]
|
Concentratia
|
|
NH3
|
|
|
|
|
|
N2
|
|
|
|
|
|
O2
|
|
|
|
|
|
H2O
|
|
|
|
|
|
TOTAL
|
|
|
|
|
IESIRI
|
Component
|
Debit molar
[ kmol/h]
|
Debit masic
[kg/h]
|
Debit volumetric
[Nm3/h]
|
Concentratia
|
|
NH3
|
|
|
|
|
|
N2
|
|
|
|
|
|
O2
|
|
|
|
|
|
H2O
|
|
|
|
|
|
NO2
neconsumat
|
|
|
|
|
|
NO
|
|
|
|
|
|
HNO3
|
|
|
|
|
|
TOTAL
|
|
|
|
|
4.BILANT PARTIAL DE MATERIALE
4.1. OXIDATORUL
DE NH3
4NH3 + 5O2 ↔ 6H2O
+4 NO
|
Component
|
Debit molar
[ kmol/h]
|
Debit masic
[kg/h]
|
Debit volumetric
[Nm3/h]
|
Concentratia
|
|
NH3
|
|
|
|
|
|
N2
|
|
|
|
|
|
O2
|
|
|
|
|
|
H2O
|
|
|
|
|
|
TOTAL
|
|
|
|
|
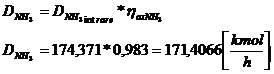
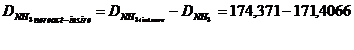
DNH3 neraect
= 2,9644 [kmol/h]
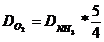
DO2 =
171,4066 * 1,25 = 214,2582 [ kmol/h]
DO2 iesire =
DO2 intrare - DO2 = 354,327 - 214,2582 = 140,0688[kmol/h]
DNO Iesire
= DNH3 *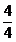
DNO Iesire
= 171,4066 * 1 = 171,4066 [kmol/h]
DH2O = DNH3 iesire * 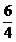
DH2O = 171,4066 * 1,5 = 257,1099 [kmol/h]
DH2O iesire
= DH2O intrare + DH2O
DH2O iesire
= 12,9581 + 257,1099 = 270,068 [kmol/h]
|
Component
|
Debit molar
[ kmol/h]
|
Debit masic
[kg/h]
|
Debit volumetric
[Nm3/h]
|
Concentratia
|
|
NH3 neconsumat
|
|
|
|
|
|
N2
|
|
|
|
|
|
O2
|
|
|
|
|
|
NO
|
|
|
|
|
|
H2O
|
|
|
|
|
|
TOTAL
|
|
|
|
|
4.2. Bilant
partial de materiale in spalator racitor
Spalatorul racitor
functioneaza la presiune atmosfericasi este alcatuit dintr-o coloana cu 3
talere sita pe care se formeaza cate un strat spumant de acid azotic de
concentratie 10-15%.
Racirea se face prin
serpentinele de racier introduce in stratul spumant.
Intre talere are loc
oxidarea NO → NO2, iar pe taler are loc condensarea vaporilor
de apa si absorbtia NO2.
|
Component
|
Debit molar
[ kmol/h]
|
Debit masic
[kg/h]
|
Debit volumetric
[Nm3/h]
|
Concentratia
|
|
NH3 neconsumat
|
|
|
|
|
|
N2
|
|
|
|
|
|
O2
|
|
|
|
|
|
NO
|
|
|
|
|
|
H2O
|
|
|
|
|
|
TOTAL
|
|
|
|
|
|
APA lichida
|
|
|
|
|
Fie 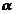 = grad de oxidare
= grad de oxidare
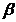 = grad de absorbtie
= grad de absorbtie
Pentru temperatura
medie de 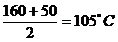 s-a calculate gradul
de oxidare
s-a calculate gradul
de oxidare  cu relatia:
cu relatia:
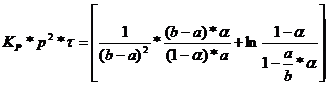
Unde:
Kp = constanta
de viteza pentru oxidarea NO corespunzatoare concentratiei exprimate in presiuni partiale
Kp = 0,4228exp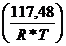 =
= 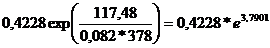
Kp = 0,4228*44,2608 = 18,7134
R = 0,082 l*atm/mol*K
T = 105+273 = 378K
τ = timpul (0,5s)
p = 1 atm
Concentratia initiala de NO : 2a=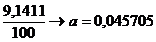
Concentratia initiala de O2 : b = 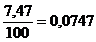
A = Kp*p2* τ =18,7134*1*0,5 = 9,3567
B = b - a = 0,0747 - 0,045705 = 0,028995 → B2 =
8,47*10-4
C = a →0,045705
D = 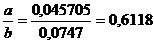
E1 = 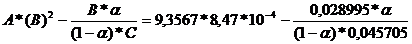
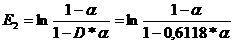
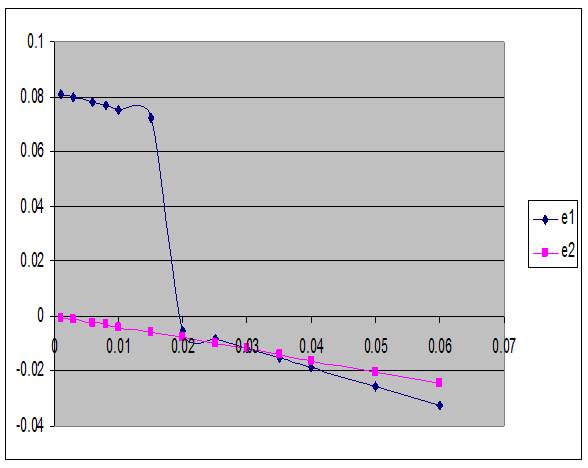
CALCUL ALFA

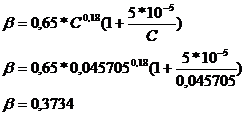
BILANTUL PARTIAL DE MATERIALE DE LA INTRARE
IN UTILAJ PANA LA PRIMUL TALER
2NO + O2
↔ 2NO2
DNOcons = DNO tabel * α
DNOcons = 171,4066 * 0,02995
DNOcons = 5,1336 kmol/h
DNOnetransf
= DNO table - DNOcons
DNOnetransf
= 171,4066 - 5,1336
DNOnetransf
= 166,273 kmol/h
DO2 cons
= DNOcons * 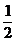 = 5,1336 *0,5
= 5,1336 *0,5
DO2 cons
= 2,5668 kmol/h
DO2necons
= DO2tabel - DO2 cons = 140,0688 - 2,5668
DO2necons
= 137,502 kmol/h
DNO2format
= DNOnecons
DNO2format
= 5,1336 kmol/h
Tabel centralizat intrari pe talerul I
|
Component
|
Debit molar
[ kmol/h]
|
Debit masic
[kg/h]
|
Debit volumetric
[Nm3/h]
|
Concentratia
|
|
NH3 nereactionat
|
|
|
|
|
|
N2
|
|
|
|
|
|
O2neconsumat
|
|
|
|
|
|
NOnetransformat
|
|
|
|
|
|
H2O
|
|
|
|
|
|
NO2format
|
|
|
|
|
|
TOTAL
|
|
|
|
|
|
APA lichida
|
|
|
|
|
3 NO2 + H2O
↔ 2HNO3 + NO
2 NO + O2
↔ 2NO2
Se face transferal
de la 2 moli NO2 la 3 moli NO2.
2 moli NO2..DNO2tab
intrari taler I
3 moli NO2 . . . . . . . ..x
x = 7,7004kmol/h DNO2
DNO2 = DNO2(x)
* β = 7,7004 * 0,3734
DNO2 =
2,8754 kmol/h
DNO2 netransf
= DNO2(x) - DNO2 = 7,7004 2,8754
DNO2 netransf
= 4,825 kmol/h
DH2O(liq)cons
= DNO2 *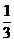 = 2,8754 * 0,3333
= 2,8754 * 0,3333
DH2O(liq)cons
= 0,9585 kmol/h
DH2O(liq)necons
= DH2O table - DH2O(liq)cons = 270,068 - 0,9585
DH2O(liq)necons
= 269,1095 kmol/h
DHNO3 (liq)
= DNO2 *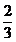 = 2,8754 * 0,6666
= 2,8754 * 0,6666
DHNO3 (liq)
= 1,9169 kmol/h
DNO format = DH2O(liq)cons = 0,9585 kmol/h
DNOtotal
= DNO table intrare taler I + DNO format = 166,273 + 0,9585
DNOtotal
= 159,3726 kmol/h
|
Component
|
Debit molar
[ kmol/h]
|
Debit masic
[kg/h]
|
Debit volumetric
[Nm3/h]
|
Concentratia
|
|
NH3 nereactionat
|
|
|
|
|
|
N2
|
|
|
|
|
|
O2consumat
|
|
|
|
|
|
NOtotal
|
|
|
|
|
|
H2O(liq)neconsumat
|
|
|
|
|
|
NO2netransf
|
|
|
|
|
|
TOTAL
|
|
|
|
|
|
APA lichida
|
|
|
|
|
|
HNO3liq
|
|
|
|
|
DH20liq =
DH20liq intrare taler I - DH20liq consumat
BILANT DE MATERIALE INTRE TALERUL I SI
TALERUL II
Intre talerul I si
II are loc oxidarea NO la NO2 cu un grad de oxidare α = 0,02995
2NO + O2 → 2 NO2
DNOcons =
DNOtab iesire taler I * α = 159,3726 *0,02995
DNOcons =
4,7732 kmol/h
DNOnetransf
= DNOtab iesire taler I - DNOcons = 159,3726 - 4,7732
DNOnetransf
= 154,5994 kmol/h
DO2cons =
DNOcons * 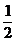 = 4,7732 * 0,5
= 4,7732 * 0,5
DO2cons =
2,3866 kmol/h


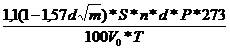 , s
, s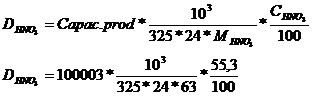 [1]
[1] [2]
[2] [3]
[3]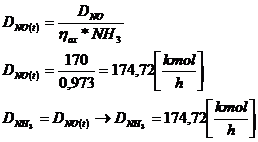

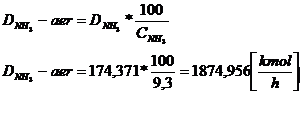
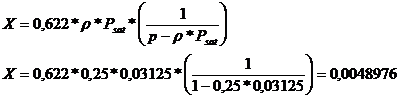 [7]
[7]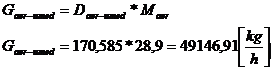
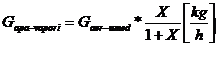 [10]
[10]