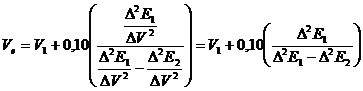POTENTIOMETRIE
Metodele
potentiometrice de analiza sunt acele metode ce permit determinarea
concentratiei ionilor din solutie,
din valoarea potentialului sau din variatia potentialului unui
electrod indicator adecvat. Potentialul determinat depinde de
reactia electrochimica ce are loc la electrod, iar aceasta la randul
ei depinde de felul si activitatea speciilor ionice prezente, de natura
electrodului, precum si de marimea curentului ce trece prin sistem.
Masurarea directa a
potentialului unui electrod nu este posibila si de aceea se
alcatuiesc celule electrochimice, formate in general din electrodul
indicator al activitatii (deci si al concentratiei) ionului
studiat si un electrod de comparatie (de obicei cu potential
constant). Marimea a carei valoare sau variatie se urmareste
pentru determinarea concentratiei ionilor din solutie este deci
forta electromotoare (f.e.m.) a unei astfel de celule.
Determinarile potentiometrice pot fi: directe
si indirecte.
a.) Masuratorile
directe se bazeaza pe relatiile existente intre potentialele
de electrod si activitatea ionilor din solutie (Ecuatia lui Nernst)
Deteminarea activitatii,
in principiu este posibila printr-o singura masuratoare a
f.e.m., daca electrodul studiat este asociat cu un electrod de
referinta avand potentialul cunoscut. Pana in prezent,
metodele potentiometrice directe sunt aplicate in special pentru masurarea
activitatii ionului de hidrogen din solutie (a pH-ului) precum si la determinarea
concentratiilor Cl-, Br-, l-, S2-,
Na+, etc. prin utilizarea unor electrozi ion-selectivi.
b.) Metoda indirecta
consta in titrarea potentiometrica a ionului studiat cu o
solutie potrivita de titrant, punctul de echivalenta
determinandu-se din variatia f.e.m. a unei celule adecvate.
Concentratia ionului studiat se determina din cantitatea de titrant
necesara, stabilita cu ajutorul relatiei dintre f.e.m. (E)
si volumul de titrant (V) la punctul de echivalenta. Aceasta nu necesita
cunoasterea potentialelor de electrod sau a coeficientilor de activitate (valori
absolute) ci numai cunoasterea variatiei f.e.m. in functie de
volumul de titrant. Titrarile potentiometrice s-au dovedit utile in special
in cazurile in care punctul de echivalenta nu se poate evidentia
cu ajutorul indicatorilor, in cazul solutiilor intens colorate sau a
suspensilor.
Titrarile
potentiometrice sunt aplicabile intr-o mare varietate de tipuri de
reactii: acido-bazice, redox, cu formare de precipitate, cu
formare de combinatii complexe, etc., precum si pentru reactiile
care se desfasoara in mediu neapos, in care
masuratorile potentiometrice directe nu se pot realiza
datorita necunoasterii coeficientilor de activitate in acest mediu.
De asemenea, metoda de titrare potentiometrica se poate aplica
si in cazul in care in solutie se gasesc mai multe specii chimice
(ex. titrarea potentiometrica cu solutie de AgNO3 a amestecurilor de
halogenuri, Cl-, Br- si l-).
TITRAREA
POTENTIOMETRICA
Titrarea potentiometrica
consta in masurarea variatiei f.e.m. (E) in functie de
volumul (V) de titrant. Determinarea
punctului de echivalenta al reactiei este posibil datorita
saltului mai mare de potential ce are loc in acel punct. Spre deosebire de masuratorile
potentiometrice directe, in cazul titrarilor potentiometrice nu este
necesara determinarea absoluta a f.e.m., ci numai variatia ei.
Problemele
teoretice si practice care se ridica in titrarile
potentiometrice sunt:
alegerea unui reactant (solutie cu concentratie
cunoscuta) cu care ionul sau substanta de dozat sa reactioneze cantitativ printr-o reactie
de neutralizare, redox, de precipitare, etc.;
alegerea unui electrod indicator al ionului
respectiv precum si a unui electrod de referinta
corespunzator;
alcatuirea montajului electric si
masurarea variatiei f.e.m. ;
 reprezentarea grafica a relatiei
f.e.m. - volum de titrant si determinarea punctului de
echivalenta;
reprezentarea grafica a relatiei
f.e.m. - volum de titrant si determinarea punctului de
echivalenta;
calcularea si interpretarea
rezultatelor.
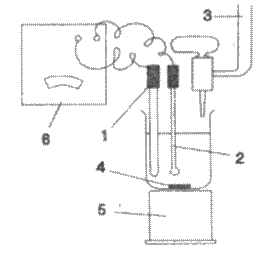
Dispozitivul de titrare
potentiometrica (fig.3) este
format din: vasul in care se efectueaza titrarea (pahar
berzelius) si care prin imersia electrozilor (indicator si de referinta) constituie celula
propriu-zisa, biureta pentru masurarea
volumului de titrant, un sistem de agitare pentru omogenizarea solutiei dupa fiecare adaugare de titrant (agitator magnetic sau barbotare de gaz)
si aparatul de masura
pentru f.e.m.
Titrarea se efectueaza adaugand la solutia
care constituie proba de analizat, a unor
cantitati mici de titrant
(cu biureta) la intervale egale de timp. Dupa fiecare adaos, solutia trebuie bine omogenizata
si trebuie asteptat timpul
in care electrozii ating potentialul de echilibru (1 - 2 min). Se
masoara apoi diferenta de
potential intre electrodul indicator si cel de referinta si se noteaza
valorile f.e.m. In cursul titrarii
se poate modifica, atat intervalul de timp intre doua adaosuri consecutive
de titrant, cat si volumele de titrant, astfel ca in regiunea
punctului de echivalenta unde cresc diferentele dintre valorile
f.e.m. sa se adauge cantitati
mici de titrant (0,1 ml).
Rezultatele titrarii
potentiometrice sunt cu atat mai precise cu cat saltul de potential
la punctul de echivalenta este mai
mare. Marimea saltului de potential este functie
de natura reactiei care are loc, a mediului de reactie si
a tipului de electrozi folosit. Determinarea punctului de echivalenta in
titrarea potentiometrica se poate face prin metoda grafica sau prin
calcul.
Determinarea
grafica a punctului de echivalenta se face reprezentind
grafic pe abscisa volumul solutiei de titrant folosit (V
exprimat in ml) iar pe ordonata valoarea corespunzatoare a
diferentei de potential. Momentul de echivalenta corespunde
punctului de inflexiune al curbei (fig.4a) care extrapolat pe abscisa ne
ajuta la stabilirea volumului de echivalenta Ve.
O metoda grafica mai precisa consta in reprezentarea
valorii corespunzatoare a rapotului E/ V (in care E = variatia diferentei de potential dupa fiecare
adaugare de solutie titranta iar V =
volumul de solutie titranta
adaugate de fiecare data). In acest caz momentul de echivalenta corespunde
valorii maxime a raportului E/ V (fig.4b).
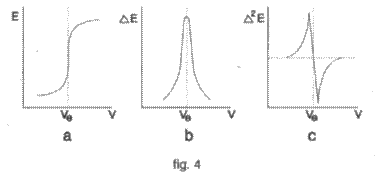 O metoda
grafica si mai precisa consta in folosirea derivatei a doua; pe
abscisa se inscrie volumul solutiei titrante iar pe ordonata
valoarea corespunzatoare a raportului E2/ V2. Volumul de echivalenta
corespunde valorii de pe abscisa rezultata prin extrapolarea
punctului in care raportul E2/ V2 trece de la valori pozitive la valori
negative (fig.4c).
O metoda
grafica si mai precisa consta in folosirea derivatei a doua; pe
abscisa se inscrie volumul solutiei titrante iar pe ordonata
valoarea corespunzatoare a raportului E2/ V2. Volumul de echivalenta
corespunde valorii de pe abscisa rezultata prin extrapolarea
punctului in care raportul E2/ V2 trece de la valori pozitive la valori
negative (fig.4c).
Metoda de calcul a punctului de echivalenta in titrarea
potentiometrica are la baza relatia
Hosteller si Roberts. Deoarece in jurul
punctului de echivalenta pasul titrarii (volumul de titrant
adaugat este constant (0,1 sau 0,2 ml) atunci, atat V cat si V2 sunt constante,
astfel ca se poate reprezenta E in functie de V si E in functie de V,
iar relatia lui Hosteller si Roberts se simplifica.
in
care:
Ve - volumul solutiei titrante la punctul
de echivalenta (ml);
V, - volumul solutiei titrante folosit inaintea
punctului de echivalenta;
0,10 - cantitatea de solutie titranta
adaugata in jurul punctului de echivalenta;
E,/ V2 - derivata a doua
(pozitiva sau negativa) inainte de momentul de echivalenta;
E2/ V2 - derivata a doua
(negativa sau pozitiva) dupa momentul de echivalenta.
Metoda este
ilustrata prin datele unei titrari potentiometrice ipotetice in
tabelul urmator.
Dupa determinarea
volumului de echivalenta prin metode grafice sau prin calcul se trece
la calcularea concentratiei substantei sau a ionului de dozat
dupa metodele de calcul ale analizei volumetrice.
ACTIVITATE PRACTICA
Titrarea potentiometrica aplicata in
reactiile cu schimb de proton
Stabilirea titrului unei solutii de
NaOH~0,1N cu ajutorul unei solutii de HCI cu concentratie
cunoscuta.
Evidentierea punctului de
echivalenta prin titrarea potentiometrica si cu
ajutorul unui indicator acido-bazic de culoare (fenolftaleina). Calcularea erorii de indicator la stabilirea
titrului.
Determinarea
continutului procentual de acid acetilsalicilic din pulberi prin titrarea
cu solutia NaOH.
Modul de lucru 1. Stabilirea titrului
solutiei de NaOH 0,1 N
Variatia potentialului si pH-lui in cursul
titrarii va fi monitorizata cu ajutorul unui pH/potentiometru
CONSORT. Dupa pornirea acestuia
de la butonul ON/OFF se va apasa pe butonul MODE o singura data
pentru a selecta scala de potential. Pentru citirea valorii
corespunzatoare de pH se apasa din nou butonul MODE. Pentru a va
reintoarce la scala de potential se apasa butonul MODE in mod
repetat.
Intr-un pahar Berzelius
de 150 mL se masoara cu o
biureta 5 ml solutie de HCI cu concentratie cunoscuta si
se dilueaza cu 50 mL apa distilata. Se introduce in pahar
magnetul. In solutia din pahar se imerseaza cei doi electrozi astfel incat
sa nu fie atinsi de magnetul care se roteste omogenizand
solutia. Se adapteaza biureta cu solutia de NaOH 0,1 N. Se inregistreaza
valoarea potentialului si pH-lui la momentul zero al titrarii si se incepe
adaugarea solutiei de titrant. La inceputul titrarii se
adauga cite 0,5 ml. In vederea omogenizarii, dupa fiecare adaugare de titrant se
asteapta 15-20 secunde, apoi se citeste valoarea potentialului si pH-lui. In apropierea punctului de
echivalenta, cand diferenta de potential intre doua adaugari
succesive devine mai mare de 12-15 mV, se va reduce volumul de titrant
adaugat la 0,1 mL.
Se continua adaugarea
titrantului (cate 0,1mL) pana cand valoarea diferentelor de
potential revine sub 12-15 mV si se mentine constanta. Din acest
moment se mai adauga inca de trei ori cate 0,5 mL titrant, notand de
fiecare data valoarea potentialului si pH-lui.
Pentru stabilirea titrului mediu al solutiei
de NaOH 0,1 N se executa doua titrari potentiometrice,
folosind de fiecare data acelasi volum de proba (5 mL HCl cu
titru cunoscut).
In vederea calcularii erorii de indicator, se va efectua o
titrare acido-bazica clasica. Intr-un pahar Erlenmayer se masoara cu biureta 5 mL de HCl
cu titru cunoscut si se adauga 1-2 picaturi de
fenolftaleina. Proba se dilueaza cu aproximativ 50mL apa
distilata si se titreaza cu solutia de NaOH pana la
virajul culorii la slab roz. Se noteaza volumul final obtinut (VeFF
mL).
Toate datele experimentale se vor
nota in tabelul nr.1.
In tabelul nr.2 se vor
inscrie atat volumele de echivalenta rezultate in urma titrarii
potentiometrice cat si cel determinat vizual cu ajutorul indicatorului.
Astfel, in coloanele 1
si 5 din tabelul nr. 2 se inscriu volumele de echivalenta
obtinute in titrarea potentiometrica prin calcul, folosind
datele experimentale din tabelul nr .1 (vezi partea generala - metoda Hosteller si
Roberts).
In coloanele 2 - 4
si 6 - 8 ale tabelul nr.2 se vor inscrie volumele de echivalenta
obtinute prin reprezentarea grafica in diferite moduri (vezi
fig.4a, b, c) a rezultatelor obtinute in titrarea
potentiometrica.
In coloana 9 (tabelul nr.2) se va nota
volumul final stabilit vizual cu ajutorul indicatorului de
culoare.
Tabelul nr. 1
|
Titrarea nr. 1
|
Titrarea nr. 2
|
|
mL NaOH
|
E(mV)
|
ΔE
|
Δ2E
|
mL NaOH
|
E(mV)
|
ΔE
|
Δ2E
|
|
|
|
|
|
|
|
|
Tabelul nr. 2
|
Titrarea potentiometrica nr. 1
|
Titrarea potentiometrica nr. 2
|
Titrare clasica
|
|
|
|
|
|
|
|
|
|
|
Ve
calculat
|
Ve
determinat grafic
|
Ve
calculat
|
Ve
determinat grafic
|
Ve fenolftaleina
|
|
|
|
|
|
|
|
|
|
|
Titru 1 (T1)
|
|
Titru 2 (T2)
|
|
Titru
FF
(TFF)
|
|
|
|
|
Titru mediu (TM) = . . . . . . . . . g/mL
|
E%FF=
. . . ..%
|
| | | | | | | | | |
Titrul solutiei de hidroxid se calculeaza
utilizand datele experimentale din tabelul nr. 2 (Ve calculat - col.
1 si 5 si Ve fenolftaleina - col. 9), dupa
urmatorul rationament:
36,46 g HCI . . 39,997 g
NaOH
V THCl.Ve
T NaOH
Pentru evaluarea erorii de indicator
E%, se va calcula titrul mediu obtinut in urma titrarilor
potentiometrice
Eroarea
de indicator se calculeaza folosind urmatoarele relatii:
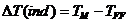
in care
TFF
reprezinta titrul NaOH stabilit cu ajutorul fenolftaleinei.
2.) Determinarea
continutului procentual de acid acetilsalicilic (aspirina) din
pulberi de comprimate prin titrare cu solutie de NaOH 0.1 N si
evidentierea potentiometrica a punctului de
echivalenta
Intr-un pahar Berzelius
de 150 mL se cantaresc la balanta analitica cca 0,1500 g pulbere
de comprimat si se trateaza cu 20 mL de alcool etilic (in prealabil neutralizat
cu solutie de NaOH 0,1N), pentru dizolvarea acidului acetilsalicilic. In
pahar se introduce un magnet si se da drumul la agitatorul magnetic
timp de 2 min. Se dilueaza solutia cu 30 mL apa
distilata si se executa montajul pentru titrari
potentiometrice indicat anterior. Se adauga cu biureta solutia
de NaOH in portiuni de 0,5 mL pana cand diferentele de
potential intre adaugari succesive este sub 12-15mV, continuand apoi cu cate 0,1 mL solutie
de NaOH. Dupa momentul de echivalenta, cind diferentele de
potential devin constante si mai mici de 12-15mV se adauga
inca de trei ori cate 0,5 mL titrant.
Rezultatele
experimentale se inscriu in tabelul nr.3 si servesc la determinarea
volumului de echivalenta (Ve) cu ajutorul caruia se
calculeaza continutul procentual de acid acetilsalicilic
din produsul analizat conform urmatorului rationament:
La 1 mL solutie NaOH 0,1 N corespunde 0,018016 g
(M/10000) acid acetilsalicilic
Calculati continutul procentual de
aspirina din pulberea de comprimat.
Tabelul nr.3 Dozarea acidului
acetilsalicilic
|
mL NaOH
|
E(mV)
|
E
|
Δ2E
|
Ve calculat
|
c% (m/m)
|
|
|
|
|
|
|