VIRUSURI HEPATITICE
Sub aceasta
denumire sunt grupate virusuri care desi apartin unor familii
distincte, cu caracteristici diferite (genom, replicare, evolutie a infectiei, cai de transmitere), au in comun
tropismul principal pentru hepatocite. Ca urmare, toate aceste virusuri determina hepatite cu
manifestari clinice variabile :
- infectii asimptomatice
- simptome clinice acute : fatigabilitate, greturi,
varsaturi, febra, icter
- forme clinice anicterice cu simptomatologie atipica
(pseudo-gripala, pseudo-reumatismala, manifestari cutanate
eruptive)
- hepatopatii cronice (simptomatice sau asimptomatice).
Dupa simptomatologia clinica, diferitele tipuri de agenti
infectanti nu pot fi diferentiati.
Pana in prezent au
fost identificate si caracterizate 7 virusuri hepatitice desemnate cu
literele A-G, insa se pare ca lista agentilor incadrabili in
acest grup generic ramane deschisa (Tabel X).
VIRUSUL HEPATITIC A (HAV)
Apartine genului
Heparnavirus din familia Picornaviridae. Anterior HAV a fost clasificat ca
apartinand genului Enterovirus (desemnat ca enterovirus 72) insa
deosebirile constatate intre HAV si enterovirusuri privind rezistenta
in mediul extern, la agenti fizici si chimici, au determinat actuala
incadrare.
Morfologie si structura
Virionul
are forma sferica, avand diametrul de 27 nm. Nu
prezinta anvelopa.
Capsida
are simetrie icosaedrica iar genomul este ARN
monocatenar, cu polaritate pozitiva. In compozitia
capsidei intra 4 proteine virale structurale (VP1-VP4) si 7 proteine
nestructurale asociate cu mecanismele de replicare.
Proteinele
structurale ce formeaza subunitatile
nucleocapsidei sunt situate la capatul NH2-terminal, iar replicaza
virala specifica se gaseste la capatul COOH-terminal
al proteinei precursoare.
Replicare
Virusul
hepatitic A (HAV) are tropism hepatocitar
datorita existentei unor receptori specifici pe suprafata
hepatocitelor. Mecanismul de replicare nu este
inca pe deplin elucidat, el desfasurandu-se probabil similar cu
cel al enterovirusurilor.
Patogeneza
Calea de patrundere a HAV in organism este
cea fecal-orala. Infectia este favorizata de faptul ca HAV
are capacitatea de a rezista perioade indelungate in mediu umed. Sursa de
infectie este omul bolnav care, mai ales in perioada preicterica,
este un intens excretor de virus. Contaminarea fecala a surselor de
apa, in zone cu standard igienico-sanitar scazut, constituie
modalitatea principala de infectare.
Datorita
dificultatilor in izolarea HAV si imposibilitatii de
crestere in culturi celulare, etapele mecanismului patogenic nu sunt
complet elucidate.
In
orice caz, sediul initial de replicare al HAV este intestinul.
Urmeaza apoi o perioada scurta de viremie dupa care virusul
ajunge la nivelul ficatului. Replicarea virala in hepatocite
determina necroza acestora, insotita de reactia
inflamatorie locala. HAV nu produce efect citopatic direct. Modificarile hepatocitare (liza,
necroza) sunt conscinta raspunsului imun al gazdei.
Aspecte clinice
Perioada
de incubatie este de 20-50 zile. Frecventa infectiilor
asimptomatice este crescuta, mai ales la copii.
Formele
manifeste clinic debuteaza de obicei cu fenomene digestive (greturi,
varsaturi) urmate de icter la nivelul tegumentelor si
mucoaselor. Faza icterica se remite in decurs de o luna.
Vindecarea
este regula (complicatiile sunt extrem de rare, mortalitatea
scazuta - vezi Tabel X) si este urmata de o imunitate
durabila (anticorpi protectori ).
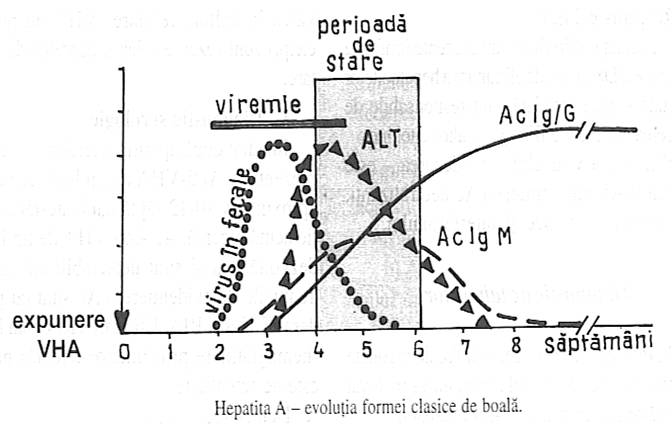
Diagnostic
de laborator
A. Diagnostic direct - este dificil de realizat deoarece
perioada de excretie fecala a virionilor este scurta si se
incheie de regula la debutul perioadei icterice. De aceea izolarea si
identificarea virusului (posibila teoretic din sange si fecale - vezi
'Patogeneza') nu se realizeaza in mod curent. De asemenea
HAV nu este cultivabil in culturi de celule.
Metodele
de evidentiere a HAV in fecale sunt :
- Imunomicroscopia electronica
- Detectarea antigenelor virale prin teste
imunoenzimatice sau radioimune
- Hibridizarea cu sonda ADN sau ARN
- PCR - amplificarea genica
B. Serologia - Diagnosticul de certitudine al unei hepatite
virale A se bazeaza pe evidentierea anticorpilor serici specifici IgM
anti-HAV prin tehnica imunoenzimatica (ELISA) sau prin test radioimun
(RIA). Testul este pozitiv incepand de la debutul fazei icterice, urmand ca
titrul IgM anti-HAV sa scada in cateva saptamani pana
la cateva luni, fiind inlocuiti de anticorpii IgG anti-HAV care
persista timp indelungat (practic toata viata).
Testarea
IgG anti-HAV este utila pentru detectarea unei infectii cu HAV in
antecedente. Testul pozitiv denota imunitate durabila.
Profilaxie
Profilaxia nespecifica
se refera la masuri cu caracter igienico-sanitar, caracteristice
pentru prevenirea infectiilor cu transmitere fecal-orala.
Profilaxia specifica
Imunizarea pasiva cu
gama-globuline polivalente este eficace mai ales inaintea expunerii sau cel
mult in decurs de 15 zile de la aceasta. Durata protectiei este de 4-6
luni.
Imunizarea activa (vaccinarea)
se realizeaza cu vaccin viral inactivat, cu administrare intramusculara.
Virusul hepatitic B (HBV)
HBV apartine familiei Hepadnaviridae
(virusuri ADN care infecteaza ficatul). Alaturi de HBV, implicat in patologia
umana, familia mai include virusuri similare care infecteaza unele
animale (marmota, rata, veverita).
Morfologie si structura
Virionul complet
(particula Dane) are diametrul de 42 nm. Alaturi de virioni completi,
in sangele pacientilor infectati se mai observa formatiuni
sferice sau tubulare cu diametrul de 22 nm care reprezinta de fapt antigen
de suprafata (AgHBs) produs in exces.
Structura unui virion
complet include : anvelopa, capsida si genomul.
HBV (Fig. ?) este un virus ADN circular,
partial dublu catenar. Virionul este constituit dintr-un 'miez'
('core') si un invelis exterior lipoproteic continand
antigenul de suprafata al HBV (AgHBs).
Cu
ajutorul microscopiei electronice s-au depistat 3 feluri de particule cu
invelis in serul pacientilor infectati cu HBV.
Asa-numitele
particule Dane reprezinta virionul intact, infectios .
Particulele sferice si filamentoase
(tubulare), fara miez, sunt constituite din AgHBs si din lipide
provenite de la celula gazda. Acestea nu sunt infectioase si
sunt produse in timpul infectiei in cantitate foarte mare. Ele
reprezinta primul marker serologic al infectiei HBV. Numarul lor este de 100-1000 de
ori mai mare decat al particulelor Dane.
ADN-ul
viral este strans legat de ADN-polimeraza, enzima necesara
replicarii virale. Ambele sunt inconjurate de un invelis intern
constituit din proteine care reprezinta antigenul 'core' (al
miezului) al HBV (AgHBc). AgHBc este prezent in hepatocite la pacientii
infectati. Este puternic imunogen si aproape toti pacientii
infectati dezvolta anticorpi anti-HBc (AcHBc). Probabil se produce
si o reactie in limfocite T. Reactia imuna impotriva AgHBc
joaca probabil un rol hotarator in eliminarea virusului. AgHBc nu
este secretat in ser.
O
parte componenta solubila a AgHBc este insa secretata
si apare in ser : antigenul 'e' (AgHBe). AgHBe in ser
denota o replicare activa a virusului. Anticorpii anti-HBe (AcHBe) se
dezvolta in cazul infectiei acute la saptamani sau chiar
luni dupa aparitia AcHBc si marcheaza de regula
sfarsitul replicarii virale.
Genomul HBV. ADN-HBV are o structura deosebita,
caracteristica (Fig. ?). Este cel mai mic genom ADN viral cunoscut dintre
cele care infecteaza omul si animalele. Structura sa este
asimetrica si consta dintr-un lant lung circular, cu
polaritate negativa (L) care este legat de un lant scurt, cu
polaritate pozitiva si cu lungime variabila (S). Aceasta
asimetrie este hotaratoare pentru replicarea virala.
Genomul
HBV contine 4 cadre libere de citire sau 'open reading frames'
(ORF) la nivelul lantului lung (L-). Genele (ORF) core (pre-C si C)
codifica pentru genele P (Pol) si S (Surface). In afara de
acestea, exista o gena (ORF) X, denumita astfel deoarece la
momentul evidentierii acestei gene produsul sau si functia
acestuia erau necunoscute. De altfel, si in prezent functiile genei X
sunt neclare. AgHBx poate fi decelat in ficatul multor pacienti
infectati cu HBV. Se pare ca AgHBx amplifica replicarea
virala prin activarea transcriptiei si, in unele conditii,
participa la hepatocarcinogeneza.
Despre
ADN-polimeraza se cunosc putine aspecte dar este demonstrat ca
ea este sintetizata independent de produsele genice core (ale miezului).
Replicare
Virusurile
ADN sunt mai rezistente si mai stabile decat cele ARN si folosesc
pentru replicare mecanismul revers-transcriptiei. ADN-HBV se poate integra
in genomul celulei gazda. Hepatocitele care contin ADN-HBV integrat
nu mai exprima proteine nucleocapsidare HBV si sunt astfel
'protejate' de liza imunologica. Supraproductia de antigene
virale (AgHBs, AgHBe) duce la imunotoleranta.
De indata ce genomul
unui hepadnavirus a patruns intr-o celula, el ajunge in nucleu, unde
polimerazele celulare il transcriu intr-o molecula lunga de ARN.
Aceasta molecula de ARN (pregenomul) este apoi introdusa intr-o
capsida nou-formata, impreuna cu o molecula de
ADN-polimeraza virala, acest complex reintrand in citoplasma celulei.
Aici, polimeraza virala realizeaza revers-transcriptia
pregenomului intr-un nou lant de ADN negativ si, pe masura
ce acesta este sintetizat, pregenomul este distrus de enzimele virale. Apoi,
ADN-polimerazele pot sintetiza lantul pozitiv folosind ca model
lantul negativ. In momentul cand virusul paraseste celula,
capsida si ADN-ul viral sunt introduse intr-o anvelopa externa,
moment in care sinteza lantului pozitiv inceteaza. Deoarece
iesirea particulelor virale se realizeaza dupa un timp variabil
in functie de celule si de statusul lor fiziologic, lungimea
lantului pozitiv este si ea variabila. Acest mecanism
surprinzator de replicare al hepadnavirusurilor il aminteste pe cel
al retrovirusurilor, cum ar fi HIV, care au un genom ARN si care
utilizeaza o molecula ADN drept intermediar. Hepadnavirusurile au
si alte trasaturi comune cu retrovirusurile : cele doua
tipuri de virusuri pot infecta latent celulele, fara a le distruge,
aranjarea si functionarea genelor retrovirale gag, pol si env
sunt comparabile cu cele ale genelor C, P si S ale hepadnavirusurilor
(gena gag codifica proteina capsidei retrovirale, pol codifica o
enzima de transcriptie si env codifica proteinele
anvelopei). De asemenea, cele doua familii de virusuri pot produce
neoplazii.
Antigene si anticorpi (markeri
serologici)
Trei
sisteme majore antigen-anticorp sunt operante in cursul infectiei HBV
(acute sau cronice). Acestea sunt :
- antigenul de suprafata (AgHBs) si anticorpii
fata de acesta (AcHBs)
- antigenul miezului ('core') (AgHBc)
si anticorpii fata de acesta (AcHBc de tip IgM si IgG)
- antigenul 'e' (AgHBe) si
anticorpii fata de acesta (AcHBe).
AgHBs
se gaseste atat in ser cat si intrahepatocitar, sub forma
libera (sfere, tubuli) sau incorporata in particulele Dane.
AgHBc
se gaseste doar in nucleul hepatocitelor infectate (nu apare in ser),
insa o portiune solubila a sa este eliberata prin
proteoliza la nivelul membranei hepatocitare ajungand astfel in sange sub
forma AgHBe. Cu alte cuvinte, prezenta AgHBe in ser denota
prezenta AgHBc in hepatocit si replicarea virala activa. (Tabel
X)
Tabel X. Markerii serologici in infectia HBV
|
Marker
|
Semnificatie
|
Pozitiv in :
|
|
ANTIGENE
|
|
|
|
AgHBs
|
antigen de suprafata
(neinfectios per se)
|
infectii acute si
cronice
|
|
AgHBe
|
- componenta a miezului
viral
- prezenta serica
denota infectivitate
|
infectii acute si
cronice
|
|
ADN-polimeraza
|
idem
|
idem
|
|
ANTICORPI
|
|
|
|
AcHBs
|
- infectie vindecata
- imunitate persistenta
|
- convalescenta
- dupa vaccinare
|
|
AcHBe
|
- replicare virala
diminuata
- infectivitate
scazuta sau absenta
|
- convalescenta
- infectii cronice cu
replicare virala redusa
- infectii cronice cu
mutante virale
|
|
AcHBc
|
IgM - infectie
recenta
|
primul anticorp care se
pozitiveaza in infectia acuta
* se poate pozitiva in pusee de
reactivare ale unor infectii cronice
|
|
AcHBc
|
IgG - infectie in
antecedente
|
- markerul cu persistenta cea mai indelungata
|
Patogeneza
Hepatocitele
nu sunt singurele celule ce pot fi infectate de HBV. Astfel, celulele
epiteliale ale cailor biliare, celulele endoteliale hepatice, pancreatice,
renale, tegumentare,leucocitele pot fi de asemenea infectate si ele
joaca probabil un rol in transmiterea virusului sau in persistenta sa
in organism.
Infectia cu HBV se realizeaza total
diferit de cea cu HAV.
HBV se transmite prin : expunere
perinatala, contact sexual, contact cu sange si produse de sange,
transplant de organe si tesuturi, manopere percutane cu instrumente
contaminate.
In
urma replicarii active a HBV intrahepatocitar, un mare numar de
virioni completi (particule Dane) precum si particule incomplete
sferice si tubulare (AgHBs) sunt eliberati in sange. Viremia HBV este
extrem de ridicata (pana la 1010 virioni / ml.) ceea ce
explica contagiozitatea extrem de mare a subiectilor infectati.
In
timpul infectiei acute, modificarile hepatice sunt similare cu cele
din infectia cu HAV, cu deosebirea ca o parte din hepatocite
prezinta aglomerari extrem de importante de AgHBs produs in exces. In
cazurile de infectii cronice HBV, aspectele histologice hepatice
variaza de la modificari minimale pana la noduli cirotici ce
constituie la o parte din cazuri stadii precoce ale dezvoltarii
carcinomului hepatocelular primar.
Sindroame
clinice
Tipurile
de infectie HBV sunt mult mai variate decat in cazul HAV, evolutiile
fiind influentate de o serie de factori legati de organismul infectat
(varsta la care survine infectia, sex, starea sistemului imun).
1. Hepatita acuta - inaparenta
- simptomatica (tipica sau
atipica)
2. Hepatopatii cronice - status de
purtator asimptomatic
-
hepatite cronice
-
ciroza hepatica
-
carcinom hepatocelular primar
1. Hepatita acuta inaparenta sau
asimptomatica poate fi decelata doar accidental prin teste biochimice
denotand citoliza hepatica moderata. Se apreciaza ca
aproximativ o treime din infectiile acute HBV sunt asimptomatice.
Hepatita
acuta simptomatica poate evolua tipic, cu fenomene digestive,
fatigabilitate si icter sau atipic (anicteric, cu fenomene
pseudo-reumatismale, pseudo-dermatologice, etc). Se pare ca doar o treime
dintre infectiile acute HBV evolueaza simptomatic tipic.
2. Hepatopatii cronice
a ) Statusul de purtator asimptomatic -
prezenta in sange a AgHBs asociata sau nu cu AcHBc de tip IgG (restul
markerilor - negativi). La nivel hepatic nu se constata modificari.
b ) Hepatitele cronice si ciroza
hepatica
-
serologic : AgHBs asociat sau nu cu markeri de replicare virala
- histologia hepatica denota grade
diferite de afectare (de la modificari minimale la fragmentarea
parenchimului in noduli cirotici)
c) Carcinomul hepatocelular primar - apare prin
malignizarea unei ciroze induse de HBV sau poate surveni fara
ciroza premergatoare. Se pare ca in carcinogeneza indusa de HBV un rol important il are
integrarea ADN-HBV in genomul hepatocitar.
La adult, in aproximativ 90% din cazuri infectiile HBV evolueaza
spre vindecare, cu eliminarea virusului din organism, refacerea leziunilor
hepatice si imunitate durabila (AcHBs persista in general
toata viata). Doar 10% dintre adulti nu pot elimina virusul
(cauzele nu sunt pe deplin elucidate) devenind astfel purtatori cronici
HBV.
In cazul copiilor,
infectia HBV are un prognostic cu mult mai rezervat, in sensul ca
rata cronicizarilor este cu mult mai mare. De fapt probabilitatea de
cronicizare a unei infectii HBV creste invers proportional cu
varsta subiectului infectat. Astfel, la nou-nascutii din mame
infectate (transmitere perinatala) rata cronicizarii poate ajunge la
90%.
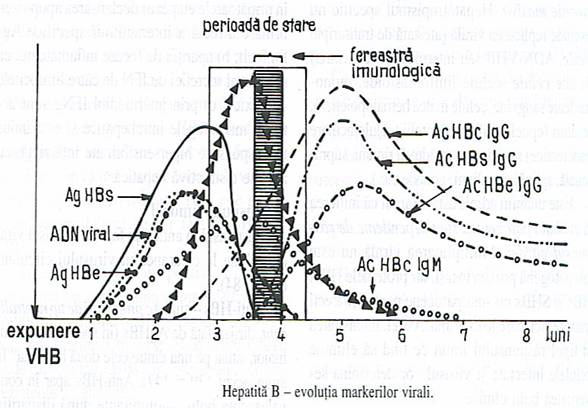
Diagnostic
de laborator
A. Teste specifice
1. Metodele imunoenzimatice .Prin ELISA se deceleaza
prezenta markerilor serologici ai HBV care sunt reprezentati de cele
3 sisteme majore antigen-anticorp care opereaza in cursul infectiei,
si anume : antigenul de suprafata al HBV (AgHBs) si
anticorpii fata de acesta (AcHBs), antigenul miezului
('core') (AgHBc) si anticorpii fata de acesta (AcHBc)
si antigenul 'e' (AgHBe) si anticorpii corespunzatori
(AcHBe). Deci serologia hepatitei B este astazi foarte completa.
Tabelul V prezinta principalele asocieri de markeri HBV iar Tabelul VI
indica markerii serologici ce trebuie testati in functie de
diferite circumstante clinice.
Tabel V.Principalele asocieri de
markeri in hepatita B
|
Antigene
HBs HBe
|
Anticorpi anti-
HBc HBe HBs
|
Comentarii
|
|
+
|
|
-faza acuta foarte precoce
-bolnav foarte infectios
|
|
+ +
|
|
-faza acuta precoce
-bolnav foarte infectios
|
|
+ +
|
+
|
-faza acuta peste 14 zile dupa
instalarea viremiei
-bolnav foarte infectios
-acelasi profil
in hepatita virala B cronica
|
|
+
|
+ +
|
-faza acuta (la finele evolutiei)
-bolnav infectios,prognostic bun
-purtator cronic in
general asimptomatic
|
|
+ +
|
-faza de convalescenta
-bolnavul poate fi inca
infectios
(ADN HBV detectabil uneori in seruri AgHBe negative)
-purtator cronic sau
subiect imunizat (AgHBs sau AcHBs nedecelabili serologic)
|
|
+ + +
|
-vindecare
-bolnav neinfectios,subiect
imunizat
-contaminare
pasiva(transfuzie)
|
|
+ +
|
-vindecare, antecedente indepartate de
hepatita virala B
|
|
+
|
-contaminare veche sau pasiva (transfuzie)
|
|
+
|
-subiect vaccinat cu vaccin
anti-HBV
-seroprotectie prin IgG-HBs
|
Tabel VI.Utilizarea markerilor serologici ai hepatitelor virale
|
Situatii
clinice
|
Markeri de cercetat
|
Scop
|
|
1.Hepatite acute
|
AgHBs
IgM-HBc
IgM-HAV
AcHCV*
|
-diagnosticarea hepatitelor A,B
acute
* diagnosticarea hepatitei C
|
|
2.Hepatita B
|
A. AgHBs/AcHBc
IgM-HBc
B. ADN viral
AgHBe/AcHBe
C. AcDelta
|
A.confirmarea hepatitei B
cronice (AgHBs/AcHBc poz),
IgM-HBc fiind negativ
B.cercetarea sistemului HBe sI masura cantitativa (pg/ml)
a ADN viral permite aprecierea importantei contagiozitatii si masurarea eficientei tratamentului antiviral adoptat
C.diagnosticarea unei infectii duble HBV-HDV
|
|
3.Status imunitar
A.prevaccinal HBV
B.postvaccinal HBV
|
A. AcHBc
AgHBs
AcHBs cantitativ
B. AcHBs cantitativ
|
A.conduita depinde de
rezultatele markerilor:
-markeri HBV-negativi ;
subiectul se vaccineaza ;
-numai AgHBs pozitiv (vezi
AcHBc) ;subiectul este infectat cu HBV si o vaccinare este ineficace
-AcHBs si AcHBc pozitivi
;subiectul deja in contact cu HBV, a dezvoltat AcHBs (nivel protector minim
recomandat:10 mUI/ml)
B.controlarea imunitatii
dupa vaccinare (nivel minim recomADNat:10 mUI/ml)
|
|
4.Grupe de risc
|
A.AcHBc
AgHBs/AcHBs
AcDelta
|
-daca AcHBc este pozitiv se
determina AgHBs,AcHBs si HIV
-daca AgHBs este pozitiv se
determina AcDelta
|
|
5.Depistare prenatala
|
A.AgHBs
B.AgHBe/AcHBe
ADN viral
|
A.depistarea gravidelor care
pot transmite HBV copiilor lor
B.daca AgHBs este pozitiv
se vor determina alti markeri si se verfica anturajul
familial
|
|
6.Urmarirea
nou-nascutului
|
AgHBs/AcHBs
cantitativ
|
-de varificat serovaccinarea copiilor nascuti din mame AgHBs pozitive
|
2. Hemaglutinarea pasiva inversa . Desi nu este
metoda de electie, poate fi folosita in cazurile in care este necesar
un diagnostic rapid. AgHBs este detectat prin tratarea serului de cercetat cu
eritrocite acoperite cu AcHBs. In cazul prezentei AgHBs in ser, se produce
aglutinarea eritrocitelor. Testul este rapid insa confirmarea prin ELISA este intotdeauna
necesara.
3. Microscopia electronica.
Vizualizarea particulelor Dane si a particulelor sferice si tubulare
AgHBs in ser este facilitata de densitatea crescuta a acestora,
insa aceasta tehnica nu este de uz curent.
4. Tehnici de biologie moleculara
- Hibridizarea cu sonde ADN
B. Teste nespecifice
Sunt
utile pentru a stabili gradul de afectare hepatica, fara a putea
da o orientare etiologica. Astfel, in infectia acuta si in
puseele de reactivare ale infectiilor cronice se constata :
- cresterea alanin-aminotransferazei
si a altor enzime hepatice
- scaderea protrombinemiei
- cresterea bilirubinemiei.
Profilaxie
Masuri nespecifice. Acestea se refera la
masurile generale de protectie impotriva infectiilor cu transmitere
parenterala (testarea corecta a sangelui transfuzat, sterilizarea
corecta a instrumenatrului utilizat in manoperele parentarele, etc.)
si sexuala (contact sexual protejat).
Masuri
specifice
Profilaxia pasiva. Eficacitatea imunoglobulinelor specifice
anti-HBs in prevenirea infectiilor HBV a fost demonstrata. Imunizarea
pasiva a fost utilizata fie ca protectie dupa expunerea la
riscul de infectare, ca de exemplu in cazul unei intepaturi
accidentale, fie ca tratament preventiv administrat regulat personalului din
unitati de hemodializa cronica, inainte de era vaccinurilor
anti-HBV.
Profilaxia activa. Vaccinurile
utilizate initial au fost derivate din plasma purtatorilor HBV. Ulterior, au aparut vaccinuri produse
prin inginerie genetica (vaccinuri recombinante). Incepand cu 1985, au
fost elaborate doua tipuri de vaccinuri : cele produse in celule de levuri
si cele produse in celule de mamifere. Aceste vaccinuri
recombinante se caracterizeaza prin faptul ca nu contin virus
integral ci doar AgHBs.
Virusul hepatitic D (HDV, agentul delta)
Agentul cunoscut ca HDV (virus hepatitic D) a fost decelat sub
forma unui nou antigen nuclear care aparea in hepatocitele unor
pacienti infectati cu HBV. Acesta a fost denumit antigen delta
(AgHD) si este frecvent asociat cu forme mai
severe de hepatita. S-a demonstrat ulterior ca AgHD
intra in compozitia unor particule virale defective de 35-37 nm.
care apar in titru ridicat comparativ cu cel al
particulelor HBV 'helper'.
Morfologie si structura
Particulele HDV
(Fig ) sunt constituite dintr-o anvelopa
externa lipidica ce contine AgHBs, care incapsideaza AgHD
si o molecula mica de ARN monocatenar, circular, covalent
inchis. Aceste proprietati neobisnuite se aseamana cu
cele ale ARN-urilor unor particule viroid-like, sateliti ai unor virusuri
ai plantelor care
influenteaza dramatic evolutia bolii initiate de virusul
helper.
HDV este un viroid de 35 nm, cu
dubla anvelopa. Sinteza anvelopei externe, constituita din
AgHBs, depinde de HBV, deoarece HDV este un virus defectiv. In schimb, sinteza
anvelopei interne, formata de antigenul delta (AgHD), depinde de genomul
HDV. Desi exista un numar de cadre libere de decodare (ORF), s-a
demonstrat ca doar un singur ORF codifica proteina virala.
Replicare
Dupa
patrunderea intr-o celula, ARN-HDV se replica eficient
fara a necesita nici o interventie a HBV, sugerand ca
functia 'helper' HBV (poate singura) este de a asigura intrarea
in celula prin interactiunea suprafetei celulare cu anvelopa
virala continand AgHBs.
Ca
si viroizii sau virusurile satelite ale plantelor, ARN-HDV se replica
circular si poseda activitati de autoclivaj si de
ligare. Totusi, HDV este mai complex deoarece genomul sau
codifica doua proteine virale specifice : antigenul mare si cel
mic al HDV. AgHD mic este esential pentru replicarea virala in timp
ce AgHD mare este esential pentru asamblarea particulei virale.
Patogeneza
Infectia
HDV nu se poate produce in absenta HBV, deci transmiterea HDV se produce
de obicei pe cale parenterala, in mod similar cu transmiterea HBV. De
mentionat ca transmiterea pe cale sexuala este mai putin
eficace decat in cazul HBV.
Principalele
grupe de risc pentru infectia HDV sunt toxicomanii care folosesc droguri
cu administrare intravenoasa (prin folosirea in comun a acelor si
seringilor), pacientii cu tratamente injectabile multiple cu
fractiuni plasmatice, imigrantii din zonele delta-endemice si
purtatorii HBV supusi riscului infectiei cu HDV.
Incubatia
hepatitei delta este cuprinsa intre 21-60 de zile, debutul este de obicei
acut, iar prezenta icterului este foarte variabila .
Portajul cronic face parte din
evolutie si sta la originea a peste 30% din decesele raportate
in formele cronice. Exista
doua forme de infectie acuta : co-infectia si
suprainfectia.
In
cazul co-infectiei, subiectul este simultan infectat cu HBV si HDV.
Evolutia spre cronicizare este rara (5% din cazuri). Detectarea
ARN-HDV in ser si a AgHD in ficat sunt posibile in cursul incubatiei,
ulterior aparitiei AgHBs in ser. Cresterea valorilor transaminazelor,
adesea difazica, acompaniaza icterul si simptomele subiective,
rapid urmate de aparitia anticorpilor anti-HDV. Dupa disparitia
AgHBs, replicarea HDV si boala diminua. De semnalat ca doar
serologia permite supozitia de co-infectie HBV-HDV.
In
cazul suprainfectiei cu HDV a unui purtator cronic de HBV,
evolutia spre cronicizare se produce in peste 80% din cazuri, cu
persistenta AgHD in ficat. Mortalitatea formelor acute este de 2-20%
si este determinata de evolutiile fulminante. Deci, formele
cronice rezulta cel mai des prin suprainfectia unui purtator
cronic HBV. Aceasta forma se caracterizeaza prin cresterea
nivelurilor transaminazelor cu caracter persistent, insotita de
aparitia anticorpilor anti-HDV care sunt prezenti in titruri mari,
durabile. ARN-HDV persista in ser si 70-80% din formele cronice
evolueaza spre ciroza. Aceasta evolutie se produce adesea
in mai putin de 2 ani (15% din cazuri).
Diagnostic
de laborator
A. Serologia
Serodiagnosticul
infectiei HDV se bazeaza in principal pe teste pentru evidentierea
AcHD, avand in vedere ca AgHD are o perioada foarte scurta de
prezenta in ser. Exista teste disponibile atat pentru IgM-HD cat
si pentru IgG-HD (Tabel X).
Tabel X. Diagnosticul serologic al infectiei cu HDV.
|
Markeri
|
Coinfectie
acuta
|
Suprainfectie
acuta
|
Hepatita D cronica
|
|
AgHBs
|
+
|
+
|
+
|
|
IgM-HBc
|
+
|
|
|
|
Ac-HD
|
+,titruri slabe,tranzitorii1
|
+,titruri in crestere,durabile2
|
+,titruri ridicate ,durabile3
|
|
HDV in ficat
|
+
|
+
|
+ +
|
1, 2 si se efectueaza minimum 2 testari succesive (in faza
acuta si in convalescenta), deoarece Ac-HD pot fi
tranzitorii, in titruri scazute si cu aparitie
tardiva in timpul fazei acute.
B. Tehnici de biologie
moleculara
- Decelarea ARN-HDV prin PCR
Virusul hepatitic C (HCV)
Virusul hepatitic
C este principalul agent al hepatitelor desemnate
anterior drept 'non-A-non-B'. In prezent HCV este incadrat in familia
Flaviviridae, care a fost recent subdivizata in 3 genuri
:
- genul Flavivirus - include foste arbovirisuri (v. febrei galbene, v.
febrei Dengue)
- genul
Pestivirus - virusuri implicate in patologia animala
- genul Hepacavirus - nume propus pentru
diferitele variante de HCV
Morfologie si structura
Virionii de forma sferica
au diametrul cuprins intre 55-65nm. Structura virionului include :
- anvelopa - de natura lipo-proteica (strat lipidic in
care sunt inserate 2 proteine organizate in complexe dimerice : E1 si E2)
- capsida - cu simetrie icosaedrica
- genomul - ARN monocatenar cu polaritate pozitiva.
Genomul HCV
codifica o poliproteina ce este ulterior clivata rezultand
proteinele virale functionale :
- proteine structurale - C -
capsidala si E1, E2/NS1 - de anvelopa, codate de genele de la
capatul 5' al genomului
- proteine
nestructurale - 6 proteine reglatoare codate de genele de la capatul 3' al
genomului (NS2, NS3, NS4a, NS4b, NS5a, NS5b).
La nivelul capatului 3' al genomului
se gaseste o regiune cu dimensiuni si secventa
variabile.
Replicare
Mecanismele
sunt inca incomplet elucidate din cauza absentei, pana in
prezent, a unor sisteme de cultivare eficace. S-ar parea
ca hepatocitele umane in cultura primara sau liniile celulare
hepatice imortalizate pot fi infectate.
Un alt aspect interesant este tropismul HCV pentru
polimorfonucleare.
Variabilitate
genetica. Este importanta (ca si in
cazul altor virusuri ARN), avand la baza incapacitatea ARN-polimerazei
virale de a corecta erorile survenite in cursul replicarii. Aceste erori se traduc prin
mutatii. Unele dintre aceste erori sunt tolerate in timp ce altele pot aboli sau modifica profund
functionalitatea ARN viral. Prin acest mecanism de 'eroare si selectie' apar
variante multiple genomice. La aceasta selectie de mutante se
adauga si presiunea exercitata de sistemul imun al gazdei, ceea
ce duce la variabilitatea genica extrem de ridicata a ARN-HCV.
Clasificare (tipuri si subtipuri HCV). Ca urmare a
hipervariabilitatii genetice constatate in cazul HCV s-a ajuns la
identificarea de tipuri si subtipuri de molecule ARN-HCV (10 tipuri
si 52 subtipuri), intre care, pana in prezent nu s-a putut demonstra
recombinarea.
Patogeneza
Infectia
HCV se poate transmite prin mai multe cai (vezi Tabel X), conturandu-se
astfel grupe de populatie cu risc crescut de infectare :
receptorii de transfuzii de sange, toxicomanii (folosirea in comun a
seringilor), partenerii sexuali ai persoanelor infectate,
nou-nascutii mamelor infectate.
a ) Manifestari hepatice
Indiferent de calea de infectare,
dupa o incubatie de pana la 180 de zile, survine un episod de
hepatita acuta simptomatica sau asimptomatica. Formele
icterice sunt extrem de rare. De cele mai multe ori, simptomatologia
hepatica poate trece neobservata, ea fiind acompaniata de
simptome atipice (90% din cazuri). Testele de hepatocitoliza sunt
elevate in cursul fazei acute. Formele fulminante sunt o
exceptie.
In 60-80% din cazuri, virusul nu poate fi
eliminat si infectia se cronicizeaza. Mecanismele
cronicizarii nu sunt perfect elucidate, dar este probabil ca
hipervariabilitatea genetica a HCV joaca un rol important (mutante
care scapa recunoasterii de catre sistemul imun al gazdei). De
asemenea, mecanisme reglatoare complexe permit ca nivelul replicarii HCV
sa fie scazut, compatibil cu 'supravietiurea'
hepatocitului. In unele cazuri se discuta
implicarea mecanismelor autoimune.
Infectia
cronica HCV este de asemenea pauci- sau asimptomatica,
cu hepatocitoliza moderata sau chiar absenta (fluctuatii
ale valorilor transaminazelor). Histologia hepatica este oarecum
caracteristica (evocatoare) pentru infectia HCV :
aspecte de inflamatie portala si lobulara asociate cu
necroza periportala, la care se adauga leziuni de steatoza
hepatica.
Riscul
de dezvoltare a unei ciroze hepatice si / sau a carcinomului hepatocelular
primar exista si este augmentat in cazul
asocierii altor factori de agresiune hepatica (alcool, infectie HBV
cronica).
b ) Manifestari extrahepatice
Sunt urmarea faptului ca HCV nu poseda numai tropism
hepatocitar. Patologia extra-hepatica indusa de HCV cuprinde o
serie de afectiuni cu mecanisme patogenetice mai mult sau mai putin elucidate :
1 - Anomalii imunologice
Mecanisme :
- formare
de complexe imune circulante (crioglobulinemiile mixte anterior considerate
'esentiale')
- mecanisme
autoimune
Manifestari clinice : cutanate (purpura), articulare
(artrite), nervoase (neuropatii senzitive periferice), renale (glomerulonefrita
membrano-proliferativa), tiroidiene (tiroidite autoimune)
2 - Porphiria cutanea tarda
(forma sporadica) - deficienta enzimei hepatice
uroporfirinogen-decarboxilaza
Mecanism : incomplet elucidat (probabil HCV
joaca rol de declansare a maladiei pe un fond genetic predispus)
3 - Lichenul plan -
legatura incomplet elucidata cu infectia HCV
4 - Sindromul Gougerot-Sjogren
- (sialadenita limfocitara) - idem
Diagnostic de laborator
A. Metode indirecte -
Serologia
Clonarea
genomului HCV a permis producerea in cantitati mari
de proteine recombinante si peptide de sinteza codate de genele
structurale si nestructurale ale virusului. Aceste antigene virale sunt
utilizate in testele serologice, permitand detectarea specifica a anticorpilor anti-HCV. Diagnosticul presupune utilizarea a
doua tipuri de teste : 1. de depistare si 2.
de validare (de confirmare).
1. Teste de depistare - ELISA -
proteinele recombinante (antigenele) virale sunt fixate pe suportul solid
(polistiren, nitroceluloza), iar detectarea anticorpilor specifici se
realizeaza prin imunocaptura.
2. Teste de validare - utilizeaza tehnici de imuno-blotting - RIBA
(Radio-immunoblot- assay)
B. Metode directe - Tehnici de biologie
moleculara
- PCR (Polymerase Chain Reaction)
- NASBA (Nucleic Acid Sequence
Base Amplification)
Profilaxie
Masurile
profilactice nespecifice sunt similare cu cele impotriva infectiei HBV.
Profilaxia specifica activa (vaccinarea) este inca in studiu.
Datorita extrem de ridicatei variabilitati genetice, prepararea
unui vaccin anti-HCV nu a putut fi inca realizata.
Virusul hepatitic E
Este provizoriu incadrat in familia
Caliciviridae.
Morfologie si structura
Virionul
este lipsit de anvelopa, avand forma
sferica si diametrul cuprins intre 27-34 nm.
Genomul
este ARN monocatenar cu polaritate pozitiva, cuprinzand 3 ORF :
- ORF1- codifica proteinele
nestructurale
- ORF 2 si ORF3 - codifica proteine structurale.
Replicare
Se produce in hepatocit, dar mecanismul este momentan
neelucidat
Patogeneza
Infectia
HEV are multe puncte comune cu infectia HAV
(calea de transmitere fecal-orala, replicarea intrahepatocitara).
Si in cazul infectiei HEV se parccurg etape similare
: sediul initial de replicare este intestinul (excretie
intensa de virioni), urmeaza apoi o viremie de scurta
durata si infectarea hepatocitului cu hepatocitoliza si
inflamatie locala (nu prin efect citopatic direct, ci prin raspunsul
imun al gazdei).
Nu se cunosc date care sa ateste
evolutia cronica.
Anticorpii de tip IgM apar concomitent cu cresterea
transaminazelor si apoi titrul lor scade treptat (in decurs de 3 luni)
fiind inlocuiti cu IgG-HEV. Persistenta in ser a anticorpilor de tip IgG este mai redusa
decat in infectia cu HAV. IgG-HEV se negativeaza in cativa ani.
In
peste jumatate din cazuri infectia HEV este asimptomatica,
formele manifeste clinic fiind mai frecvente la adolescenti si
adulti tineri. Evolutia infectiei este benigna, cu
exceptia situatiilor cand ea survine la gravide. Infectarea
gravidelor evolueaza sever, cu forme fulminante urmate de deces in
pana la 20% din cazuri.
Diagnostic
de laborator
A. Diagnostic direct
Evidentierea
HEV in scaun prin microscopie electronica este relativ dificila, din
aceleasi motive ca in infectia HAV. HEV poate fi detectat prin
imunomicroscopie electronica, iar genomul viral poate fi pus in
evidenta prin tehnici de biologie moleculara (PCR).
B. Diagnostic indirect
Consta
in decelarea anticorpilor anti-HEV in ser. Se utilizeaza tehnici ELISA
si Western blot. Diagnosticul ar necesita (ca si in cazul hepatitei
A) detectarea IgM-HEV, care inca nu este de uz curent.
Virusul hepatitic F
A
fost identificat in cazuri de hepatite cu transmitere non-parenterala
non-A non-E (si non-B, non-C, non-D), semnalate in mai multe
tari. Virusul a fost denumit HFV (Hepatitis French Virus).
Este un virus ADN dublu
catenar, cu dimensiuni cuprinse intre 27-37 nm.
Grupul
virusurilor hepatitice GB
Mai
multe cazuri de hepatite acute cu transmitere parenterala au fost
considerate ca fiind produse de 2 agenti virali nou evidentiati,
cu structura asemanatoare flavivirusurilor dar totusi
diferita de cea a HCV. Aceste 2 virusuri au fost desemnate drept virusul
hepatitic GB-A si GB-B (GBV-A si, respectiv GBV-B) (GB fiind initialele unui chirurg care a
dezvoltat o hepatita acuta si in serul caruia a fost
identificat pentru prima data un agent viral de acest tip).
Un al treilea virus GB
(GBV-C) a fost recent identificat, discutandu-se posibila sa implicare in
hepatite cronice.
Tabel X. Virusuri hepatitice identificate pana in prezent
|
Virus
|
Familie
Genom
|
Transmitere
|
Debut
|
Incubatie
|
Severitate in infectia
acuta
|
Mortalitate
|
Cronicizare
|
|
A
|
Picornaviridae
ARN
|
fecal-orala
|
acut
|
20-50 zile
|
medie
|
sub 0,5%
|
NU
|
|
B
|
Hepadnaviridae
ADN
|
-parenterala
-sexuala
- verticala
- intrafamiliala
|
acut sau insidios
|
45-160 zile
|
uneori ridicata
|
1-2%
|
DA
|
|
C
|
Flaviviridae
?
ARN
|
-parenterala
-sexuala
-verticala
|
variabil
|
14-180 zile
|
de obicei forme subclinice
|
05-1%
|
DA
|
|
D
|
viroid-like
ARN
|
-parenterala
-sexuala
|
variabil
|
15-60 zile
|
variabila
|
ridicata
|
DA
|
|
E
|
Caliciviridae
?
ARN
|
fecal-orala
|
acut
|
15-50 zile
|
medie sau
severa
(la gravide)
|
1-2%
Gravide : 20%
|
NU
|
|
F
|
neincadrat
ADN
|
non-parenterala
|
acut
|
?
|
?
|
?
|
?
|
|
G
(GB)
|
Flaviviridae
?
ARN
|
parenterala
|
?
|
?
|
?
|
?
|
posibila
?
|
FAMILIA
HERPESVIRIDAE
CLASIFICARE
Familia Herpesviridae
cuprinde un mare numar de virusuri ce pot infecta omul si unele
animale (peste 100 de virusuri). Dintre acestea, agentii cu
semnificatie pentru patologia umana sunt grupati in 3 subfamilii
:
- Subfamilia Alphaherpesvirinae : - Virusul
Herpes simplex tip I
- Virusul Herpes simplex tip II
- Virusul varicelo-zosterian
- Subfamilia Betaherpesvirinae : - Virusul
cytomegalic (Cytomegalovirus)
- Virusul herpetic uman tip 6
- Virusul herpetic uman tip 7
- Subfamilia Gammaherpesvirinae
: - Virusul Epstein-Barr
CARACTERE COMUNE
Morfologie si structura
Virionii sunt de forma sferica avand dimensiuni intre
180-200nm. Ei sunt constituiti dintr-un genom ADN liniar,
dublu catenar ce codifica 50-70 proteine virale.
Genomul este inclus intr-o capsida cu
simetrie icosaedrica, in jurul careia se gaseste 0 anvelopa
cu o compozitie complexa, in doua straturi. Stratul situat in proximitatea capsidei este de
natura proteica, avand o structura granular-amorfa. Acesta
este acoperit de un invelis extern lipidic pe care proemina spiculi
constituiti din glicoproteine (Fig. ?).
Replicare
Dupa atasarea la celula gazda,
penetrarea virusului in celula se realizeaza prin mecanismul de
fuziune a anvelopei virale cu membrana celulara. Patruns in
citoplasma, virionul se decapsideaza. Capsida este distrusa la
nivelul citoplasmei celulare, iar genomul viral migreaza in nucleu.
Urmeaza ciclul replicativ intranuclear, cu etapele caracteristice pentru
moleculele de ADN dublu catenar. In urma replicarii rezulta molecule
incapsidate care sunt eliberate din nucleu. La nivelul membranei nucleare a celulei gazda
sunt sintetizate anvelopele virale. Virionii sunt apoi transportati la nivelul
membranei citoplasmatice externe si eliberati.
3. SUBFAMILIA ALPHAHERPESVIRINAE
Cuprinde
virusurile Herpes simplex tip I (HSV-1) si II (HSV-II) si virusul
varicelo-zosterian (VZV). In privinta HSV-1 si HSV-2 nu se poate face
o demarcatie clara a sindroamelor pe care le determina dar, in
general se admite ca HSV-1 produce simptome localizate in jumatatea
superioara a corpului iar HSV-II este de obicei implicat in
infectiile genitale.
Ca tip de infectie,
virusurile apartinand acestei subfamilii se incadreaza in categoria
'infectii persistente cu debut acut', la care cronicizarea este
data de latenta rezultata din persistenta ADN-ului viral in
celula gazda. Ca urmare, in cazul infectiilor cu HSV se opereaza
cu notiunile de infectie primara, infectie
initiala, celula infectata latent, reactivare
si recurenta (recrudescenta).
a. Infectia primara
- primul contact infectant cu HSV-1 sau HSV-2
b. Infectie initiala - primul contact infectant cu
HSV-2 la o persoana infectata primar cu HSV-1 sau invers.
c. Celula infectata
latent - celula in care virusul infectant persista
d. Reactivare - productia de virus
(replicarea activa) in celula infectata latent.
e. Recurenta
(recrudescenta) - reactivare manifesta clinic prin simptome
caracteristice.
Virusul
Herpes simplex tip I
Determina infectii cu poarta de
intrare tegumentara sau mucoasa. De obicei patrunderea sa in
organism se face la nivelul unei solutii de continuitate la nivelul
tegumentului sau mucoasei bucale sau la nivelul conjunctivei oculare.
Datorita replicarii virale
active la nivelul portii de intrare se produc simptome locale
caracteristice:
- gingivo-stomatita acuta - eruptie
veziculo-ulcerativa
- keratoconjunctivita.
Replicarea are loc si la nivelul
ganglionilor limfatici regionali. Dupa depasirea acestora se
produce viremia initiala cu localizarea consecutiva a virusului
la nivelul unor viscere. In cazurile de insuficienta a sistemului
imun al gazdei se pot produce forme severe de boala cu diseminare
viscerala masiva :
- herpesul generalizat
- meningita, meningo-encefalita herpetica.
Infectia
primara (initiala) devine persistenta datorita
faptului ca virusul ajunge pe calea nervilor senzitivi in ganglionii
medulari senzitivi, unde replicarea sa continua fara ca virusul
sa fie eliminat. Persistenta
genomului viral la acest nivel se face sub forma episomala
(non-integrativa).
Infectia primara
este adesea achizitionata in copilarie prin contactul intim cu
persoane infectate. Dupa remiterea simptomelor locale, infectia
persistenta poate evolua cu perioade asimptomatice alternand cu episoade
de reactivare a caror intensitate si frecventa tinde
sa descreasca cu varsta. In cazul episoadelor recurente de
keratoconjunctivita herpetica exista pericolul afectarilor
oculare severe ireversibile (cicatrici corneene, orbire).
Virusul
Herpes simplex tip II
Infectia
se produce prin contact sexual, patrunderea virusului in organism
facandu-se la nivelul unor solutii de continuitate ale mucoasei
genitale. De asemenea,
HSV-2 poate fi transmis vertical (de la mama infectata la
nou-nascut).
Deoarece,
de obicei, infectia cu HSV-1 se produce la varste tinere (copilarie),
infectia cu HSV-2 este cel mai frecvent dobandita sub forma de
infectie initiala (mai rar ca infectie primara).
Manifestarile clinice locale sunt :
-la barbat - manunchi de vezicule situate la nivelul penisului,
interesand uneori meatul urinar cu disurie consecutiva
-la femeie - grupuri de vezicule la nivel labial, vulvar, perineal cu
posibilitatea de extindere pana la nivelul regiunii interne a coapsei sau
la nivelul colului uterin (cervicita herpetica).
La ambele sexe leziunile
veziculare sunt insotite de adenopatii inghinale.
Episodul initial este urmat de
recurente cu frecventa variabila.
La
nou-nascut HSV-2 se transmite, dupa cum am mentionat, de la mama
infectata, in cursul nasterii (traversarea canalului cervico-vaginal
infectat). Simptomatologia apare la cateva zile de la nastere si ea
variaza de la aparitia catorva vezicule tegumentare pana la
eruptii veziculo-ulcerative generalizate insotite de visceralizare
(afectare hepatica, cerebrala) cu posibila evolutie
letala.
Virusul varicelo-zosterian
Denumirea
indica cele doua afectiuni pe care virusul le poate produce
: varicela in cazul infectiei
primare, zona zoster prin reactivare.
Infectia
primara se produce in urma patrunderii virusului prin mucoasa
nazofaringiana. La acest nivel se produce replicarea virala
urmata de diseminarea prin contiguitate, pe cale limfatica si
sanguina. Dupa patrunderea si replicarea activa a
virusului in sange se produce invazia ectodermului. Aceasta se traduce clinic
prin aparitia de leziuni caracteristice :
-la nivel tegumentar - exantem - eruptie generalizata cu
leziuni ce prezinta o evolutie tipica : macule - papule -
vezicule - cruste
-la nivelul mucoaselor (respiratorie, digestiva, genitala) -enantem
Diseminarea sanguina se
realizeaza in valuri succesive ce urmeaza viremiei initiale,
motiv pentru care eruptiile au un caracter polimorf (elemente eruptive in
stadii diferite - de la macula la crusta) prezente simultan.
Complicatii :
- Infectia bacteriana a veziculelor, cu formarea de pustule
dupa vindecarea carora pot ramane cicatrici tegumentare
persistente
- Encefalita post-varicela - mai frecventa la pacienti
imunodeficienti
- Pneumonia variceloasa - idem.
- Alte visceralizari.
Reactivarea
infectiei se produce datorita faptului ca in cursul
infectiei primare virusul migreaza pe calea : nerv senzitiv -
ganglion senzitiv, cantonandu-se sub forma latenta la acest nivel.
Sub influenta unor factori imunosupresori, se produce reactivarea
urmata de recrudescenta : replicare activa virala in
celulele ganglionului senzitiv, urmata de eliberarea virionilor care pe
calea nervilor senzitivi ajung la nivelul terminatiunilor nervoase senzitive
tegumentare. Rezultatul este o eruptie veziculoasa strict
localizata (in mod caracteristic) la teritoriul cutanat al nervului
respectiv. Eruptia este precedata si acompaniata de
hiperestezia dureroasa a zonei respective. Veziculele vor parcurge
aceleasi etape evolutive descrise la infectia primara.
Complicatii :
- Durerea persistenta la nivelul zonei interesate (poate persista
luni-ani de zile)
-Zona zoster oftalmic - se produce prin interesarea ramurii oftalmice a
nervului trigemen
-Zona zoster generalizat - clinic se aseamana cu tabloul eruptiv
din varicela, cu deosebirea ca la nivelul dermatomului afectat
eruptia este mai pronuntata
-Encefalita zosteriana - complicatie rara.
Diagnostic de laborator
A. Microscopia electronica. Produsul patologic examinat este
lichidul vezicular care contine numerosi virioni cu aspect
caracteristic. Distinctia
intre HSV-1, HSV-2 si VZV nu se poate face.
B. Imunofluorescenta. Utilizeaza anticorpii
monoclonali anti-HSV-1 si anti-HSV-2 sau anti-VZV, marcati cu o
substanta fluorescenta. La examinarea in lumina
ultravioleta, virionii vor aparea sub forma de particule
galben-verzui. In acest fel se face distinctia clara intre cele 3
virusuri.
B. Cultivare. In cazul HSV-1 si HSV-2, recoltarea se face
la nivelul leziunilor veziculare. Cultivarea se realizeaza in culturi
celulare (linii celulare diploide umane), diagnosticul bazandu-se pe observarea
efectului citopatic : aparitia de focare de celule mari, multinucleate cu
incluziuni intranucleare.
In cazul VZV cultivarea in
culturi de celule nu se utilizeaza datorita faptului ca acest
virus creste extrem de lent, iar aparitia efectului citopatic se
poate observa tardiv (dupa 3 saptamani).
Oua embrionate.
Inocularea in membrana corio-alantoida a oualor embrionate
determina ingrosari localizate ale acesteia.
Animale de
experienta. Inocularea intracerebrala sau
intraperitoneala la soareci nou-nascuti sau adulti
determina imbolnaviri letale.
Scarificarea
corneeana la iepure determina producerea keratoconjunctivitei.
Inocularea intraplantara
la cobai determina eruptie veziculara locala.
C. Serologia. Testele serologice de rutina (reactia
de fixare a complementului, reactia de neutralizare) sunt de utilitate
redusa datorita cross-reactivitatii care face
imposibila distinctia intre HSV-1 si HSV-2.
Testele imunoenzimatice
(ELISA) sau radioimune (RIA) evidentiind anticorpii specifici de tip IgM
si IgG anti-HSV-1/ 2 sunt utile doar in cazul diagnosticarii
infectiei primare.
Anticorpii de tip IgG
persista perioade indelungate fara a putea preveni
reactivarile. De altfel, in cazul reactivarilor, titrurile de
anticorpi specifici prezinta modificari necaracteristice (uneori
cresteri nedecelabile), motiv pentru care utilitatea diagnostica este
practic nula.
In cazul infectiei cu
virusul varicelo-zosterian (VZV) serologia are valoare diagnostica mai
mare, desi posibilitatea de cross-reactivitate cu HSV-1 sau -2 nu este
exclusa. Astfel, in cazul varicelei, raspunsul imun este mai clar
delimitat decat in cazul HSV1 si 2. Anticorpii specifici IgM-anti-VZV apar
in cursul primei saptamani si persista aproximativ 3 luni,
fiind apoi substituiti de IgG. In
cazul unui atac ulterior de zona-zoster, IgM-anti-VZV vor fi din nou decelati
in titruri crescute.
Profilaxie
Vaccinuri continand virus viu atenuat.
4. SUBFAMILIA BETAHERPESVIRINAE
Virusul
cytomegalic (Cytomegalovirus - CMV)
Infectiile cu CMV sunt deosebit de frecvente dar ele sunt in
general asimptomatice la adult. In schimb, infectiile survenite la
nou-nascut si sugar evolueaza foarte sever putand determina
decesul.
Calea
de patrundere a virusului in organism difera in functie de
varsta si de circumstantele in care survine infectia (Tabel
X).
Tabel X. Mecanismele
infectarii cu CMV
|
PACIENT
|
MECANISM DE INFECTARE
|
|
Fat (mama cu
infectie CMV)
|
-infectie
transplacentara
|
|
Nou-nascut (mama cu
infectie CMV)
|
-infectie intra-partum
-infectie prin
alaptare
|
|
Copil
|
-infectie interpersonala (contact
cu saliva, urina infectata)
|
|
Adolescent, adult
|
-contact sexual
-transfuzie de sange sau preparate de sange
-transplant de organe,
tesuturi
|
La
nou-nascut infectia primara (congenitala sau
neo-natala) evolueaza sub forma asa numitei boli a incluziilor cytomegalice. Numele este dat de prezenta unor incluziuni
celulare intranucleare patognomonice si cu vacuolizarea citoplasmei.
Aceste leziuni celulare sunt generalizate la nivelul organelor hematopoetice
si sistemului nervos si ele duc la exitus.
La copil si
adolescent infectia primara poate evolua simptomatic benign, mimand o
mononucleoza infectioasa : febra, limfadenopatii,
hepatosplenomegalie si modificari ale tabloului sanguin (vezi mai jos
- Virusul Epstein-Barr).
La adult, dupa cum am
aratat, infectia este in general asimptomatica, exceptie
facand cazurile de imunosupresie, cum sunt receptorii de transfuzii
multiple sau transplant. De altfel, in aceste cazuri se poate produce fie o
infectie primara (sange transfuzat sau organ transplantat infectat)
fie o reactivare a unei infectii latente. Reactivarea infectiei CMV in cazul
receptorilor de transplant este favorizata de tratamentul imunosupresor
asociat interventiei chirurgicale. Cazurile cu depresie imunitara pot
evolua letal in urma visceralizarii infectiei CMV (pneumonii
interstitiale, hepatite, etc.), mai ales atunci cand infectia este
primara. In general infectiile reactivate au o evolutie
benigna.
Mecanismul
prin care se realizeaza persistenta infectiei CMV nu este pe
deplin elucidat : fie infectie latenta cu persistenta ADN viral
sub forma episomala, fie integrare ADN viral in genomul leucocitelor.
Pe
langa reactivarea posibila a infectiei CMV in conditiile
descrise, exista si situatii in care poate surveni o reinfectie
cu o tulpina virala diferita.
Virusul herpetic uman tip 6 (HHV-6 Virusul herpetic uman tip 7 (HHV-7)
Relativ recent izolat si caracterizat,
HHV-6 este implicat in etiologie a doua sindroame :
a. Exantemul subit (Roseola infantum) -
boala febrila asociata cu eruptie cutanata, la copii
mici
b. Limfadenopatia (la adulti).
HHV-6
a fost izolat si din mononuclearele pacientilor HIV pozitivi. Se pare
ca afinitatea HHV-6 fata de limfocitele T CD4-pozitive
accelereaza evolutia infectiei HIV spre SIDA.
HHV-7
a fost izolat din celule mononucleare la indivizi sanatosi.
Semnificatia in patologie nu a fost inca elucidata.
Diagnostic de laborator.
CMV
poate fi izolat din urina, saliva, sange.
A. Microscopie.
a. In sectiuni histologice se observa
aspectul caracteristic de celule mari cu incluziuni in forma de 'ochi
de bufnita' (Fig. 56-17, Murray, p. 589). Aceste 'celule
citomegalice' sunt prezente in majoritatea viscerelor.
b. Imunofluorescenta utilizand anticorpi
monoclonali constituie o posibilitate de diagnostic rapid. In acest fel se
poate decela virusul in lichidul de spalatura bronsica
sau bronho-alveolara pentru diagnosticarea pneumoniei CMV.
B. Cultivare. Se
realizeaza pe culturi celulare fibroblastice umane. Efectul citopatic
consta in aparitia de focare de celule mononucleare cu incluziuni
intranucleare caracteristice, insa aceste modificari sunt tardive
(pot aparea in decurs de 4 saptamani).
Infectia nu poate fi
studiata experimental pe animale datorita strictei
specificitati de specie.
C. Serologie. Metodele imunoenzimatice (ELISA) si testele
radioimune (RIA) sunt utile pentru decelarea anticorpilor specifici de tip IgM.
Ele se efectueaza
pentru diagnosticul infectiei verticale cu CMV, cand in sangele din
cordonul ombilical se deceleaza IgM-CMV si pentru diagnosticul
infectiei acute sau recente cu CMV.
Decelarea anticorpilor de tip IgG-CMV (prin
reactia de fixare a complementului, ELISA, RIA) denota infectia
CMV in antecedente. Aceste teste sunt utile pentru triajul donatorilor de sange
sau organe, precum si pentru supraveghere epidemiologica.
SUBFAMILIA GAMMAHERPESVIRINAE
Virusul Epstein-Barr (EBV)
Determina
mononucleoza infectioasa, fiind totodata un virus cu
potential oncogen (limfomul Burkitt, carcinomul nazo-faringian). Se
caracterizeaza prin tropism limfocitar si epitelial.
Exista
doua tipuri : EBV-A si EBV-B, avand caracteristici biologice
diferite. Tipul B pare a fi intalnit cu precadere in Africa si, de
asemenea la pacienti imunosupresati. Cele doua tipuri pot
coexista intr-o gazda infectata.
EBV
patrunde in organism pe cale oro-faringiana, migrand apoi la nivelul
glandelor salivare (parotida, glande salivare submandibulare, sublinguale)
datorita tropismului epitelial. La acest nivel virusul se replica
activ si este eliberat in saliva, penetrand insa totodata
in limfocite datorita tropismului limfocitar. In acest fel, EBV va fi vehiculat
de limfocitele infectate, pe cale sanguina, cantonandu-se in toate
tesuturile limfoide.
EBV
are efect transformant asupra unei parti a limfocitelor
infectate care vireaza spre forme blastice continand genom viral.
Procesul este denumit 'imortalizare' si este cu mare
probabilitate implicat in oncogeneza determinata de EBV. In acest fel,
infectia EBV persista.
O
alta parte a limfocitelor B infectate sunt gazde ale unei replicari
virale active cu eliberare de virioni maturi prin liza celulara.
Limfocitele
B infectate cu EBV exprima antigene virale :
- EBNA ('Epstein-Barr nuclear
antigen') - la nivelul nucleilor limfocitelor infectate
- LYDMA ('lymphocyte-detected membrane antigen) - la nivelul membranei
celulare ; constituie tinta pentru limfocitele T citotoxice
- EA ('early antigen') - antigen precoce
- VCA ('viral capsid antigen') - antigen capsidal viral
- MA ('membrane antigen') - antigen membranar.
Dupa aparitia
antigenelor virale precoce ('early') infectia poate evolua fie
acut, (cu aparitia antigenelor tardive), fie persistent.
a. Mononucleoza infectioasa . Se transmite interpersonal,
prin contact cu saliva infectata. Se manifesta prin febra,
faringita, limfadenopatie (initial cervicala, apoi
generalizata), hepatosplenomegalie.
Antigene virale : EBNA,
LYDMA, EA, VCA.
Tablou sanguin periferic
patognomonic : limfocite anormale (15-90%), bazofile, cu vacuole
citoplasmatice, fragmentare nucleara, pe fond initial de leucopenie
(circa 1 saptamana) urmat de hiperleucocitoza
persistenta (circa 5 saptamani).
b. Limfomul Burkitt . Este o forma
de neoplazie cu malignitate exterm de ridicata. Se intalneste mai ales in Africa, Papua Noua
Guinee si consta din tumori localizaze cel mai frecvent la nivel
maxilar (mai rar orbitar). Interesant este faptul ca in celulele tumorale
izolate de la cazurile din zonele endemice s-a pus in evidenta
ADN-EBV sub forma episomala, in timp ce in cazurile sporadice,
intalnite in alte zone geografice, acest
lucru nu s-a evidentiat.
Antigene virale : LYDMA,
EBNA (inconstant - EA).
c. Carcinomul nazofarnigian .
Este o forma de neoplasm nedifirentiat la nivel nazo-faringian,
extrem de invaziv, mai ales la nivelul ganglionilor limfatici cervicali. Se intalneste cu precadere
in Extremul Orient.
Antigene
virale : idem b.
Diagnostic
de laborator
Izolarea
si cultivarea virusului in culturi de celule nu sunt realizabile.
Diagnosticul de laborator se bazeaza pe
aspectul frotiului sanguin periferic si pe serologie.
Tablou sanguin periferic. Hiperleucocitoza (pana la
20 milioane) cu limfocitoza marcata (pana la 50% din formula
leucocitara), cu limfocite atipice (nuclei neregulati).
Serologie.
a. Testul Paul-Bunnell. Se bazeaza pe existenta anticorpilor
heterofili produsi de limfocitele B sub actiunea EBV. Acesti
anticorpi produc aglutinarea eritrocitelor de oaie. Testul se pozitiveaza
incepand din a doua saptamana de boala.
b. Teste serologice de decelare a anticorpilor
fata de antigenele celulare (LYDMA, EBNA, EA, VCA).
Imunoflorescenta - detectarea antigenelor virale
Tehnici de biologie moleculara. - hibridizarea cu sonde ADN.
Familia
Orthomyxoviridae
Include virusurile care determina gripa,
infectie virala cu manifestari endemo-epidemice.
Clasificare
Exista
3 specii (serotipuri) de virusuri gripale : A, B si C. Deosebirile intre
ele sunt date de antigenele M (matrix) si NP (nucleoprotein) (vezi mai
jos). Tipul C difera semnificativ de tipurile A si B si este de
mai mica importanta pentru patologia umana.
Clasificarea in tipuri si subtipuri
are la baza structura antigenica a virusului gripal care include
antigene specifice de tip si de subtip (Tabel X).
Tabel X.
Clasificarea virusurilor gripale in tipuri si subtipuri.
|
Specificitate
|
Antigen
|
Caracteristici
|
|
De tip
|
NP (nucleopreoteina)
M (matrix)
|
- 3 tipuri : A, B, C
- 3 tipuri : A, B, C
|
|
De subtip
|
HA (Hemaglutinina)
N (neuraminidaza)
|
- 14 subtipuri HA (in patologia umana doar : HA1, HA2, HA3)
- 9 subtipuri (in patologia umana doar :
N1 si N2)
|
Morfologie si structura
Virionii
sunt de forma sferica sau alungita, cu diametrul de 100-200 nm,
prevazuti cu anvelopa. Acesti agenti sunt
caracterizati prin pleiomorfism, astfel incat uneori se pot observa
virioni cu forma filamentoasa si cu lungimi pana la 1000
nm. (Fig. 10.1., Offord, Collier, pag. 125)
In
structura virionului intra :
- Anvelopa - strat dublu lipoproteic ce
deriva din membrana celulei infectate. Stratul extern este prevazut
cu spiculi care contin hemaglutinina (HA) si neuraminidaza
(N). Stratul intern contine proteina M (matrix) cu rol in mentinerea
formei virionului.
Hemaglutinina
se gaseste sub forma inactiva (poliproteina) care este
activata prin scindare sub actiunea proteazelor celulei gazda.
In urma scindarii rezulta doua tipuri de segmente : H1 si
H2. Rolul HA este deosebit de important atat pentru atasarea virionului la
celula (la nivelul receptorilor celulari specifici), cat si pentru
eliberarea intracitoplasmatica a ARN viral.
Neuraminidaza
(prezenta doar la virusurile gripale A si B) mediaza
patrunderea virionului in stratul de mucus al cailor respiratorii.
- Capsida - simetrie helicoidala
- Genomul - ARN monocatenar cu polaritate negativa.
La acest nivel, exista componente suplimentare asociate genomului :
- nucleoproteina (NP) -
proteina interna asociata ARN, cu rol in protejarea acestuia.
- polimeraze : PB1, PB2, PA.
- proteine nestructurale NS1, NS2 si BM2 .
Variabilitate
antigenica
Virusurile ARN tind
sa posede o rata crescuta a mutatiilor (de aproximativ
10.000 de ori mai mare decat a virusurilor ADN), aspect ce se confirma
si in cazul virusurilor gripale.
Modificarile posibile
se clasifica in 2 categorii : minore si majore.
1. Modificari minore ('antigenic drift') -
mutatii punctiforme cu aparitia de mutante HA sau N. Aceste
mutatii, produse sub presiunea sistemului imun al gazdei, sunt cauzate de
multiplele pasaje ale v. gripal de la o gazda la alta in cursul
epidemiilor. Aceste mutatii sunt lent-progresive si cumulative.
2. Modificari majore ('antigenic shift') - sunt
rezultatul recombinarii genice intre diferite subtipuri virale. Aceste
modificari sunt constatate in cazul virusului gripal A.
Astfel, intr-o celula
infectata simultan cu 2 virusuri diferite, virionii progeni
(rezultati in urma replicarii) pot contine mixturi ale genelor
parentale. In acest fel, prin infectii duble cu virusuri de origine
umana si animala, la intervale de timp impredictibile, se
formeaza noi tulpini virale cu compozitie genetica diferita
de cea a tulpinilor aflate in circulatie. Aceste rearanjari genice
pot avea loc si intre tulpini de origine umana.
Daca aceste
modificari implica si genele ce codifica HA, N sau ambele,
noile tuplini vor beneficia de un avantaj, deoarece imunitatea colectiva a
populatiei receptoare va fi ineficienta. Aceasta deoarece imunitatea antigripala
este mediata de anticorpi fata de HA si N.
Replicare
Dupa
atasarea la receptorii specifici de pe membrana celulara, virionul
patrunde in celula prin endocitoza, fiind inclus in vacuole
(endozomi). La acest nivel, pH-ul acid induce modificari ale HA : o
anumuita secventa aminoacidica ('secventa de
fuziune') vine in contact cu peretele lipidic al vacuolei. Fuziunea cu
vacuola declanseaza decapsidarea virusului, dupa care ARN viral
este transportat in nucleul celulei gazda.
Replicarea
are loc conform etapelor caracteristice moleculelor de ARN monocatenar, cu
polaritate negativa.
Asamblarea
virionilor are loc la nivelul membranei celulare, eliberarea facandu-se
prin inmugurire, proces in care sunt implicate HA si N.
Patogeneza
Infectia
este transmisa pe cale respiratorie, interesand,
de obicei, tractul respirator superior. Virusul se
replica la nivelul epiteliului respirator, determinand distrugerea cililor
(element important in apararea locala). Urmeaza
apoi o etapa de viremie tranzitorie.
Infectia
virala a tractului respirator inferior (pneumonia gripala) se produce
uneori, manifestandu-se cu semne majore de toxemie si cu letalitate
ridicata.
Mai
frecvent, insa, pneumonia este rezultatul
suprainfectiei bacteriene secundare (S. aureus, H. influenzae, Streptococi
hemolitici).
Raspuns imun
Cel mai important tip de
anticorpi protectori specifici (neutralizanti) sunt cei anti-HA,
acestia impiedicand atasarea virionului la celula. Anticorpii
anti-N impiedica, probabil, eliberarea virionilor din celula.
Dupa producerea
infectiei, sistemul imun reactioneaza prin :
- anticorpi IgG serici
- limfocitele T citotoxice si macrofagele alveolare.
Diagnostic de laborator
A. Examen direct
- Microscopia electronica
- Imunofluorescenta - detectarea
antigenelor virale
B. Cultivare
Se
realizeaza pe culturi celulare primare de rinichi de maimuta.
Efectul citopatic nu este caracteristic, dar identificarea se poate realiza
prin hemaglutinare directa.
Si
in cazul inocularii oualor embrionate, diagnosticul se pune tot pe
baza proprietatilor hemaglutinante ale v. gripal.
Inocularea
la animale de experienta produce fie infectia
experimentala, fie, doar cresterea titrului de anticorpi specifici.
C. Serologia
Decelarea anticorpilor
specifici de tip (anti-NP) si de subtip (anti-HA) prin :
- hemaglutinoinhibare
- seroneutralizare
- fixarea complementului
- ELISA
Profilaxie
Profilaxia specifica activa se realizeaza prin administrarea
de vaccinuri inactivate sau vaccinuri vii atenuate.




