Noutati
privind aspectele clinice ale hipertensiunii intraabdominale (HIA) si
sindromului de compartiment abdominal (SCA)
Istoricul recunoasterii PIA si SCA
Drumul parcurs de la prima notificare despre
hipertensiunea intraabdominala (HIA) si potentialul ei de a genera sindrom
de compartiment abdominal (SCA) nu este scurt 14. Cateva semne sau simptome ce
fac referire la HIA sau SCA au fost descrise inca din anul 1800, dar abia in
ultimele decenii a crescut foarte mult interesul pentru acasta patologie
si s-au acumulat multe cunostintele clinice.
Dupa cum spus, HIA/SCA au progresat lent in drumul lor
spre recunoastere 20. Recent Schein a semnalat ca efectele
cresterii PIA au fost cunoscute inca din 1863 cand Marey a observat
efectele de ,,stimulare'' a respiratiei, in fapt cresterea frecventei,
prezenta in cresterile de volum ale abdomenului 21. In urma efectuarii unor experimente pe
animale Heinricius a demonstrat in 1890 ca cresterea PIA la 27
si 46 mmHg este fatala si
a intuit drept cauze deteriorarea respiratiei, scaderea distensiei
cardiace diastolice si hipotensiunea 21. Deasemenea, in 1911 Esmerson a
condus numeroase experimente pe caini ajungand la cateva concluzii privind consecintele cresterii PIA si
anume: deplasarea diafragmului reprezinta factorul principal in
cresterea volumului inspirator, cresterea PIA creste
rezistenta vasculara periferica, ca PIA excesiva poate
cauza moartea prin insuficienta cardiaca inaintea
dezvoltarii axfisiei demonstrand ca presiuni mai mari de 45 mmH2O omoara un animal mic 14. El a
utilizat in eperimentele sale distensia abdomenului cu gaz sau lichid si a
concluzionat ca pe langa compromiterea cardiaca se produce
si cresterea rezistentei in teritoriul splanhnic si a
observat ca indepartarea lichidului de SCAita duce la o
usurare a travaliului cardiac. Aceasta ultima observatie o
putem considera ca fiind un principiu terapeutic de baza vabil si in acest
moment in multe cazuri de SCA.
Primele
observatii privind afectarea renala din cresterile PIA au fost
observate de Wendt in 1876 si ceva mai tarziu, in 1947 Bradley a
aratat scaderea ratei filtrarii glomerulare si fluxului
plasmatic renal in cresterea PIA 21.
Inovatorii termenului
de ,,abdominal compartment syndrome" au fost Fietsam si colaboratorii.
Acestia l-au folosit pentru prima data in 1980 pentru a descrie
alterarile fiziopatologice observate in HIA secundare chirurgiei
anevrismului aortic 22. Ei au comunicat 4 cazuri cu anevrism de aorta
abdominala rupt ce au generat o crestere a PIA chiar in ciuda
repararii leziunii. Manifestarile clinice comune au fost:
cresterea presiunilor ventilatorii, cresterea PVC si
scaderea diurezei. Autorii au relevat urmatoarele aspecte:
-SCA este cauzat de
edemul interstitial si retroperitoneal
-4 pacienti au
primit mai mult de 25 l de lichid pentru resuscitarea volemica
-incizia
abdominala de decompresiune este asociata cu o
inbunatatire dramatica
Desi a fost
descrisa initial cu peste un secol in urma, HIA/SCA a fost
recent redescoperita in multe situatii ca un sindrom perimorbid in
contextul unei traume severe sau unei afectiuni severe abdominale 23, 24. Odata cu
refocalizarea atentiei asupra acestui fenomen, a devenit evident ca
SCA se intalneste nu numai la pacientii posttraumatizati critici,
ci se poate intalni intr-un larg spectru de afectiuni 25.
In decembrie 2004, clinicieni si
cercetatori din lumea intreaga s-au intalnit la Noosa, Australia
pentru a forma Word Society on Abdominal Compartment Syndrome (WSACS). Acest
congres inaugural a cuprins prezentarea a numeroase comunicari si
studii si au conturat pasii importanti pentru stabilirea
definitiilor de consens a HIA si SCA 28. Aceste definitii permit o clarificare substantiala a
criteriilor de diagnostic a HIA/SCA si vor ajuta la acuratetea
cercetarilor despre acest subiect. Redescoperirea HIA/SCA in anii '80
si primii ani '90 au dus la renasterea cercetarilor despre acest
subiect la mijlocul anilor '90. 15-17, 23,24. Aceasta literatura
descrie bine fiziopatologia HIA/SCA si optiunile pentru diagnosticul
clinic si management. In ciuda
multitudinii dovezilor ce arata impactul acestui sindrom, cele mai multe
cercetari sunt coordonate de chirurgi cu punerea accentului pe SCA in
trauma 29. In plus, aceasta literatura tinde sa fie
compusa din mici cercetari clinice prospective.
Odata cu cresterea recenta a
bazei de date medicale privind SCA, pot fi identificati pasi
importanti pentru stabilirea unui management terapeutic posibil si
conturarea unor consensuri privind tratamentul, asa cum s-a intamplat
si in cazul altor patologii intalnite frecvent in terapia intensiva.
Consider ca aceasta crestere de raportari reprezinta
si o consecinta a recunoasterii si identificarii
SCA. Pe masura ce cunostintele medicale privind acest sindrom
se inmultesc, initial se contureaza interventiile
profilactice si terapeutice urmand ca apoi studiile randomizate,
trialurile control sau alte cercetari sa inlature toate dubiile legate
de existenta acestei patologii si managementul terapeutic.
In ultimul deceniu,
numeroasele progrese din managementul clinic al pacientului critic s-au mutat
din sfera teoretica la protocoale standardizate de ingrijiri, acestea
incluzand printre altele profilaxia trombozei venoase profunde, profilaxia
ulcerului de stres, pozitia semisezanda pentru prevenirea
pneumoniei asociate cu ventilatorul si terapia precoce a sepsisului
1-4. O revedere istorica a
literaturii pentru fiecare din aceste protocoale a aratat ca
evolutia de la recunoasterea precoce a fenomenului fiziopatologic la
interventia profilactica si terapeutica standardizata
bazata pe probe de mare acuratete a urmat un sablon evolutiv.
Urmeaza apoi ca institutii
nationale, societati medicale si grupuri de spitale sa
evalueze si din punct de vedere economic prevenirea acestei afectiuni
specifice. Daca este realizabila din punct devedere financiar,
trebuiesc demarate campanii privind protocoale standardizate privind profilaxia
si terapia acestei afectiuni si instituirea unui nou standard de
ingrijire.
Un exemplu specifc poate fi vazut in
evolutia profilaxiei trombozei venoase profunde. Staza,
hipercoagulabilitatea si leziunea vasculara (triada Virchow) a fost
remarcata pe masura acumularii datelor clinice la pacientii
critici. Cunostintele au fost stranse pe masura ce studiile
cu caracter general au demonstrat riscul semnificativ pentru TVP si embolie pulmonara al
acestor pacienti 7,8. Dupa analiza riscului si beneficiului a
fost initiata terapia anticoagulanta profilactica 9. Ulterior, studii mari au demonstrat reducerea
semnificativa a morbiditatii si mortalitatii prin
protocolizarea terapiei profilactice anticoagulante 10, 11. Acestea au fost
asimilate de societati medicale si prin campanii de spital a
inceput profilaxia curenta TVP ca un standard pentru foarte multi
pacienti din TI 12.
Aceste aspectre de acceptare graduala
si implementare au fost vazute si in alte situatii cum ar
fi introducerea beta blocantelor si IECA in IMA si utilizarea
volumelor Tidal mici la pacientii cu SDRA. In ciuda stabilirii unor
standarde clare, complianta implementarii acestor date in
managementul terapeutic nu depaseste 60% 13. O pare din lumea medicala deplange
vietile care ar fi putut fi salvate daca daca noile standarde ar
fi fost implementate precoce si in intregime in timp ce ceilalti
indeamna la punerea in balanta a riscurilor si beneficiilor
acestor noi terapii medicale.
O cercetare mutidisciplinara cu privire
la recunoasterea si managementul HIA/SCA a fost efectuata de
Kimball si colaboratorii 25. Rezultatele acestei cercetari
demonstreaza o recunoastere si o intelegere moderata a
HIA/SCA in unele specialitati de Terapie Intensiva (chirurgie
si anestezie) si au relevat o ignoranta semnificativa
a diagnosticului si managementului HIA/SCA in alte specialitati
de Terapie Intensiva (medicina interna si pediatrie).
Concluzia acestei cercetari a fost ca exista o variatie
semnificativa a pregatirii personalului medical cu privire la
managementul HIA/SCA si un procent semnificativ de intensivisti nu
cunosc notiunile de management a SCA ce include monitorizarea presiunii
vezicale si laparotomia decompresiva.
Malbrain si colaboratorii au facut
tn 2004 un studiu privind prevalenta HIA/SCA si au aratat ca din 45 de pacienti
internati in Terapie Intensiva aproximativ 10 au prezentat risc de
HIA si 4 aveau conditii de dezvoltare a SCA. In plus, contrar
parerii generale anterioare, acest studiu a aratat ca SCA are o
prevalenta mult mai mare la pacientii din TI medicala decat
cei din TI chirurgicala 26.
Aceiasi autori au
concluzionat in urma altui studiu efectuat in 2005 privind incidenta
si prognosticul HIA ca aparitia HIA in timpul
stationarii in TI poate fi un factor de predictie pentru perioada de stationare in TI
In acelasi timp Kimball si
colaboratorii au facut un studiu ce
a cuprins medicii intensivisti si a aratat ca 78% din ei au
consimtit dupa studierea atenta a literaturii puse la
dispozitie privind HIA/SCA ca exista o corelatie intre HIA
si volumul mare de lichid de resuscitare in sepsis si MODS 25. In aceasta cercetare, 82% din medici au
estimat ca pana la 25% din pacientii lor au prezentat semne
clinice legate de cresterea PIA.
Recent au fost publicate rezultatele unor
cercetari privind cunostintele medicilor despre HIA si SCA
31. Acestea au aratat ca exista o lipsa generala de
cunostinte, desi nivelul acestora este mai bun decat acum 10
ani, si la fel de importanta este lipsa de aplicatie
clinica a cunostintelor disponibile ca si nemonitorizarea
PIA in TI. Deasemenea studiul a relevat ca daca PIA aceasta este masurata, calea
vezicala este folosita in exclusivitate. Nu exista consensuri
privind debutul masurarii, momentului efectuarii laparotomiei
decompresive, existand mari variatii intre chirurgi, intensivisti
si pediatri.
Intr-un efort viitor, o cercetare
internationala multidisciplinara privind HIA/SCA a fost aprobata
de European Society of Intensive Care Medicine (ESICM) si Society of
Critical Care Medicine (SCCM). Cercetarea poate fi accesata prin internet la www.wsacs.org/survey.htm.
pana in acest moment sunt aproximativ 1800 de medici interesati
sa participe la aceasta cercetare si scopul este de a aduna mai
mult de 2000. Datele preliminare despre acest studiu arata ca 13,6%
din respondenti nu sunt familiarizati cu HIA sau cu efectele
cresterii PIAasupra functiei organelor in timp ce 1,3% nu au auzit
niciodata de SCA. Un total de 62,9% de respondenti considera
combinarea examenului clinic cu PIA cea mai buna metoda de diagnostic
a HIA in timp ce 24,1 folosesc doar PIA pentru a pune diagnosticul. Alte metode
folosite sunt computer tomograful 13,1%, perimetrul abdominal 10,1%, si
ecografia abdominala 7,8%. Metoda masurarii transvezicale este
metoda cea mai folosita 92,3%, urmata de masurarea presiunii
intraperitoneale 4,2% si stomacale 2,8%. Cand este folosita vazica,
52,8% folosesc instilarea unui volum de 50 ml, in timp ce 21,9% instileaza 100
ml si 4,3% mai mult de 200 ml. Deasemenea 16,2% din corespondenti
folosesc pentru instilare volume mai mici de 25 ml. Pe de alta parte 6,8%
din corespondenti nu au asteptat echilibrarea pana la
masurarea PIA si 51,9% au cunostinte despre metoda
masurarii continue a PIA. Conceptul de presiune de perfuzie
abdominala este cunoscut de 81,5% si gradientul de filtrare de 19,7%.
In ceea ce priveste valorile normale 14,8% cred ca PIA normala
este de mai mare de 10 mmHg, in timp ce 77,1% definesc HIA ca o PIA mai mare de
15 mmHg si 58% definesc SCA ca o PIA mai mare de 25 mmHg. Rezultatele
acestui si a altor studii trebuie sa identifice golurile
educationale si tintele academice pentru urmatorii ani. Din
aceste rezultate reiese clar ca cunostintele si
perfectionarea definitiilor de consens vor fi o tinta
importanta in cercetarile HIA/SCA ca si implementarea acestor
cunostinte.
Tabelul 1
insumeaza datele acestui studiu.
Carcetarile privind diagnosticul
si managementul HIA si SCA au avut ca rezultat aparitia unor dispozitive
comerciale de masurare a PIA: Foley Manometer (www.holtech
medical.com), the AbViser® (www.wolfetory.com), the PIA-Monitor
(www.spiegelberg.de), and the CiMON (www.pulsion.com) 37. Prin aceasta
monitorizare, a fost posibila o recunoastere mai mare a a spectrului
larg al pacientilor cu risc 38. Aceste dispozitive permit
recunoasterea precoce a HIA a preveni progresia spre SCA cu mortalitatea
si morbiditatea ei semnificativa - figura 3. (25).
Odata decelata precoce cresterea
PIA, prin masuri terapeutice specifice fiecarei etiologii de HIA se
poate opri progresia spre SCA. Spre exemplu managementul atent al lichidelor
si folosirea coloizilor, folosirea temporara a agentilor
blocanti neuromusculari, paracenteza pentru eliminarea lichidului
intraabdominal, decompresiunea gastrica si rectala cu tubul
nazogastric si clisme sunt masurile terapeuice cu eficienta cea mai
mare 32-34, 36, 39. De asemenea s-a dovedit faptul ca hemodializa
veno-venoasa continua (CWHD) poate deasemenea sa atenueze
cresterea PIA si sa previna progresia spre SCA 35. In plus,
in fata unei HIA sau SCA documentata prin masurarea PIA, chirurgii
sunt mai hotarati sa recurga la laparotomia
decompresiva in fata SCA cand aceasta nu raspunde la terapiile
medicale susmentionate 25.
Recunoasterea
actuala a HIA si SCA.
HIA/SCA sunt recunoscute de un numar
relativ mic de clinicieni care au vazut acest sindrom in forma lui cea mai
severa, cunostintele extinzandu-se treptat spre restul comunitatii
medicilor din TI 25, 31, 40-44. Un alt mare progres privind cunostitele
despre SCA consta in identificarea spectrului larg de pacienti gravi
la care poate surveni. Urmatorul mare pas dupa recunoasterea
larga a acestui sindrom este incadrarea managementului HIA/SCA la un
standard de ingrijiri in mare masura acceptat.
Etape
similare au fost parcurse si in cazul stabilirii profilaxiei si tratamentului TVP, TEP
si spsisului. Fata de profilaxia TVP si TEP, standardul de
ingrijire al HIA/SCA difera prin faptul ca managementul HIA/SCA va fi
multidimensional. In aceasta privinta HIA/SCA se poate compara
cu complexitatea diagnosticarii si tratamentului precoce al unei
septicemii. Intradevar, aceste doua sindroame se si suprapun astfel
ca un ghid de tratament al sepsisului din 2005 recomanda un
management atent al lichidelor pentru a preveni HIA 45. Acest ghid
recomanda pentru supravietuirea in sepsis, in ordine:
vigilenta in diagnostic, monitorizarea atenta in timpul
resuscitarii lichidiene, antibiotice, vasopresoare, steroizi, activarea
proteinei C si glucoza sub control atent impreuna cu alte
ingrijiri generale 11, 12. si pentru clinicienii si cercetatorii
interesati de HIA/SCA, acesta este cadrul cel mai simplu pe care trebuie sa-l
urmeze. In general noi intelegem care sunt riscurile, cum le
monitorizam, si efectuam numeroase interventii profilactice
si terapeutice pentru HIA/SCA.
Similar cu terapia precoce in sepsis,
putine din aceste interventii sunt bazate pe probe. Totusi cel
putin cateva probe exista pentru multe din aceste terapii, ce pot
constitui fundamentul terapiei HIA/SCA. Urgenta pentru progres este
reala. Date importante despre HIA/SCA demonstreaza ca de la un
punct, HIA/SCA si sepsisul merg mana in mana 26. Deasemenea este
nerealist sa sugeram ca HIA/SCA poate avea un impact asupra unui
numar mai mare de pacienti din ICU decat sepsisul 26. Pentru aceia
implicati in continuare in cercetarea HIA/SCA, drumul de urmat este clar.
Folosind evidentele disponibile, trebuie sa dezvoltam
tratamentul HIA/SCA si sa il aplicam in trialuri prospective
multicentru 47 .
SCA este cel mai
comun sindrom observat la pacientii critici in momentul in care se face
resuscitarea lichidiana din starile severe de soc si
inflamatie sistemica 18, 19. O
consecinta a repletiei volemice o constituie sechestrarea
interstitiala de lichid ce duce la edem visceral in compartimentul
abdominal si toracic.
Desi au fost observate acum aproape 150
de ani, implicatiile fiziopatologice ale presiunii intra-abdominale
crescute au fost de fapt redescoperite doar in deceniul trecut. PIA crescuta
sau 'Hipertensiunea intra-abdominala' (HIA) este acum in mod
obisnuit identificata la pacientii critici, si
recunoscuta drept cauza a unei morbiditati si
mortalitati semnificative. HIA a fost recunoscuta ca un sir
de modificari fiziopatologice incepand cu perturbarea fluxului sanguin
regional si in final culminand cu insuficienta organica
indusa de PIA, denumita 'Sindrom de compartiment abdominal'
(ACS).
Raportari cu privire la sindromul de compartiment
abdominal au aparut citate in literatura in cadrul traumatologiei
si chirurgiei generale, in care s-a aratat ca, daca
evolutia nu a fost exploziva de la inceput, macar a acompaniat
si evoluat progresiv cu un mare potential de amenintare a
vietii (5).
Figura 1 arata PIA/HIA/SCA in timp.
Figura 2 -
cercetari importante privind HIA si SCA ce descriu in detaliu
fiziopatologia si prevalenta acestui sindrom. Cresterea
cunostintelor si cercetarile importante privind HIA/SCA au
dus la formarea grupurilor de studiu HIA/SCA.
Figure 1: The intra-abdominal pressure, intra-abdominal hypertension
and abdominal compartment syndrome timeline, listing the landmark events.
Figura 2.
Numarul publicatiilor ce au continut termenii,, abdominal compartment syndrome" ca criteriu
de cautare pe PubMed (U.S. National Library of Medicine) or ScienceDirect
(Elsevier B. V.) in ordinea publicarii din 1982 la 2006 (limitate la
subiectii umani).
Sindromul de compartiment abdominal este mai
nou apreciat datorita consecintelor potential fatale ale
cresterii presiunii intraabdominale.
HIA poate debuta prin cresterea
subtila a PIA, care daca ar fi recunoscuta precoce si
tratata ar putea impiedica evolutia spre SCA. Medicii intensivisti
au inceput de curand sa recunoSCAa ca multe afectiuni au un
risc potential pentru aparitia acestui fenomen care daca nu este
recunoscut poate ameninta viata 25, 26. Cunostintele
actuale nu se refera doar la conceptul teoretic izolat de HIA, ci a
capatat si noi conotatii: fenomenul HIA real clinic, HIA
consecutiva fenomenului de ischemie/reperfuzie. De-a lungul conturarii acestor concepte
au existant constant schimbari ale definitiilor si a valorilor
critice. Daca luam in considerare spectrul larg de
specialitati in care se pot intalni HIA si SCA, ar fi ideal un
consens larg de la toate disciplinele de terapie intensiva. 27. Principalele indicatii de monitorizare
ale PIA sunt:
Sepsis/SIRS/Ischemie-reperfuzie
-sepsis si
resuscitare cu mai mult de 6 L cristaloide/coloide sau mai mult de 4 U sange in
8 ore
-pancreatita
-peritonita
-ileus sau
obstructie intestinala
-necroza sau
ischemie mezenterica
Compresiune
viscerala/reduction
-SCAita in volum
mare/ dializa peritoneala
-sangerarea peretelui
abdominal sau retroperitoneala
-tumora
abdominala mare
-laparotomie
inchisa in tensiune
-gastroschisis/omfaloce
Chirurgie
-balanta
lichidiana intraoperatorie > 6 ore
-repararea
anevrismului aortic abdominal
Trauma
-soc ce
necesita resuscitare (ischemie-reperfuzie)
-laparotomie
exploratorie
-politrauma cu
sau fara trauma abdominala necesitand pentru resuscitare
mai mult de 6 l cristaloide sau > 4 unitati sange sange in 8 ore
-arsuri majore
(>25% TBSA)
In viitor este
timpul sa se efectueze trialuri clinice multi-centru pentru a aduce
managementul HIA/SCA la un standard international de ingrijiri.
Definitie
Avand in vedere prevalenta HIA in TI,
dificultatea diagnosticului si morbiditatea si mortalitatea asociate,
trebuie subliniata importanta masurarii PIA, identificarii
prezentei insuficientei de perfuzie si a restabilirii perfuziei
sistemice si regionale la nivel de organ la pacientii cu HIA sau SCA.
Decelarea HIA doar prin examenul fizic este dicila, astfel ca o PIA crescuta
poate usor sa ramana nedescoperita si poate duce
la un grad de disfunctie si insuficienta organica.
Astfel ca masurarea PIA, cel mai adesea prin masurarea presiunii
intravezicale, a fost identificata ca esentiala pentru
diagnosticul si tratamentul corect al pacientilor cu HIA sau SCA.
Desi
primele studii au sugerat ca o PIA de 30 pana la 40 mm Hg ar fi
acceptabila, acum se recunoaste ca si cresteri mici
ale PIA la 10-15 mmHg pot sa aiba un impact enorm asupra perfuziei
organelor si asupra prognosticului pacientului.
Prin
urmare, definitia HIA a necesitat o ajustare continua de-a lungul
anilor, iar valoarea 'PIA critice' care necesita
interventia terapeutica a fost micsorata. De asemenea au fost extinse categoriile de pacienti cu risc pentru
HIA si SCA. Considerate initial ca apar doar la pacientii
cu traumatisme, acum se stie ca HIA si SCA apar practic la toate
categoriile de pacienti. Totodata s-a constatat ca PIA crescuta
a fost asociata cu rapiditatea instalarii si prezenta
comorbiditatilor cu un impact semnificativ asupra prezentarii
clinice si managementului. Deasemenea, varsta, obezitatea, sarcina,
mecanismul injuriei, difunctia sau insuficienta pulmonara,
cardiaca sau renala, necesitatea ventilatiei mecanice si
aparitia SIRS, au fost recunoscute ca factori ce influenteaza
evolutia si tratamentul acestor bolnavi critici.
La inceputul procesului de intelegere a
HIA si SCA s-a incercat gasirea unei singure valori prag a PIA care
sa poata fi folosita simplu si universal pentru luarea
deciziilor la pacientii critici cu HIA. 'PIA critica' ce
necesita interventia terapeutica poate fi considerata
'graalul' cercetarii HIA si SCA. 'PIA
critica' ce produce disfunctie de organ difera de la
pacient la pacient in functie si de fiziologia si
comorbiditatile preexistente ale fiecaruia.
Totusi,
o astfel de abordare simplifica prea mult un proces fiziologic care de
fapt este foarte complex si variabil. Desi PIA este un factor
determinant major al prognosticului pacientului critic, PIA care defineste
HIA si ACS in mod evident difera de la pacient la pacient si
chiar in cazul aceluiasi pacient, in functie de evolutia bolii.
In
intervalele acceptabile clinic, PIA este un predictor specific, dar insensibil
al severitatii bolii si al caracterului adecvat al
resuscitarii. Cresterea sensibilitatii diagnostice a PIA ar
necesita ca pacientii sa fie lasati sa aiba
valori ale PIA mai mari. Dar se stie ca astfel de valori ale HIA
produc tulburari de perfuzie organica, si o astfel de
practica ar fi inacceptabila clinic, avand in vedere nivelul actual
de intelegere a morbiditatii si mortalitatii HIA.
Astfel, cu toate ca este o metoda utila de screening, PIA nu are
o sensibilitate suficienta pentru a fi folosita ca enpoint al
resuscitarii. Tinand cont de variabilitatea marcata a valorilor PIA
la pacientii critici, este putin probabil ca se putea folosi
vreodata o singura valoare-prag la toti pacientii critici.
O abordare alternativa pentru
imbunatatirea sensibilitatii PIA este incorporarea ei
in modul de evaluare a perfuziei abdominale ca endpoint al resuscitarii.
Asemanator cu notiunea unanim acceptata de presiune de
perfuzie cerebrala (PPC), calculata ca presiunea arteriala medie
(PAM) minus presiunea intracraniala (PIC), presiunea de perfuzie
abdominala (PPA), calculata ca PAM minus PIA, a fost propusa drept
un marker mai precis al bolii critice si endpoint al resuscitarii.
PPA = PAM - PIA
Prin urmare, o singura valoare-prag a
PIA nu poate fi folosita pentru luarea deciziilor clinice la toti
pacientii critici. PPA este superioara si fata de PIA
si fata de end-point-urile generale de resuscitare ca pH-ul,
deficitul de baze si lactatul din sangele arterial, in ce priveste
capacitatea sa de a stabili prognosticul si de a fi un parametru util
pentru ghidarea resuscitarii si managementului pacientului cu HIA sau
ACS.
Acesta teza evalueaza printre
altele suportul stiitific si potentialul folosirii clinice
a PPA in managementul pacientilor cu HIA si ACS.
Ce presiune
defineste hipertensiunea?
In orice compartiment al corpului omenesc, o
crestere a presiunilor peste limitele fiziologice este daunatoare. La
presiuni care inca permit curgerea axiala a sangelui prin vase,
perfuzia capilara poate inceta sa existe rezultand moartea
celulara. Sechelele fiziopatologice si aparitia semnelor si
simptomelor sunt dependente de un numar de factori si anume:
presiunea de perfuzie, rata si marimea cresterii presiunii
intracompartimentale, complianta compartimentului si motivul
schimbarii presiunii in compartiment. Spre exemplu, o crestere rapid
exponentiala a presiunii intracraniene in craniul rigid la un pacient
hipotensiv este rapid fatala daca interventia urgenta este
intarziata, in timp ce o hidrocefalie cronica la un copil la un copil
poate avea efecte minore sau deloc asupra functiei cerebrale.
Aceleasi principii se aplica
si la abdomen. In timpul laparoscopiei cu relaxare musculara PIA
poate creste acut la 20 mmHg sau mai mult fara nici o
interferenta cu functionarea organelor. Simon si co au
conceput un model porcin si au aratat ca daca PIA a crescut
la 20 mmHg dupa o perioada de soc hemoragic si repletie
volemica a fost urmata de o scadere marcata a functiei
pulmonare. In schimb animalele de control cu cresteri similare ale PIA dar
fara hemoragie anterioara au avut modificari minime ale
raportului PaO2/FiO2. La om, SCA ca
rezultat al acumularii rapide de lichid intraabdominal a fost
constatata dupa resuscitarea cristaloida masiva in
absenta unei injurii intraabdominale, putand fi tolerate pana la 15 l
lichide de resuscitare.
Din cele de mai sus se pot delimita cateva
concluzii ce pot favoriza dezvoltarea patologica a PIA. Modificarea
trebuie sa fie acuta si trebuie sa fie o agresiune anterioara care nu este necesar sa
fie neaparat intraabdominala. In scopul de a minimiza efectele nocive
ale presiunilor crescute din orice compartiment este imperativ sa fie bine
cunoscuta conditia inainte ca sindromul de compartiment sa fie
instituit. Conform filozofiei lui Dickens: ,,prevenirea este mai buna
decat tratarea", pentru ca cea de-a doua se poate dovedi imposibila.
Ca la cele mai multe sindromuri exista
o faza prodromala inainte ca semnele si simptomele evidente
sa se manifeste. Pentru abdomen aceasta este reprezentata de perioada
HIA. In trecut acest fenomen a fost folosit alternativ si a fost sinonim cu SCA. O
diferenta a trebuit sa fie facuta intre HIA si
SCA si ele trebuie sa fie vazute ca faze diferite ale
dezvoltarii procesului patologic, poate comparabile cu diferentele
intre gradele sindromului de raspuns inflamator sistemic (SIRS).
Termenul HIA este rezervat pentru faza
cresterii PIA inaintea
aparitiei semnelor certe. Este important sa realizam ca in
faza prodromala hipoperfuzia splahnica poate sa apara mult
inainte ca manifestarile clasice sa devina evidente. Simptomele prodromale
sunt adesea usoare si pot fi asociate cu o varietate de alte
conditii. Aceasta este in special adevarat la pacientii critici
care indiferent de motive necesita tratament de ingrijiri intensive
dupa laparotomie. Usoare cresteri ale presiunii, hipotensiunea,
o crestere a PVC sau POAP, o scadere a diurezei sunt toate
caracteristici ale cresterii PIA dar la fel de bine ar putea fi asociate
insuficientei cardiace, dupa un sepsis abdominal sever sau dupa
un traumatism major.
Aceasta ridica un numar important
de intrebari cu privire la definirea HIA si SCA. Care este PIA
normala? Care este tensiunea de granita intre normotensiune
si hipertensiune? Cat de comuna este HIA? In ce moment HIA se
transforma in SCA? Gasindu-de raspunsurile la aceste intrebari,
HIA si SCA pot fi definite si punctul in care fiziologicul se
transforma in patologic poate fi identificat.
Ce
presiune defineste hipertensiunea?
In principiu, intr-un sindrom de
compartiment, cresterea presiunii de orice grad necesita
interventie pentru a preveni disfunctia progresiva de organ si cu
cat hipertensiunea este mai severa, cu atat mai urgenta este
necesitatea interventiei. Daca acest principiu este aplicat la
abdomen, identificarea presiunii la care disfunctia de organ devine
aparenta poate fi folosita pentru a defini HIA.
Astfel a aparut necesitatea
evidentierii obiective a cresterii PIA inaintea aparitiei
anomaliilor de perfuzie si a disfunctiilor de organ sau ca acestea sa
devina vizibile clinic. Experimental s-a constatat prin monitorizarea
parametrilor hemodinamici usuali, ca o PIA de pana la 10 mmHg nu are
efect semnificativ asupra ejectiei cardiace, presiunii sanguine, PVC
si POAP. Totusi, cu privire la POAP, aceasta trebuie vazuta in
lumina cresterii presiunii
pleurale. Adevarata POAP transmurala este egala cu POAP end-
expiratorie minus presiunea
pleurala si aceasta scade la o PIA de 10 mmHg. Cand PIA se apropie de
15 mmHg se produce o crestere semnificativa a presiunii pleurale, CO
scade cu 20% ca si intoarcerea venoasa. Paradoxal PVC si POAP pot
fi crescute ca rezultat al cresterii presiunii intratoracice. La o PIA de
20 mmHg CO scade semnificativ la 70% din valoarea de baza.
Parametrii hemodinamici singuri,
totusi, nu reflecta extinderea problemei. Intr-o serie de experimente
animale, Diebes si col au masurat efectul cresterii PIA asupra
fluxului sanguin intestinal si hepatic. In timpul cresterii PIA, nivelul de baza al PAM a fost
tinut constant de incarcarea volumului intravascular. Rezultatele
combinate a doua studii sunt prezentate in Figura 1.
Cea mai notabila descoperire a acestor
studii a fost ca desi o cadere semnificativa a CO a fost
observata doar la PIA de 40 mmHg, scaderi semnificative ale
alimentarii cu sange ale ficatului si intestinului au fost observate
la presiuni de 10 si respectiv 20 mmHg. In plus, pH-ul mucoasei gastrice a
scazut semnificativ la 7,16 la PIA de 20 mmHg si 6,89 la 40 mmHg. Aceste
nivele reprezinta o oxigenare suplimentara cu respectiv 50 respectiv 2% din normal.
Din aceste date este clar ca inainte ca
semnele clinice datorate cresterii PIA sa devina aparente,
organele intraabdominale devin ischemice. Trebuie subliniat ca animalele
din experimentele de mai sus nu au suferit o afectiune sau trauma
anterioara, cresterea PIA fiind singura interventie.
Alte studii au evidetiat la pacintii
cu HIA, un pH gastric anormal gasit in stransa corelatie cu PIA
peste 15 mmHg asociat cu alte disfunctii de organe sau evacuare gastric intarziata.
In decursul timpului valorile PIA
gasite, indiferent de etiologia HIA, au fost cuprinse intr-un interval cu
limita inferioara de -16 mmHg presiune subatmosferica si cea
superioara de 80 mmHg si o medie in jur de 6,5 mmHg. Chirurgia
abdominala produce de regula o crestere a PIA, dar rar
depaseste 15 mmHg la cazurile necomplicate. Chirurgia de
urgenta are un efect mai marcat asupra PIA dar aceasta tine de
alte conditii patologice decat de actul chirurgical in sine.
Ventilatia cu presiune pozitiva va creste evident PIA in comparatie
cu respiratia spontana.
Majoritatea studiilor publicate despre PIA
autorii au selectat arbritrar o varietate de limite intre PIA normala
si cea care defineste HIA. Acestea se intind intr-un interval intre
12 si 25 mmHg. Totusi, un studiu a folosit curbele ROC (receiver
operating characteristic) pentru a defini valoarea PIA la care se produc
efectele locale sau sistemice. Cu privire la complicatiile postoperatorii
intalnite in chirurgia electiva sau de urgenta a anevrismului
aortic, curbele ROC au aratat ca un nivel de 15 mmHg poate fi folosit
ca limita de jos pentru a defini HIA. In studiu au fost inclusi
pacienti fara alte afectiuni semnificative si s-a
concluzionat ca valori mai crescute decat aceasta cresc foarte mult
morbiditatea prin HIA. Acest nivel nu reprezinta o valoare absoluta intrucat
la o minoritate de pacienti o valoare de 12 mm Hg poate determina HIA, in special in
prezenta hipotensiunii care poate accentua in plus hipoperfuzia organelor.
Deasemenea, s-a sugerat ca presiunea de
perfuzie abdominala definita ca presiunea arteriala medie minus
presiunea intraabdominala poate fi un indicator mai realist. Valori mai
mici de 50 mmHg indica un mare risc de efecte detrimentale datorate PIA.
Care este PIA normala?
PIA este foarte variabila la indivizii
normali si depinde de indexul de masa corporala si de
pozitie. In cel mai strict sens, doar valorile PIA mergand de la valori
negative la 0 mmHg pot fi considerate normale. Totusi anumite
caracteristici fiziopatologice cum ar fi obezitatea morbida pot fi asociate
cu cresterea cronica a PIA cu care pacientul s-a adaptat si
semnificatia clinica a valorilor crescute usor sau moderat
trebuie sa fie avute in vedere in evaluarea statusului initial al
pacientului. Spre exemplu, este bine demonstrat ca diametrul abdominal
crescut la pacientii cu obezitate morbida este asociat cu PIA
crescuta in absenta altei fiziopatologii semnificative. Chiar interventii terapeutice minore
sau modificari ale pozitiei corpului in special la pacientii
bolnavi critic ar putea influenta valoarea PIA si ar cauza scurte
cresteri ale valorii PIA masurate. Dupa aceea, PIA poate reveni
la normal sau la nivelele de baza. Din acest considerent se impune ca inaintea
diagnosticarii unei PIA anormale sau HIA care ar putea necesita o
interventie terapeutica, trebuie demonstrata ca este o
crestere sustinuta a PIA
ce reflecta un fenomen patologic nou sau o entitate in cavitatea
abdominala. Ca regula PIA trebuie intotdeauna sa fie
masurata la sfarsitul expirului in pozitie de decubit
dorsal.
Deasemenea si in alte circumstante
clinice se poate intalni simptome concordante cu cele din HIA sau SCA,
insotite de o PIA normala sau crescuta, fara ca
aceasta crestere sa aiba o semnificatie clinica
sau fiziopatologica. Cele mai exemplificative sunt sarcina, obezitatea,
dializa peritoneeala, pneumoperitoneul, decubitul si aplicarea PEEP.
Astfel, in trimestrul II si III de
sarcina, uterul ocupa marea majoritate a cavitatii
abdominale si determina o scadere a amplitudinii respiratorii
si scaderea TA (sd hipotensiunii de decubit). Aceste simptome se
datoreaza restrictiei miscarilor diafragmatice si
compresiunii asupra venei cave inferioare. Cu toate acestea, in cele mai multe
cazuri, PIA nu este crescuta. In plus, simptomele se amelioreaza in
decubit lateral sau ortostatism. Datorita influentei hormonale din
timpul sarcinii, peretele abdominal este usor destins, are
complianta crescuta, factori care reduc potentialul de
crestere al PIA cauzata de expansiunea uterului. In aceasta
situatie, daca PIA creste din cauza altor conditii, ex
pneumoperitoneu in timpul laparoscopiei, perfuzia uterina si a
fatului poate fi sever compromisa.
Obezitatea reprezinta o alta
conditie comuna asociata cu cresterea PIA. la acesti
pacienti se pot intalni frecvent presiuni vezicale in jur de 30 mmHg. In acest
context, mai multe simptome ale obezitatii cum ar fi
disfunctiile renale si respiratorii au fost atribuite sindromului de
compartiment abdominal cronic. In masurarea PIA la pacientii obezi este recomandata pozitia de decubit
dorsal, in aceasta pozitie valoarea PIA obtinuta
reprezinta suma presiunii fiziologice existenta intraabdominal la
care se adauga presiunea exercitata de peretele abdominal care este mult
mai crescuta decat la pacientii normoponderali. In
consecinta, valoarea mare a PIA obtinuta la persoanele
obeze nu reprezinta si nu trebuie interpretata ca PIA
crescuta la un pacient normoponderal.
La obezi se recomanda masurarea PIA in
decubit dorsal din anumite considerente. Astfel, in pozitie culcata,
greutatea peretelui abdominal va comprima preferential portiunea
dorsala a abdomenului incluzand rinichii si vasele mari, avand ca
efect afectarea perfuziei organelor splahnice. In pozitia verticala, greutatea
viscerelor abdominale pot induce un gradient de presiune cranio-caudal, cu presiune
neutra sau chiar negativa, comparativ cu pacientii cu greutate
normala, in abdomenul superior
si presiune mult mai crescuta in abdomenul inferior.
La aceste constatari au ajuns intr-un
studiu Hackney si colaboratorii care au gasit la pacientii cu
obezitate severa care nu au disfunctie respiratorie (deci nu au
retentie de CO2) o valoare a PIA
normala, masurata cu balonul gastric in pozitie
sezanda. Insa nu se poate spune ca aceasta valoare
este si cea mai fidela din cauza considerentelor de mai sus. O
alta constatare a acestor autori a fost ca la pacientii obezi,
PIA poate creste semnicativ si se poate insoti chiar si de
disfunctie ventilatorie doar prin inclinarea partii superioare a
corpului pacientului, aflat in pozitie sezanda, prin comprimarea
abdomenului.
In concluzie PIA poate sa creasca
in obezitate in absenta unui proces fiziopatologic implicat clasic in
etiologia SCA, ea fiind datorata doar partial restrictiei
expansiunii peretelui abdominal (ca in SCA clasic) la aceasta adaugandu-se
cresterea continutului abdominal eventual dependeta de
pozitia corpului.
Se mai poate adauga la concluzii
ca la pacientii cu morbiditate severa, daca PIA este in
plus ridicata, exemplu in conditiile unui pneumoperitoneu aplicat in
timpul unei chirurgiei laparoscopice, se pot intruni mult mai usor
conditiile de producere a unui SCA
cu compromiterea severa a functiei circulatorii, respiratorii, renale
si hepatice.
O alta situatie particulara o
constituie dializa peritoneala. In timpul efectuarii dializei
peritoneale acute (DPA), cand se introduce in cavitatea peritoneala o
cantitate semnificativa de fluid dializat, deobicei 1-2 l la un adult,
acesta poate produce o crestere marcata a PIA. Acest fenomen este
bine studiat intrucat cresterea PIA prin introducerea unei
cantitati de lichid in cavitatea peritoneala este folosita
in experimentele pe modelele animale 11).
La om, in timpul DPA poate fi observata
scaderea ejectiei cardiace si cresterea presiunii in artera
pulmonara 12,13). Dializa peritoneala nu este efectuata uzual la
pacientii din terapie intensiva, dar este inca folosita in
circumstantele in care alte forme de terapie substitutionala
renala acuta nu sunt disponibile.
Intr-un studiu din Vietnam in care dializa peritoneala a fost comparata
cu hemofiltrarea veno-venoasa in insuficienta renala acuta
produsa de infectii, rata mortalitatii a fost semnificativ
mai crescuta la grupul cu dializa peritoneala. Ea poate fi
datorata eficientei mai reduse a dializei peritoneale, dar o
alta cauza incriminata a fost disfunctiile de organ
datorate cresterii intermitente a PIA.
Situatia se schimba in dializa
peritoneala cronica (DPC) unde s-a constatat ca efectele nocive
circulatorii sunt mai putin nocive. Astfel, in mai multe studii efectuate la pacientii cu DPC s-a
observat ca in urma cresterii PIA, presiunea sanguina si
indexul cardiac au scazut semnificativ.12 13.
Ultimele constatari au fost ca
lichidul de dializat peritoneal acumulat in cavitatea peritoneala la
pacientii cu dializa peritoneala cronica poate produce in
regiunea dorsala a abdomenului o presiune mare comprimand vena cava
inferioara si scazand intoarcerea venoasa.
In doua studii cu copii hipervolemici
dupa chirurgie cardiaca, dializa peritoneala nu a cauzat vreo
schimbare a ejectiei cardiace sau presiunii sanguine sistemice 16 17. De
fapt, dializa peritoneala este bine tolerata la copii si este
inca o procedura comuna la copii mici si copii care
dezvolta insuficienta renala dupa chirurgie
cardiaca.
O alta situatie clinica
particulara o reprezinta pneumoperitoneul din timpul chirurgiei
laparoscopice fiind una din cauzele iatrogene de crestere a PIA. In mod
normal, CO2 este insuflat in peritoneu cu o presiune de 15 mmHg. In realitate
aceasta reprezinta doar partial presiunea din cavitatea
peritoneala. Presiunea reala poate fi semnificativ crescuta
datorita presiunii suprapuse produsa de greutatea organelor
splahnice.19-25.
Pneumoperitoneul poate da simptome
asemanatoare cu SCA cu compromiterea circulatiei si respiratiei
ca si reducerea perfuziei renale si organelor splanhnice. De regula,
dupa procedura, enzimele hepatice sunt crescute datorita afectarii circulatiei
hepatice 20-21. In timpul procedurii, diureza de obicei scade si la copii
mici poate produce anurie tranzitorie 22-24.
In concluzie, daca se intrunesc mai
multe conditii si anume: pacienti cu obezitate morbida
expusi la pneumoperitoneu prelungit se pot dezvolta conditiile unui
SCA. In plus, pozitia Trendelemburg si insuflarea de CO2 au efecte
circulatorii bine cunoscute 25. Cu toate acestea, daca pneumoperitoneul
este administrat pe perioada scurta consecinte sustinute
sunt rar vazute, alterarea circulatiei si respiratiei fiind
de regula reversibile 19-24.
O situatie mai particulara in care
PIA este crescuta o reprezinta pozitia de decubit ventral
folosita pentru a imbunatati oxigenarea in afectiunile
pulmonare acute si pentru a reduce riscul afectiunilor pulmonare
induse de ventilator 26. Teoretic, pozitia de decubit ventral creste
PIA daca abdomenul este comprimat de salteaua suport si nu sunt luate
masuri de ameliorare ale acestei comprimari.
Pelosi si colaboratorii au
constatat pe 16 pacienti cu afectiuni pulmonare acute ca PIA a
crescut doar in medie cu 3 mmHg in pozitia de decubit ventral. Acesteia
au folosit perne sub torace si sub pelvis pentru a minimaliza
restrictia abdomenului.
Rezultate similare au fost relatate de
Herning si colaboratorii care au examinat efectul pozitiei de decubit
ventral, dar fara a utiliza vreo masura de minimalizare a
restrictiei abdominale asupra PIA si a functiei cardiovasculare,
splanhnice si renale la pacienti cu insuficienta
respiratorie acuta 28 29. Ei au aratat o crestere medie cu 3-7
mmHg a PIA, fluxul sanguin sistemic a
crescut si functia renala si a organelor splanhnice nu a
fost deteriorata 28 29.
Astfel se pare ca cresterea PIA in
pozitia de decubit ventral este minora si in afara oricaror
efecte negative majore. Cu toate acestea, se poate intui gravitatea efectelor
pacientilor odata cu cresterea severa a PIA, in special la
pacientii cu obezitate morbida. In aceste conditii, o
minima comprimare suplimentara a abdomenului probabil poate produce o
crestere semnificativa a PIA, in special daca nu au fost luate
masurile de reducere a restrictiei abdominale.
PEEP-ul (presiunea pozitiva la
sfarsitul expiratiei) este un parametru respirator folosit uzual
pentru contracararea compromiterii respiratiei cauzata de
cresterea PIA. Desi in conditii normale PEEP-ul nu
afecteaza PIA, acesta poate creste PIA, in situatia in care
complianta peretelui abdominal este scazuta, prin miscarea
diafragmului la sfarsitul expiratiei in jos, comprimand astfel organele
intraabdominale cu reducerea perfuziei organelor splahnice 30 31.
Efectele ,,adverse' majore ale PEEP-ului
nu constau in cresterea PIA, dar prin cresterea presiunii
intratoracice, produce scaderea intoarcerii venoase, care
adaugata la modificarile perfuziei splahnice existente la un
pacient cu PIA crescuta duce la hipoperfuzia organelor abdominale 31.
In
concluzie putem spune ca putine conditii comune (obezitatea)
si proceduri (laparoscopie, dializa peritoneala) sunt asociate cu
cresterea PIA si pot produce simptome similare cu cele ale
pacientilor cu HIA sau SCA dar cu semnificatie mai putin severa
si reversibila.
Definitia hipertensiunii
intraabdominale -HIA
HIA este
definita ca oricare din cele doua conditii urmatoare:
-la PIA ≥12 mm Hg masurata in
conditii standard de minim 3 ori la un interval de 4-6 ore
-la PPA ≤ 60 mmHg masurata de
minim doua ori in conditii standard la interval de 1-6 ore
Hipertensiunea
intraabdominala este gradata dupa cum urmeaza:
|
Gradul
|
PIA
|
|
I
|
12-15 mmHg
|
|
II
|
16-20 mmHg
|
|
III
|
21-25 mmHg
|
|
IV
|
≥25 mmHg
|
In
functie de durata simptomatologiei, HIA poate fi clasificata in 4
grupe:
a. HIA
cronica
b. HIA
acuta
c. HIA
subacuta
d. HIA
hiperacuta (22)
Definitia SCA:
SCA se
defineste prin prezenta urmatoarelor doua situatii:
-La PIA ≥ 20 mmHg cu sau fara
PPA < 50 mmHg inregistrata cu minim 3 masuratori
standardizate si
-insuficienta singulara sau
multipla de organ
In contrast cu HIA, SCA nu trebuie sa fie
gradata deoarece acest fenomen poate sa existe sau nu.
SCA primar se refera la:
-o conditie asociata cu traumatisme sau boli din regiunea abdominala si
pelvina, care frecvent necesita interventie chirurgicala
precoce sau interventie angioradiologica;
-o conditie care se dezvolta in urma unei interventii
chirurgicale abdominale (ca traumele organelor abdominale ce necesita
tratament chirurgical, peritonite secundare, sangerari datorate unor
fracturi pelvine ori alte cauze de hematom retroperitoneal masiv, transplantul
de ficat).
Acesti pacienti sunt supusi initial unui trial de
management nechirurgical pentru decelarea leziunilor organelor solide care
ulterior pot dezvolta SCA primara.
Forme sinonime: SCA abdominala,
chirurgicala sau acuta.
SCA
secundar se refera la: arsurile mari ori alte conditii ce
necesita resuscitare volemica masiva), care genereaza semne
si simptome comune similare cu cele din SCA primara.
Forme sinonime: SCA extraabdominala, medicala sau subacuta.
SCA tertiara sau recurenta
se refera la:
-o conditie care se dezvolta in urma
unui tratament profilactic sau terapeutic medical sau chirurgical a unui SCA
primara sau secundara (ex. persistenta SCA dupa
decomprimarea prin laparotomie sau dezvoltarea unui nou episod de SCA
consecutiv inchiderii definitive a peretelui abdominal, dupa utilizarea
anterioara a inchiderii temporare a peretelui).
Forme sinonime: cronic, deschis.
Diferentierea
intre forma localizata sau sistemica de HIA/SCA se face masurand
presiunea intraabdominala cu balonul gastric. O cauza locala
este prezenta cand diferenta este mai mare de 10 mmHg.
Din
ce moment HIA se transforma in SCA?
Nu toti pacientii cu HIA vor
necesita decompresiune abdominala si pe de alta parte
laparotomiile inutile cu inchidere cu plasa implica o morbiditate
considerabila prin cresterea PIA. Invers, neefectuarea decompresiunii
abdominale in prezenta SCA este de regula fatala, in timp ce
interventia la timp este asociata cu imbunatatirea
marcata a functiei organelor si o rata totala de
supravietuire de 59% . In ultima afirmatie sta distintia
teoretica intre HIA si SCA, si anume, ca HIA in asociere cu
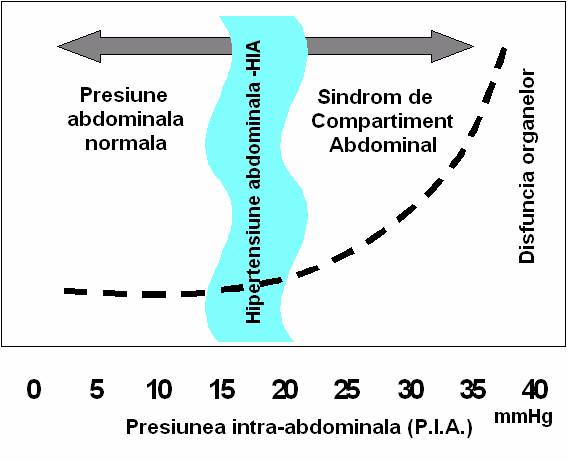
disfunctia de organe reprezinta SCA. (fig 2). Insa acel punct
patologic din care HIA se asociaza cu modificari modeste in
disfunctia organelor este greu de identificat. Aria intunecata
ilustreaza ca HIA poate suferi schimbari la stanga sau la
dreapta in functie de scenariul clinic. Daca in ceea ce priveste
pacientii critici situati la extreme prognosticul este evident, la
cei in stare medie prognosticul de supravietuire sau deces este dificil. In
principiu pacientii cu PIA sub 15 mmHg si disfunctii de organ
explicabile de patologia lor anterioara este improbabil sa
beneficieze de decompresiune abdominala, insa aceia cu
disfunctie de organ si PIA peste 20 mmHg ar trebui supusi
chirurgiei decompresive. Dar ce se intampla cu cei intre 15-20 mmHg cu
cresteri usoare a presiunii aeriene ce genereaza o afectare
usoara pulmonara acuta, o crestere moderata a PVC
si o functie renala la limita? Acesta defineste grupul
cu HIA cu potential SCA. O cantarire intre risc si beneficii
este necesara. In balanta, din eviedentele disponibile
acumulate, asemenea pacienti ar trebui decomprimati si
diagnosticul confirmat sau infirmat retrospectiv. In aceasta ingusta
,,no man's land'' a HIA intre PIA normal si SCA eforturile noastre trebuie
sa fie concentrate intr-o incercare de a clarifica definitiile
si astfel optiunile de tratament. Bazarea pe parametrii hemodinamici
standard este prea cruda insa masurarea perfuziei splahnice este prea
dificila in scenariul clinic pentru a fi aplicata current.
Reglementari
O sursa de confuzie in literatura
privind PIA patologica deriva din folosirea a doua unitati
diferite de masurare a presiunii: mmHg si cm H2O. Echivalenta
intre cele doua unitati de masura este:
1 mmHg = 1,36 cmH2O si invers
1 cmH2O este egal cu 0,74 mmHg.
In aceasta lucrare toate valorile de
presiune sunt exprimate in mmHG cu valoarea corespondenta in cm H2O
prezentata in paranteza cand este cazul.
Exista variatii si
fluctuatii inerente ale PIA. Cand comparam valorile
masuratorilor continui cu masuratorile luate la interval scurte,
se ridica problema relevantei de a folosi o valoare maximala a
PIA pentru a ne ghida strategiile terapeutice in locul folosirii mediei sau
medianei unui set de masuratori. In lipsa unui consens si din
cauza ca majoritatea institutiilor folosesc valorile PIA
maximale din masuratorile presiunii vezicale individuale, toate
valorile presionale ulterioare referitoare la acestea corespund valorilor PIA
maximale din masuratorile vezicale discontinue standardizate, daca nu
sunt stipulate altfel.
Cavitatea abdominala
este inconjurata partial de structuri rigide cum ar fi pelvisul, coloana vertebrala si
arcurile costale si partial de tesuturi flexibile - peretele
abdominal si diafragmul. Theoretic, valorile PIA urmeaza legile
hidrostaticii unde gradul de flexibilitate al peretelui abdominal si
gravitatia specifica a continutului sau ar determina
presiunea intr-un punct dat intr-o pozitie data (pronatie,
supinatie). Totusi, miscarile diafragmului si a cutiei
toracice, relaxarea si contractiile musculaturii peretelui abdominal,
obezitatea si variatiile de continut ale intestinelor (aer,
lichid, masa fecala) adauga grade de variatie
fiziologica care limiteaza utilitatea unei descrieri stricte
matematice a PIA. In plus, tehnicile folosite pentru a masura PIA, ce vor
fi prezentate intr-un capitol urmator, adauga un grad ulterior de
incertitudine si de aceea, orice valori numerice prezentate
subsecvential servesc doar ca aproximari si trebuie luate ca atare.
Etiopatogenia sindromului de compartiment abdominal.
Sindromul de compartiment abdominal este o
entitate cu potential fatal, de care, toti clinicienii si
chirurgii in particular, trebuie sa fie bine informati.
Cresterea prelungita a PIA poate duce la compromiterea
pulmonara, insuficienta renala, deprimare cardiaca,
soc si deces (1).
Sindromul de compartiment abdominal se
refera la alterari ale mecanicii respiratorii, a parametrilor
hemodinamici si functiei renale, acestea fiind rezultatul
cresterii PIA.
De regula pacientii cu SCA sunt
critici si dependenti de ventilator in terapia intensiva. Cu
toate ca se face frecvent analogia cu sindromul de compartiment periferic,
aceasta analogie nu este in
totalitate valida din cauza ca SCA este insotit de profunde efecte sistemice ce nu se
regasesc in sindromul de compartiment al extremitatilor (24).
SCA poate fi
intalnit fie ca o consecinta a traumei chirurgicale, fie fie ca o
consecinta a numeroase conditii medicale.
Diagnosticul depinde de recunoasterea
tabloului clinic la pacientii cu risc urmate de o masurare
obiectiva a presiunii intra-abdominala (5).
Succesul tratamentului poate necesita
decompresiune abdominala cu inchiderea abdominala temporara. In
ciuda decompresiunii urgente, rata mortalitatii ramane
crescuta din cauza severitatii afectiunii.
Un studiu epidemiologic multicentric recent
a descoperit ca HIA (definita ca PIA≥12 mmHg) a fost
prezenta la 51% din pacientii medicali si chirurgicali de la
terapie intensiva (ICU), iar ACS (definita ca PIA≥20 mmHg cu
una sau mai multe insuficiente de organ) a fost gasit la 8%.
Prevalenta PIA crescute la pacientii care ajung la
insuficienta organica sugereaza ca HIA poate foarte
bine sa joace un rol major in dezvoltarea insuficientei organice
multiple (MSOF), o cauza majora a mortalitatii in ICU.
Cat de comuna este HIA?
Raspunsul la intrebarea ,,cat de
comuna este HIA?" este ingreunat de faptul ca studiile care au
incercat sa cuantifice incidenta HIA si SCA au folosit criterii
diferite pentru a defini HIA. Astfel
rezultatele acestor studii au fost diferite in fuctie de baza de
selectie a clinicii de TI respective si de valoarea de la care PIA
este considerata patologica si defineste HIA sau SCA. Mai
jos sunt trecute in revista cele mai ample si semnificative studii efectuate.
Sugrue si col 28 intr-un studiu de 100
pacienti admisi intr-o singura unitate de TI dupa laparotomie, folosindu-se un nivel
de 20 mmHg pentru a defini HIA. Din 88 de pacienti eligibili pentru
analiza finala 29 (33%) au avut presiunea crescuta. Daca ar fi
folosita ca limita o presiune mai mica, ex 15 mmHg, 38
(43%) de pacienti au avut o PIA
excesiva. Din 57 pacienti supusi interventiei chirurgicale
23 (40%) au avut presiuni mai mari de 20 mmHg, in timp ce din 31 de
pacienti supusi interventiei chirurgicale elective doar 6 (19%) au indeplinit acest criteriu.
Desi fara o semnificatie statistic aceasta trebuie
considerata ca o descoperire clinic semnificativa. Dintr-o serie de
70 pacienti care au suferit afectiuni abdominale care
ameninta viata, 23 (33%) au fost considerati ca avand HIA
folosind un nivel de 25 mmHg ca definitie.12. Acest studiu poate fi
criticat totusi pentru cuprinderea unui grup specific de pacienti cu
risc inalt al acestei complicatii si nu prezinta obligatoriu
adevarata incidenta. Asa cum au sugerat autorii, nivelul
critic al HIA care necesita tratament nu a fost stabilit.
Intr-un studiu prospectiv pe 405
pacienti care au fost admisi
in terapie intensiva (31) incidenta totala a a HIA a fost 17,5%
folosindu-se ca limita 12 mmHg. Din pacientii admisi dupa
chirurgia de urgenta 39% au indeplinit criteriile de HIA in
comparatie cu doar 6% din cei supusi chirurgiei elective.
Incidenta la pacientii medicali a fost de 20%. Surprinzator, in
ciuda folosirii a trei nivele diferite de PIA pentru a defini HIA,
incidenta este foarte asemanatoare in special la pacientii
care au suferit interventii chirurgicale de urgenta.
Factori
etiologici de HIA:
De mai mult de un secol chirurgii au
recunoscut ca cresterea presiunii intraabdominale poate produce serioase
consecinte fiziopatologice. Cu toate acestea, doar recent au fost clar
definiti factorii cauzali comuni si constelatia de dezordini
fiziopatologice produse de cresterea presiunii abdominale. (26)
Recent, nivelul cunostintelor
despre SCA au crescut din doua motive: in primul rand, folosirea
laparoscopului pentru chirurgia generala a adus cu ea aprecierea si
cuantificarea PIA ca un parametru al acestei tehnici. (21)
In al doilea rand, folosirea frecventa
a laparotomiei planificate in traumatologia abdominala a dus, atat pentru
chirurg cat si pentru anestezist, la aprecierea efectelor benefice ale
decompresiunii abdominale la evacuarea hematoamelor sau schimbarea packingului.
(11)
Sindromul poate fi consecinta a variate
injurii, incluzand si laparotomia pentru traumatisme abdominale severe,
ruptura de anevrism aortic abdominal si infectiile
intraabdominale. (16)
Deasemenea inchiderea inciziei abdominale
dupa dupa o procedura intraabdominala indelungata,
in special in interventiile ce necesita
o expunere prelungita a intestinelor sau volume mari de lichide pentru
repletia intravenoasa, presiunea intraabdominala poate
creste rapid. Daca presiunea intraabdominala creste peste
25 mmHg, poate produce complicatii potential fatale. (12)
Mai mult, riscul cresterii presiunii
intrabdominale la valori critice nu este limitat doar la pacientii
postoperator. Sunt si alte conditii ce duc la escaladarea presiunii
intraabdominale:
Packing-ul perihepatic sau cu alta
localizare intraabdominala, cand se plaseaza deliberat postoperator o
anumita perioada pentru a mentine o tamponada, poate
deasemenea sa fie o cauza patogenica de crestere a
presiunii intraabdominale. (17)
Aceaste conditii fiziopatologice recent
etichetate ca sindrom de compartiment abdominal au un impact profund asupra
multor organe si sisteme.
O situatie particulara o
constituie SCA secundar sau simpatic. Experientele recente sugereaza ca
edemul visceral progresiv se poate dezvolta, ducand la SCA, si in
absenta unei injurii directe asupra abdomenului. (16)
Trauma distala sau infectia poate stimula edemul intestinal
prin inducerea reactiva a unui ,,sindrom de capilar deschis". Spre
exemplu, un pacient ce are simptome de SCA dupa amputatia unei
extremitati inferioare strivite. Toate aceste simptome raspund
prompt la decompresiunea chirurgicala a abdomenului. (16)
Chirurgia
abdominala:
-laparoscopica
-reducerea
herniei, eventratiei, inchidere stramta
-pansament
circular cu centura Velcro pentru a preveni cura chirurgicala a herniei. (12)
2.
Resuscitarea hidrica masiva definita ca administrarea de mai
mult de 5 litri de substante coloide ori cristaloide in 24 de ore;
3.
Ileusul indiferent daca este paralitic, mecanic sau pseudo-obstructiv
definit ca distensia abdominala sau absenta zgomotelor peristaltice
sau absenta tranzitului intestinal; evidentiata prin dilatarea
gastrica sau gastropareza masiva cu un rezidiu gastric mai mare
de 1000 ml intr-o perioada de 24 ore. (16)
4.
Infectii abdominale (peritonita, abces, . )
5.
Pneumoperitoneu
6. Hemoperitoneu
datorat unei sangerari intra- retroperitoneale
7.Ruperea
unui anevrism aortic intraabdominal
8.Pancreatita
acuta hemoragica
9.Traumatismul
abdominal
10.Fracturi
ale pelvisului
11.Tumorile
ovariene masive
12.Cancerul
de colon
13.Sarcina
si travaliu
14.Coagulopatie
hipotermica
15Socul
septic
Indicatiile de monitorizare a PIA:
- Postoperator in chirurgia abdominala
- Pacienti cu traumatisme abdominale inchise
sau deschise
- Pacienti ventilati mecanic cu diferite
disfunctii de organe ce sunt evaluate zilnic prin scorul
Sequential Organ Failure Assessment (SOFA)
- Pacienti cu abdomen destins, cu semne si simptome sugestive pentr SCA:
-oligurie
-hipoxie
-hipotensiune
-acidoza inexplicabila
-ischemie mezenterica
-PIC crescuta
5. Pacienti
cu packing abdominal dupa inchiderea temporara abdominala
dupa multiple traume sau transplant hepatic
6. Pacienti
care nu au suferit o interventie chirurgicala, dar care au primit
volume mari de fluide pentru resuscitare in contextul unor afectiuni
insotite de tulburari de flux capilar (pancreatita, soc
septic, trauma) (22)
Fiziopatologia
SCA.
Presiunea din interiorul
compartimentului abdominal poate creste consecutiv traumei, ca rezultat al
acumularii sangelui, fluidelor sau edemului. Ischemia intestinala
nontraumatica, hemoragia sau infarctul intestinal, pot deasemenea sa
duca la cresterea presiunii in compartimentul abdominal, pe
masura ce celulele ischemice se edematiaza sau se
acumuleaza lichidele.
Alte cauze potentiale
sunt coagulopatile din sangerarile abdominale, ciroza sau hipotermia
profunda.
Odata ce presiunea din
compartimentul abdominal invinge presiunea din capilarele ce perfuzeaza
organele abdominale, se poate produce ischemia sau infarctizarea acestor
organe.
Monitorizarea presiunii din
compartimentul abdominal este menita sa deceleze precoce
cresterea presiunii inainte de a se produce ischemierea sau infarctizarea
organelor.
Evaluarea si
managementul pacientilor critici necesita aprecierea
modificarilorfiziopatologice, aspectelor clinice si a
explorarilor paraclinice. Din cauza ca hipertensiunea
intra-abdominala cauzeaza alterari fiziopatologice severe,
clinicianul trebuie sa recunoSCAa si sa obiectiveze PIA cat
mai precoce si sa evalueze intreg scenariu clinic.
Influenta unei PIA
crescute asupra hemodinamicii locale si sistemice si asupra mecanicii
respiratorii este importanta. Un studiu a aratat ca 38% din
pacientii admisi in TI dupa o interventie chirurgicala
majora au PIA mai mare de 20 mmHg.
Anamneza si examenul
clinic la pacientii cu SCA poate fi mult ingreunata deoarece
pacientii care dezvolta SCA pot fi incapabili sa comunice din
cauza ca pot fi intubati sau pot fi foarte critici.
Cu toate acestea PIA trebuie
monitorizata obligatoriu in urmatoarele circumstante:
-traumatismele abdominale
-hemoragia
-peritonitele
-chirurgia aortica de urgenta
-inchiderea abdominala fortata
-cresterea circumferintei abdominale
-istoric de pancreatita
-dificultate in respiratie
-scaderea debitului urinar
-sincopa
-greata si voma
SCA este de regula sugerat
de o crestere a circumferintei abdominale. Daca aceasta modificare este acuta,
abdomenul este in tensiune si dureros.
Desi aceasta poate fi
recunoscuta cu dificultate la pacientii cu obezitate morbita, acesti pacienti
au abdomenul in afara proportiei lor constitutionale. Acesta poate fi usor
evidentiat in ortostatism si decubit drept.
Cresterea PIA are largi
efecte sistemice ca si efecte locale. Mai multe studii clinice si
experimentale au demonstrat ca cele mai multe efecte ale SCA sunt datorate
factorilor mecanici generati de PIA si influentei acesteia asupra
compartimentelor intra-abdominal, retroperitoneal si toracic. (29)
Probabil ca si
raspunsul neurohormonal juaca un rol in patogenia SCA, totusi
informatiile sunt limitate pentru a sustine acest concept.
Omfalocelul reprezina prototipul clasic pentru intelegerea SCA. In tratamentul gastroschizisului si
omfalocelului neonatal, chirurgia pediatrica intalneste o
situatie similara cu SCA. Incercarea de repunere imediata a
intestinului poate produce compromiterea severa a functiei pulmonare si
a fluxului vascular intraabdominal, similar cu SCA. Pentru a evita aceste
complicatii, chirurgii au inventat ,,silastic chimneys" care
realizeaza o protectie a viscerului herniat. Hernia este atunci
usor si progresiv redusa in timp ce presiunea
intraabdominala este mentinuta sub 20 mmHg. (14)
Presiunea de perfuzie dintr-un compartiment
anatomic depinde de trei factori:
1. Presiunea influxului arterial
2. Presiunea efluxului venos
3. Complianta sau abilitatea
compartimentului de a se dilata ca raspuns la cresterea volumului.
Probabil ca cea mai acceptata exemplificare a presiunii de
perfuzie este in cazul traumatismului cranian. Deoarece creierul este inchis
intr-o 'cutie' osoasa si in general nu poate poate sa
se expandeze dincolo de limitele craniului, complianta craniana este
nesemnificativa si PPC (presiunea de perfuzie cerebrala) se
calculeaza ca influx arterial (PAM) minus eflux venos (PIC). PAM este
determinata de volumul intravascular, contractilitatea cardiaca
si rezistenta vasculara sistemica, iar PIC depinde de
volumul creierului, al lichidului cefalorahidian, al sangelui intracranian
si al oricarui proces inlocuitor de spatiu, cum ar fi un hematom
sau o tumora. Dupa Doctrina Monro-Kellie, o crestere a volumului
uneia sau mai multora din aceste patru componente ale craniului va duce la o
crestere a PIC. Optimizarea PPC se face fie prin cresterea PAM (prin
folosirea adecvata a rescitarii lichidiene si a
vasopresoarelor), sau prin scaderea PIC (prin administrarea de diuretice,
drenajul LCR, sau evacuarea proceselor inlocuitoare de spatiu). Este
interesant faptul ca studii recente au readus in discutie conceptul de
hemicraniectomie (indepartarea unei portiuni mari din calota
craniana) pentru a mari complianta craniana, asa cum
decompresiunea abdominala creste complianta cavitatii
abdominale. Perfuzia abdominala poate fi considerata
asemanatoare cu a creierului (Tabelul 1).
Tabelul
. Compartimentele cranian si abdominal
|
Abdomen
|
Craniu
|
|
Organ(e)
|
Ficat,
splina, rinichi, stomac, intestine
|
Creier
|
|
Fluid(e)
|
Ascita,
aer, fecale
|
Lichid
cefalorahidian
|
|
Delimitare
|
Peretii
abdominali
|
Cutia
craniana
|
|
Leziuni
|
Sange,
edem, ascita, aer, tumori
|
Tumori,
hematoame
|
|
Presiune
|
PIA
|
PIC
|
|
Perfuzie
|
PPA
= PAM - PIA
|
PPC
= PAM - PIC
|
PIC: presiunea intracraniana; PIA:
presiunea intraabdominala; PPC: presiunea de perfuzie cerebrala; PAM:
presiunea arteriala medie; PPA: presiunea de perfuzie abdominala
Abdomenul contine mai multe
organe solide (ficatul, rinichii, splina, etc) si fluide (sange,
urina, continut intestinal) cu complianta limitata,
dar si organe cavitare care contin aer (stomacul, intestinul
subtire, colonul) cu distensibilitate marcata si spatii
potentiale (peritoneul, retroperitoneul) care pot sa se mareasca
semnificativ ca raspuns la o leziune sau boala. Abdomenul poate
sa contina si procese patologice inlocuitoare de
spatiu cum ar fi sange, aer, ascita sau o tumora. La fel ca in
creier si conform cu doctrina Monro-Kellie, o
crestere a volumului continutului cavitatii abdominale va
duce la o crestere a PIA. Desi nu este inchis intr-un invelis
rigid cum este creierul, abdomenul nu este nici pe departe perfect compliant
si expansibil. Unele parti din abdomen, cum ar fi coloana
vertebrala, pelvisul si arcurile costale sunt rigide, in timp ce
altele, ca diafragmul si in special peretele abdominal sunt compliante
numai pana la un punct determinat de diversi factori.
Astfel complianta
peretelui abdominal este influentata semnificativ de varsta,
obezitate, musculatura peretelui abdominal, sarcina si chirurgia
abdominala. Deasemenea, durerea si edemul spatiului 3 de
asemenea reduc complianta si maresc efectele negative ale PIA
crescute. Toti acesti factori pot sa aiba un impact
semnificativ asupra capacitatii pacientului de a tolera HIA, ca
si asupra adecvabilitatii perfuziei abdominale.
In mod normal, valoarea
presiunii intraabdominale este 0 sau subatmosferica. In conditii
patologice ca cele enumerate mai sus, cresterea presiunii este
compensata pana la atingerea unei valori critice, dupa care
apare afectarea bunei functionari a mai multor organe si sisteme.
Limita superioara pentru
care organismul detine mecanisme adaptative compensatorii care sa
contracareze cresterea presiunii abdominale este in jur de 20 mmHg dar are
si unele variatii individuale.
Depasirea acestei
valori are ca efect disfunctia organelor intraabdominale precum si a
celor extraperitoneale, fiind afectate in grad mai mare functia
respiratorie, cardiovasculara si digestiva si intr-o mai
mica masura presiunea
intracraniana.
In ceea ce priveste afectarea
sistemului respirator, se descrie un model de insuficienta respiratorie
restrictiva cu scaderea capacitatii respiratorii funtionale,
a compliantei si a volumelor pulmonare, avand consecinta
cresterea suntului pulmonar, hipercarbiei, hipoxemiei, scaderea
raportului PaO2/FiO2.
La fel de importante sunt si
efectele cresterii presiunii intraabdominale si intratoracice asupra
sistemului cardiovascular datorate in principal compresiunii exercitate asupra
vaselor mari. Astfel se produce scaderea intoarcerii venoase, cresterea
presiunii in artera pulmonara si a presiunii venoase centrale, scaderea
debitului cardiac, cresterea rezistentei vasculare periferice si
favorizarea conditiilor de aparitie a trombozei venoase sau a
emboliei pulmonare. La acesti bolnavi TAM ramane in limite normale
datorita cresterii rezistentei vasculare sistemice, dar poate scadea
la pacientii cu rezerva cardiaca limitata sau in situatia
unui volum intravascular scazut.
Functia gastrointestinala
este si ea afectata de cresterea PIA, cu consecinte locale si
mai ales sistemice. Astfel cresterea PIA duce la scaderea fluxului
sanguin hepatic, scade fluxul venos portal si creste fluxul prin
anastomozele portocave. Aceste modificari ale circulatiei nutritive si
functionale a ficatului au impact asupra metabolismelor in care este
implicat ficatul.
Tubul digestiv este afectat
prin scaderea fluxului sanguin regional ce duce la hipoxie tisulara
si edem al peretelui intestinal. Prin ischemia mucoasei intestinale,
aceasta isi pierde functia de bariera, apare translocatia
bacteriana in vasele portale si limfatice cu aparitia sepsisului
si MSOF.
Rinichiul este si el un
organ puternic afectat de cresterea PIA. Astfel la cresterea PIA de
aproximativ 20 mmHg apare oliguria, iar peste 25-30 mmHg apare anuria. Acestea
sunt consecinta scaderii fluxului sanguin renal si a ratei filtrarii
glomerulare care duc, totodata, la activarea sistemului renina-angiotensina-aldosteron
cu cresterea nivelurilor de renina, aldosteron, peptid natriuretic si catecolamine. Prin compresiunea directa
a rinichiului se poate produce cresterea presiunii in corticala renala
si necroza tubulara acuta.
Dupa cum am vazut, PIA
crescuta produce o deteriorare semnificativa a functiei
cardiace, pulmonare, renale, gastrointestinale si hepatice, fiecare organ
avand o vulnerabilitate particulara. Astfel, PIA care poate tulbura
perfuzia unui organ poate avea un efect mult mai mic asupra altuia. Acest
raspuns diferentiat, impreuna cu susceptibilitatea crescuta
la PIA observata la pacintii cu hipovolemie si comorbiditati
asociate, complica managementul pacientilor critici si impune
folosirea PIA ca endpoint al resuscitarii. Deasemenea presiunea de
perfuzie abdominala este un alt parametru important ce poate fi folosit
pentru stabilirea endpointului resuscitarii.
Cosnsecinte clinice si
paraclinice locale si sistemice ale SCA:
Cele mai comune
manifestari intalnite in SCA sunt complicatiile locale, renale
si cardio-pulmonare.
Modificari clinice si
paraclinice ale sistmului respirator:
Cresterea PIA
cauzeaza direct efecte mecanice asupra plamanului, ce constau in
reducerea volumului toracic si cresterea presiunii
intratoracice.
Obeid si col au
masurat complianta dinamica la 26 pacienti la care s-a
facut laparoscopie diagnostica. Acestia au observat
scaderea compliantei dinamice pulmonare la o PIA de 16 mmHg sau mai
mare. Complianta pulmonara dinamica scade cand acesti
pacienti au fost plasati in pozitie Trendelemburg.
Concluzia a fost ca
Ascensionarea diafragmului in cavitatea toracica cauzeaza o
restrictie a expansionarii plamanului responsabila de
modificari respiratorii similare cu cele din HIA.
In plus, ei au concluzionat
ca marimea continutului abdominal poate exacerba aceasta
problema cu atat mai mult cu cat pacientul este pozitionat in
pozitie Trendelemburg.
Ascensionarea pasiva a diafragmului
permite transmiterea PIA in cavitatea pleurala reducand bilateral
complianta pulmonara statica si dinamica. Cresterile
presiunii intratoracice, prin ridicarea diafragmului, duc la compresiunea
extrinseca asupra parenchimului pulmonar cu aparitia atelectaziei
alveolare, scaderea difuziunii oxigenului si a dioxidului de carbon
prin membrana alveolo-capilara si cresterea fractiei de
sunt intrapulmonar si a spatiului mort alveolar. Aceste
disfunctionalitati sunt accentuate de prezenta
hipovolemiei.
Reducerea compliantei are
drept consecinta o presiune inspiratorie foarte crescuta pentru
a mentine o ventilatie eficienta. Cresterea varfului
presional este evident la o PIA peste 15 mmHg.
Analiza gazelor sanguine
arteriale a aratat o crestere a PaCO2, consecinta a
scaderii compliantei pulmonare si a ventilatiei
ineficiente. PaO2 poate fi deasemenea redusa ca urmare a atelectaziilor
bazale si scaderii ejectiei cardiace. In aceste conditii se poate dezvolta hipercarbia si
acidoza respiratorie potential fatala. Uneori cresterea
PCO2 si a presiunii inspiratorii de varf pot fi primele semne ce
arata ca presiunea abdominala a crescut la nivele patologice.
Compromiterea
functiei pulmonare de regula precede afectarea renala care este mai tardiva si
anunta un prognostic mai grav.
Radiografia pulmonara
simpla la pacientii cu SCA arata ascensionarea hemidiafragmului
precum si reducerea ariilor pulmonare.
Putem concluziona ca modificarile
respiratorii ale SCA contureaza un tablou de insuficienta
respiratorie restrictiva cu scaderea capacitatii
respiratorii functionale, a compliantei si a volumelor
pulmonare, avand consecinta cresterea suntului pulmonar,
hipercarbiei, hipoxemiei, scaderea raportului PaO2/FiO2 si
acidoza respiratorie.
Frecvent, in SCA, pentru
mentinerea unei ventilatii si oxigenari adecvate este
necesara folosirea unui suport ventilator, de la administrarea de oxigen
pe canula nazala pana la suport ventilator complet. Insa
utilizarea ventilatiei mecanice cu PEEP duce in cele din urma la o
exacerbare a consecintelor cardiace si respiratorii produse de HIA.
Numeroase studii au aratat ca exista oricum o presiune
pozitiva la sfarsitul expirului in cavitatea pleurala la
presiuni intraabdominale de 15 mmHg sau mai mult.
Deasemenea, cercetarile
au aratat ca modalitatea cea mai eficienta de reducere a
consecintelor respiratorii ca si a celor cardiace induse de SCA este
decompresiunea chirurgicala a abdomenului. Chiar si presiuni aeriene de varf mai mari de
80 cmH2O au fost ameliorate pana spre valorile normale, imediat dupa
decompresiunea chirurgicala a abdomenului.
Anomaliile sistemului
respirator observate la examenul clinic sunt:
-wheezing,
-raluri,
-cresterea frecventei respiratorii
-cianoza
-aspect palid
Modificari clinice si
paraclinice ale sistmului cardio-vascular:
Efectele cresterii PIA
asupra sistemului hemodinamic sunt complexe. Acestea sunt datorate in principal
compresiunii exercitate asupra vaselor mari si cordului. Astfel, se
produce scaderea intoarcerii venoase, cresterea presiunii in artera
pulmonara si a presiunii venoase centrale, scaderea debitului
cardiac, cresterea rezistentei vasculare periferice si
favorizarea conditiilor de aparitie a trombozei venoase sau a
emboliei pulmonare.
La acesti bolnavi, T.A.M.
ramane in limite normale datorita cresterii rezistentei vasculare
sistemice, dar poate scadea la pacientii cu rezerva
cardiaca limitata sau in situatia unui volum intravascular
scazut. (9).
Mai multe din aceste
disfunctii par sa raspunda partial la resuscitarea
volemica, dar aceste fluide pot duce, deasemenea, la cresterea
edemului si pot exacerba HIA. In cele din urma, singura solutie
pentru a intrerupe acest cerc vicios este decompresiunea prin laparotomie.
S-a demonstrat ca debutul acestor
modificari apare la o PIA de numai 10 mmHg. In plus, o crestere a PIA
de la 10 la 30 mmHg reduce mai mult ejectia cardiaca prin reducerea
debitului bataie. Debitul bataie scade din cauza scaderii
presarcinii si cresterii postsarcinii.
Presarcina este redusa ca rezultat al sechestrarii lichidelor
in teritoriul splahnic, patul vascular al extremitatii inferioare
si vena cava inferioara. In plus, cresterea PIA reduce
complianta ventriculului stang si astfel scade umplerea
ventriculara. (28)
In ciuda reducerii
presarcinii, masurarea presiunii venoase centrale si a presiunii
capilare pulmonare poate arata o crestere artificiala a
presiunii ce este datorata de fapt unei presiuni intratoracice crescute.
In acelasi timp o PIA
mare creste postsarcina prin cresterea rezistentei vasculare
sistemice, realizata prin compresia mecanica a patului vascular.
Aceasta crestere a rezistentei vasculare sistemice
reprezinta si o compensatie pentru mentinerea in limite relativ normale a
presiunii sanguine in conditiile reducerii ejectiei cardiace.
Cordul, el insusi afectat prin
comprimare directa este supus unui travaliu crescut, trebuind sa
pompeze sange impotriva unei presiuni aortice crescute, datorata
cresterii rezistentei vasculare periferice.
Compromiterea progresiva a debitului
cardiac duce la colaps cardio-vascular si soc, acestea fiind
evenimentele terminale.
Astfel, tabloul clinic este
conturat de o ejectie cardiaca scazuta si
rezistenta vasculara crescuta in contextul unei presiuni
capilare pulmonare si presiuni venoase centrale crescute.
Pacientii
hipovolemici, cei cu contractilitate cardiaca scazuta si
cei care necesita ventilatie mecanica cu presiune pozitiva
par sa sufere reduceri ale debitului cardiac la valori mai mici ale PIA
decat pacientii normovolemici.
Staza
venoasa
Compresiunea venei cave inferioare poate duce la staza in
interiorul venelor extremitatii inferioare favorizand aparitia
tromboflebitei si emboliei pulmonare. Studiile doppler au aratat
incetinirea fluxului venos in venele extremitatii inferioare in special
in sindromul de compartiment abdominal
postoperator. Edemul sever al extremitatii inferioare se remite in
primele 24 de ore dupa decompresiunea SCA.
Consecintele clinice
cele mai importante sunt:
-scaderea debitului
cardiac,
-hipotensiunea si scaderea debitului cardiac ca rezultat al
scaderii intoarcerii venoase,
-sincopa sau starea de slabiciune poate fi un semn al hipovolemiei.
-alterarea circulatiei la
nivelul extremitatilor distale secundar scaderii presiunii
aortice,
-necesar masiv de lichide intravenoase,
-POCP si PVC crescuta
-ischemie intestinala si sangerare gastrointestinala
datorata ischemiei intestinale,
-insuficienta cardiaca, stop cardiac
Cullen et al au descris modificarile
cardiorespiratorii la sase pacienti cu HIA cunoscuta. El a
masurat PIA cu 15 minute inainte de decompresiunea chirurgicala.
Inainte de decompresiune,
toti pacientii au avut acidoza metabolica, tahicardie,
tendinta la colaps, cresterea marcata a PVC, a presiunii in
artera pulmonara si a POPC.
Dupa modificarea
volumului abdomenului, PVC, debitul cardiac si volemia au crescut
usor, in timp ce frecventa cardiaca a scazut.
Presiunile monitorizate
traditional ce reflecta statusul volemic, cum ar fi PVC sau POCP sunt
eronat crescute si ele nu reflecta statusul volemic al
pacientilor. Mai utile sunt masuratorile volumetrice cum ar fi:
indexul volumului end-diastolic al ventriculului drept (right ventricular
end-diastolic volume index -RVEDVI) si/sau indexul volumului end-distolic
global (global end-diastolic volume index -GEDVI) trebuiesc folosite pentru a
determina punctul cand resuscitarea volemica si-a piedut utilitatea.
Daca in resuscitarea
volemica se tine cont numai de PVC si POAP si nu se ajusteaza indicii cardiaci
presionali de baza, se ajunge la o resuscitare fluida inadecvata
urmata de persistenta globala a ischemiei organelor si
cresterea riscului de MODS si deces. Pentru a evita acest neajuns PVC
trebuie corectata astfel:
PVC
corectata = PVC masurata - PIA/2
La pacientii cu
rezerva cardio-pulmonara redusa, decompresiunea precoce trebuie
sa fie luata in considerare ca metoda cu eficienta cea mai mare.
Efecte HIA asupra SNC.
Efectele sistemice ale
cresterii PIA nu sunt limitate doar la disfunctiile
cardiorespiratorii, efectele perfuziei cerebrale sunt deasemenea bine
documentate. Acest aspect are o importanta deosebita in
conditiile in care 50% din pacientii cu SCA cu trauma
abdominala majora au si injurii cerebrale semnificative
coexistente.
Reducerea perfuziei cerebrale
este in principal datorata scaderii fluxului venos secundara
cresterii presiunii intratoracice.
Desi expansiunea
volemica poate fi utila pentru mentinerea sau cresterea
presiunii arteriale medii si astfel a presiunii de perfuzie
cerebrala, aceasta poate fi nociva deoarece poate servi la
exacerbarea edemului cerebral. Aceste date sugereaza ca
nemonitorizarea cresterii PIA poate avea efecte neurologice adverse
severe.
In ultimul timp au fost raportate din ce in
ce mai multe cazuri in care au fost descrise efectele nocive ale HIA asupra presiunii
intracraniene (PIC) si asupra presiunii de perfuzie cerebrala (PPC).
Doua grupuri de cercetatori au raportat cazuri in care cresterea
PIA in timpul laparoscopiei cauzeaza semnificative cresteri ale PIC.
Bloomfield si col au
confirmat aceste constatari si au raportat un caz in care un pacient
politraumatizat, cu contuzie cerebrala, hemoragie subarahnoidiana,
fracturi ale bazinului si o mica contuzie hepatica, la admiterea
in ICU a avut cateterizata artera pulmonara si un dispozitiv de
monitorizare a presiunii intraventriculare cerebrale.
In ziua a sasea s-a
observat distensia abdomenului pacientului precum si o crestere
marcata a presiunii inspiratorii. SaO2 s-a deteriorat. PIC si
cantitatea de lichid cerebrospinal care a trebuit sa fie drenata
pentru a mentine in limite acceptabile PIC a crescut. Concomitent
presiunea de perfuzie cerebrala a scazut.
Totodata, diureticele
si manitolul au devenit necesare pentru mentinerea diurezei. A fost
suspicionata HIA, desi presiunea intraabdominala nu a fost
monitorizata. Dupa confirmarea diagnosticului a fost efectuata
laparotomie exploratorie si decompresiune, avand consecinta
imbunatatirea dramatica a sistemelor afectate. Cateterul
ventricular a fost retras dupa 24 ore de la interventie deoarece
postoperator PIC a ramas la valori joase.
Cresterea PIA cauzeaza cresterea presiunii in vena
cava superioara cu reducerea drenarii spre torace avand ca
rezultat:
-cresterea PVC
-cresterea PIC
-scaderea PPC
-edem cerebral, anoxia creierului
Modificari clinice locale (aparat
digestiv).
Intestinul pare sa fie
deosebit de sensibil la HIA si practic toate organele intraabdominale
si retroperitoneale prezinta scaderea fluxului sanguin in
prezenta PIA crescute, acest lucru avand consecinte fiind locale
si mai ales sistemice.
Astfel cresterea PIA
scade fluxul sanguin hepatic, scade fluxul venos portal si creste
fluxul prin anastomozele portocave.
Daca cresterea PIA este
mica pana la moderata, aceasta poate sa nu fie
evidenta la examenul abdominal, astfel ca la pacientii cu semne
clinice prezente sugestive de SCA este necesara evaluarea PIA.
Efectele HIA asupra
organelor abdominale au fost studiate la caini de Caldwel si Ricotta prin
evaluarea fluxului sanguin la toate organele abdominale si toracice in
conditiile cresterii PIA de la 0 la 20 si respectiv 40 mmHg.
Ei au constatat ca
fluxul sanguin la oricare din organele abdominale scade semnificativ. Singura
exceptie o constituie glanda suprarenala, motivul pentru care acest
organ nu este afectat nefiind cunoscut.
Diebel si col. au
crescut progresiv presiunea intraabdominala in timpul anesteziei la porci
la 10,20,30 si 40 mmHg. Ei au masurat fluxul sanguin din mucoasa
si intestin, precum si pH-ul intramucosal si au stabilit
valorile PIA la care acestea sunt afectate semnificativ. Evaluarea acidozei
mucoasei intestinale a fost obiectivata cu ajutorul tonometrului.
Experimental s-a aratat
ca o crestere a PIA de 10 mmHg peste valoarea normala, chiar in
prezenta unui debit cardiac si a unei presiuni arteriale medii
normale produce moficari marcate ale fluxului sanguin hepatic. Fluxul
sanguin al arterei hepatice si venei porte este redus cu 40% si
respectiv 30% presiunea venoasa portala, aceasta restrictie
crescand in paralel cu PIA. Fluxul in artera hepatica este afectat
direct de scaderea debitului cardiac indusa de HIA, iar fluxul
sanguin al venei hepatice si al venei porte este redus prin compresiune
extrinseca.
Aceste modificari ale circulatiei nutritive si functionale a
ficatului au impact asupra metabolismelor in care este implicat ficatul.
Cresterea PIA are
deasemenea si alte efecte asupra fluxului sanguin splanhnic, independent
de debitul cardiac. La o PIA mai mare de 15 mmHg se produce o reducere a
fluxului sanguin arterial mezenteric, iar la o PIA de 40 mmHg scaderea
este cu pana la 69%, rezultand o micsorare a fluxului sanguin si
a aportului sanguin la nivelul mucoasei digestive. Acidoza mucoasei este o consecinta
firesca a ischemiei ei.
Efectele negative ale PIA
asupra perfuziei mezenterice pot fi amplificate de prezenta hipovolemiei
sau a hemoragiei. Ischemia intestinului si perfuzia inadecvata
initiaza un cerc vicios de inrautautatire a
perfuziei, permeabilitate capilara crescuta, scaderea pH-ului mucoasei
si acidoza metabolica sistemica. S-a estimat ca la o PIA de 20 mmHg diminua perfuzia mucoasei
intestinale si apare translocatia bacteriena, a sepsisul si
a MSOF. S-a demonstrat ca translocatia bacteriana in nodulii
limfatici mezenterici apare in prezenta hemoragiei la o PIA de numai 10
mmHg.
Aceste modificari ale
fluxului sanguin splanhnic persista in ciuda mentinerii unui debit
cardiac si a unei incarcari volemice normale.
Studiu prospectiv de
investigare a oxigenarii mucoasei gastrice in timpul chirurgiei
laparoscopice elective. (Schwarte, Anesthesiology 2004)
|
Abdominal pressure:
|
Mucosal Oxygen Saturation
|
|
PIA = 0
|
|
|
PIA = 8
|
|
|
PIA = 12
|
|
Alti cercetatori
au obtinut aceleasi rezultate. Aceste modificari au
implicatii semnificative in translocarea bacteriana, aceasta fiind o
sursa importanta de sepsis si MSOF la pacientii critici.
In alt studiu, Diebel
si col au confirmat constatarile de scadere a fluxului sanguin
la nivelul organelor abdominale in special fluxul arterial si la nivelul
microcirculatiei hepatice.
Ivatury si col au
urmarit variatia pH-ului gastric ca un indicator al unei
resuscitari posttraumatice adecvate. HIA a fost asociata cu valori
scazute ale Ph intragastric la 4 din 6 pacienti. In timpul
masuratorilor nu au fost observate alte anomalii Ischemia intestinului subtire
si cresterea presiunii venoase portale cauzeaza edemul visceral,
fenomen care poate creste in plus volumul continut in cavitatea
peritomeala, urmata de cresterea si agravarea PIA.
Efectele locale abdominale ale
cresterii PIA se extind dincolo de compartimentul abdominal si de afectarea
fluxului sanguin al peretelui abdominal.
Semnele clinice sugestive de HIA si SCA la nivelul aparatului
digestiv sunt urmatoarele.
Istoricul la pacientii
cu SCA variaza in functie de cauza SCA. Durerea abdominala este
de regula prezenta in istoricul afectiunii.
Durerea abdominala
poate precede dezvoltarea SCA si poate fi relatata dupa
precipitarea unor evenimente cum ar fi traumatismul abdominal sau pancreatita.
Desi durerea abdominala
si distensia sunt comun prezente, alte simptome cum ar fi respiratia
cu dificultate si scaderea debitului urinar pot fi singurele semne de
HIA.
Aspectul de abdomen in
tensiune sau destins reprezinta simptomul cu frecventa cea mai mare
dupa durere.
Efectele asupra sistemului
reno-urinar:
Efectele renale ale HIA
si SCA includ scaderea fluxului plasmatic renal, a ratei
filtrarii glomerulare si a reabsortiei glucozei.
Presiunea de perfuzie renala (RPP) si gradientul de filtrare renala
(FG) au fost propusi ca factori-cheie in aparitia insuficientei
renale indusa de PIA. FG este forta mecanica de la nivelul
glomerulului si este egala cu diferenta dintre presiunea de
filtrare glomerulara (GFP) si presiunea din tubul proximal (PTP).
FG = GFP - PTP
In prezenta HIA se poate admite
ca PTP este egala cu PIA, si GFP se calculeaza ca PAM -
PIA. FG se calculeaza dupa formula:
FG = PAM - 2 x PIA
Astfel, modificarile PIA au un
impact mai mare asupra functiei renale si a productiei de
urina decat modificarile tensiunii arteriale medii (PAM). Astfel nu
este surprinzator ca scaderea functiei renale,
evidentiata de aparitia oliguriei, este unul dintre primele
semne vizibile ale HIA.
Oliguria este o manifestare
comuna a SCA. Cauza disfunctiei renale este multifactoriala. Cu
toate ca compresia ureterala a fost considerata mult timp un
posibil mecanism, insertia ureterala clinica si
experimentala a unui stent ureteral, nu a atenuat acest fenomen.
Ulterior s-a conturat si
s-a confirmat ipoteza ca reducerea ejectiei cardiace si de aici
a fluxului sanguin renal este in parte responsabila. In plus,
cresterea semnificativa a PIA creste presiunea in venele renale
si asupra parenchimului renal prin compresiune directa.
Combinarea efectului de
crestere a presiunii asupra venelor renale, a parenchimului renal (si
de aici a presiunii in tubul contort proximal) si reducerea fluxului
sanguin arterial renal, duce la scaderea gradientul de presiune de o parte
si de alta a membranei glomerulare si provoaca o reducere
marcata a filtrarii glomerulare.
In studii experimentale efectuate pe
pacienti normovolemici, o crestere a PIA de 20 mmHg
duce la reducerea in 75% din cazuri a
ratei filtrarii glomerulare, iar cand presiunea este mai
mare de 30 mmHg consecinta este
anuria, iar la pacientii hipovolemici acest fenomen se
produce la valori mai mici ale PIA.
Reducerea ratei filtrarii
glomerulare este refractara la administrarea de lichide, sugerand ca
reducerea fluxului sanguin renal este de mai mica importanta fata
de cresterea presiunii in venele renale.
In fata unei cresteri marcate a
presiunii intraabdominale, creatinina serica creste de trei ori
fata de nivelul de control in conditiite in care excretia
renala obiectivata prin urografie nu evidentiaza o obstructie.
Oliguria poate adesea sa fie prima consecinta
evidentiata in cresterea excesiva a presiunii
intraabdominale.
Totodata, presiunea extrinseca
directa creata asupra rinichilor produce o constrictie
circumferentiala cu efect compresiv renal bilateral, adica un
model experimental in care constrictia circumferentiala
progresiva determina o impachetare a structurilor perirenale
producand o compresiune cu directie in special antero-posterioara ce
cauzeaza hiperextensia rinichilor.
In acest model clinic experimental,
compresiunea circumferentiala are ca rezultat tardiv fie trauma
renala, fie perinefrita inflamatorie constrictiva si poate
duce la hipertensiune sistemica.
Simultan, la cresterea presiunii
intrarenale contribuie si rinichii printr-un mecanism intrinsec. Ca
reactie la actiunea combinata a traumei directe, hipoperfuziei,
hipoxiei celulare si scaderii presiunii de intoarcere venoasa,
structurile parenchimatoase solide renale incep sa se umfle exercitand o
presiune asupra capsulei renale.
Se creeaza astfel un ,,sindrom de
compartiment intrarenal". Astfel in sindromul de compartiment abdominal,
parenchimul renal pare sa fie in dublu pericol, fiind comprimat nu atat
prin cesterea presiunii interne, cat prin presiunea externa
exercitata de SCA insusi. Rezultatul net poate fi un sindrom unic de
,,dublu compartiment'' sau ,,sindrom de compartiment inclus in alt
compartiment''.
Alte mecanisme suspicionate
ar fi suntul fluxului sanguin intre corticala si medulara,
scaderea fluxului renal sanguin concomitent cu cresterea
rezistentei vasculare si prezenta unor nivele crescute de
renina, aldosteron si hormon antidiuretic.
In concluzie
modificarile aparute la nivelul aparatului reno-urinar sunt:
-scaderea fluxului arterial si
venos renal
-compresiune, congestie si edem
renal
-scaderea RFG
-necroza tubulara acuta
-oligurie/anurie neresponsive la repletia volemica sau
imbunatatirea functiei cardiace
-IRA
Alte efecte locale.
S-a demonstrat o reducere
marcata a fluxului sanguin pentru toate viscerele intraperitoneale si
retroperitoneale la o PIA mai mare de 20 mmHg.
Exceptia o constituie
glanda suprarenala pentru care, masurarea fluxului sanguin a
aratat o mentinere a fluxului chiar si la o PIA mai mare chiar
de 40 mmHg.
Efecte
la nivelul plagii operatorii.
Complicatiile
vindecarii plagii, in particular dehiscenta plagii si
dehiscenta fasciala este comuna la pacientii cu SCA. Spre
exemplu, fluxul sanguin la nivelul tecii rectus masurat prin laser Doppler
flowmetry este redus cu aproape 60% la o PIA de 10 mmHg. (7)
Deasemenea, depozitele de colagen si rezistenta la
infectii este direct corelata cu perfuzia si oxigenarea
tisulara, astfel ca cresterea PIA duce la crestrerea
perioadei de cicatrizare. (29)
Afectarea vascularizatiei
peretelui abdominal este datorata atat efectului compresiv direct asupra
microvascularizatiei peretelui cat si compromiterii fluxului vascular
in vasele epigastrice inferioare. Scaderea continutului in oxigen
si nutrieti la nivelul plagii operatorii creste riscul
postoperator de infectie si dehiscenta. (14)
Standardul actual prevede ca
medicul chirurg sa deceleze cresterea progresiva postoperatorie
a abdomenului pacientului, putand fi tentata deschiderea abdomenului in
speranta contracararii expansiunii peretelui abdominal si
reducerii tensiunii din perete. Efectul advers nedorit in aceasta
situatie este compromiterea tardiva a circulatiei in fascia
rectus. (5)
Compresia externa
realizata printr-un pansament extrem de compresiv se poate adauga la
compresiunea interna realizata de SCA asupra fasciei rectus,
amandoua ducand la compromiterea fluxului vascular parietal esential
pentru refacerea plagii.
Sindromul de reperfuzie.
Sindromul de reperfuzie este produs de
scaderea brusca a PIA si poate apare in evolutia
spontana (mai rar) sau in urma tratamentului chirurgical.
In timp, recorectarea brusca
dramatica (sindromul de reperfuzie) poate fi catastrofala. Morris
si colaboratorii au raportat asistolie subita fatala la 4 din
cei 16 pacienti care au avut celiotomie decompresiva. Etiologia
acestei opriri cardiace ramane neclara.
Ea poate fi consecinta mai multor
efecte, incluzand modificarile bruste ale solicitarii
respiratorii, schimbari drastice in fluidul sanguin, pierderea mecanismelor
de protectie impotriva hemoragiei digestive si modificari in
balanta acido-bazica. (5)
Sindromul de reperfuzie poate fi cu succes
indepartat prin asigurarea unui
acces venos adecvat si monitorizare arteriala inchisa, cu
rehidratare sustinuta, folosirea puls-oximetriei si managementul
atent necesar in modificarile rapide ale parametrilor respiratori,
cateterizarea aterei pulmonare pentru monitorizarea continua a
saturatiei oxigenarii venoase si monitorizarea temperaturii centrale.
Doi litri de solutie salina 0,45%
suplimentata cu manitol si bicarbonat este recomandata sa
fie administrata profilactic inainte de celiotomie. (34)
MOSF si
HIA
HIA duce la disfunctii organice prin
doua cai distincte separate.
Primul mecanism este cel mecanic, acesta
cauzand disfunctii organice semnificative si masurabile, in mare
masura legate de efectul cresterii presiunii asupra perfuziei
si functiei organului.
In al doilea rand, netratarea HIA poate
cauza efecte inflamatorii si imune acestea putand avea rezultat
insuficienta progresiva a organului.
In realitate, netratarea HIA
reprezinta a doua injurie ce duce la MOSF, deoarece netratarea ischemiei
celulare cauzata initial, pregateste sistemul imun al
pacientului pentru un raspuns exagerat pentru oricare alta agresiune
secundara.
Acest ,,priming" se produce pentru un timp
limitat, cca 3-16 ore de la injuria primara, de la care poate apare
momentul de hiperesponsivitate al sistemului imun. Interesant este ca, in
mod normal, timpul in care HIA se poate
dezvolta este de 8-16 ore de la injuria tisulara initiala,
adica exact perioada de maxima responsivitate imuna.
Rezende-Neto si col a constatat
ca HIA cauzeaza cresterea nivelului de citochine
pro-inflamatorii TNF, IL-6, IL-1 si de asemenea myeloperoxidaza (MPO) la
nivelul plamanilor pe un model animal.
Ei au aratat ca aparitia
HIA in timpul celor 8-16 ore critice duce la cresterea de 3 ori a
neutrofilelor inflamatorii.
Acesti autori concluzioneaza
ca exista o perioada vulnerabila ce urmeaza imediat
ischemiei si o a doua injurie reprezentata de raspunsul imun
hiper-inflamator, ce concura la o incidenta crescuta a MODS
si deces.
Alti cercetatori au gasit
crescuti mediatorii inflamatori, dar prin alt mecanism fiziopatologic decat cel
prezentat anterior si anume prin producerea fenomenului de translocare
bacteriana la nivelul intestinului aparuta ca o
consecinta a HIA asupra intestinului.
In concluzie putem spune ca
cresterea PIA cauzeaza compresiunea sau congestia venelor si
capilarelor mezenterice si reducerea fluxului sanguin catre
intestine avand ca rezultat:
-scaderea
perfuziei intestinale, cresterea edemului intestinal si deshidratare
-ischemie,
necroza, eliberarea de citokine
-translocare
bacteriana
-dezvoltareasi
perpetuarea SIRS-ului
-cresterea in
plusa presiunii abdominale.
Trebuiesc bagate in
partea speciala
Principalele
efecte produse de cresterea gradata a PIA sunt:
Modificari fiziologice la cresterea PIA intre 0-9 mmHg
Eliberarea de citochine
Acumularea de fluid in
spatiul 3
Scaderea intoarcerii venoase
si presarcinii
Efecte minime asupra PIC si
PPC
10-15 mm Hg:
Scaderea compliantei
peretelui abdominal cu 42%
Reducerea marcata a fluxului
sanguin in organele intra-abdominale ceduce la acidoza locala si
formarea de radicali liberi
Translocare bacteriana prin
peretele intestinal
16-25 mm Hg:
Agravarea deteriorarii
hemodinamice:
Scaderea marcata a
intoarcerii venoase si a perfuziei viscerelor
Cresterea PVC, POCP
Compromiterea plamanilor:
Scaderea VT, CRF, VR
Cresterea presiunilor
ventilatorii, hipercapnia, hipoxemia
26-40 mm Hg:
Colaps hemodinamic, agravarea
acidozei, hipoxemiei, hipercapniei, anurie.
Fluxul in artera celiaca
scade la 58%, artera mezenterica superioara - 39%, artera renala
- 30% (Barnes, AM J Physiol)
Reducere cu 80% a fluxului sanguin
in peretele abdominal
Incapacitatea ventilarii,
oxigenarii sau resuscitarii
Explorari paraclinice
Monitorizarea
directa si indirecta a PIA
PIA trebuie sa fie monitorizata
cand abdomenul este destins si in tensiune sau cand este suspectata
HIA. Daca este crescuta peste normal, PIA trebuie monitorizata
la fiecare 4 ore.
Importanta monitorizarii PIA
Cresterea PIA este un proces clinic
silentios care nu devine evident decat cand afectiunea este intr-un
stadiu evoluat. Detectarea precoce a HIA poate fi sugerata de
recunoasterea unor simptome clinice ce apar devreme si poate fi
confirmata de masurarea practica a PIA.
Kirkpatrik si col a condus un studiu
in care a a solicitat medicilor decelarea PIA doar prin examenul clinic. Ei au
constatat ca aceasta atitudine este gresita, 40% din
valorile semnificativ crescute ale PIA
scapand nedecelate.
Sugrue si col au avut rezultate
asemanatoare. Ambii autori concluzioneaza ca examenul
clinic este nesigur si recomanda monitorizarea de rutina a PIA.
Din cauza ca examenul clinic este
inexact, detectarea precoce a HIA necesita o metoda sigura,
reproductibila de masurare. In plus, metoda ar trebui sa fie
suficient de simpla astfel incat si personalul mediu sa
poata efectua frecvent masuratorile, pentru a permite detectarea
precoce a SCAensiunii PIA.
Intrucat literatura recenta
arata ca pacientii pot dezvolta SCA in aproximativ 6-8 ore,
consideram rezonabila sugestia
de a efectua initial masuratorile la 1-2 ore interval.
Tehnica
masurarii PIA.
PIA poate fi masurata prin
metode directe si indirecte:
-directe, invazive: -cateter intraperitoneal
-senzor
intraabdominal
-sac
gonflabil intraabdominal
-spectroscopia in infrarosu
-indirecte: -masurarea presiunii intravezicale (prin
intermediul unui cateter
Foley)
-masurarea presiunii gastrice (prin sonda
nasogastrica, prin balonul unui tonometru gastric).
Cu toate ca metodele directe sunt
foarte exacte indiferent de etiologia PIA, acestea sunt nepractice si
nerealizabile pentru practica obisnuita. Date din literatura
arata ca metoda cea mai sigura este masurarea presiunii cu
ajutorul transductorului de presiune pe calea unui cateter introdus in
cavitatea abdominala.
Prima metoda indirecta
descrisa implica plasarea unui cateter transfemural in vena cava
inferioara. Riscul asociat acestei proceduri include infectia si
formarea trombilor.
Masurarea indirecta a presiunii
se poate face prin vena cava inferioara, prin cavitatea
gastrica, pe calea rectala si vezica urinara. Totusi
metoda cea mai simpla aleasa este masurarea presiunii vezicii
urinare.
Si alte studii au aratat ca
presiunea masurata printr-un cateter Foley se coreleaza foarte
bine cu presiunile masurate direct din cavitatea abdominala si
reprezinta principala metoda de masurare a presiunii
intraabdominale.
Vezica serveste drept o
diafragma pasiva intre cavitatea peritoneala si cavitatea
vezicii atunci cand in interiorul vezicii urinare se gaseste un
continut de 50-100 ml. In acest fel este sunt reflectate variatii ale
PIA cuprinse intre 0-70 mmHg.
Tehnica este urmatoarea: se
aseaza pacientul in decubit dorsal, se introduce un cateter vezical
si dupa se goleste continutul vezicii se clampeaza
distal. Cu un ac de 18 G se introduce in interiorul vezicii prin inteparea
cateterului vezical un volum de 50-100 ml solutie salina.
Ulterior acul este conectat la un
transductor electronic de presiune venoasa centrala sau cu un
manometru de apa ce are ca punct de referinta simfiza
pubiana.
Ca alternativa se poate folosi un
robinet cu trei cai inserat intre cateterul Foley si transducerul de
presiune. Acestea sunt cuprinse in dispozitivul Ab Viser.
In decubit dorsal PIA normala este
mai mica de 10 mmHg. Dupa chirurgia abdominala PIA variaza
uzual intre 3-15 mmHg. La pacientii care au vezica neurogena sau
vezica mica contractata (ex dupa radioterapie),
masuratorile pot fi inexacte.
Obeid si col au comparat
masuratorile presiunilor vezicale, gastrice si intrarectale cu
valorile obtinute prin masurarea directa printr-un cateter
intraperitoneal. Acestia au evaluat deasemenea influenta pozitiei
corpului asupra masuratorilor indirecte. Concluzia a fost ca
preziunea vezicala reflecta cel mai fidel presiunea
intraabdominala si este metoda tehnica cea mai de incredere.
Toate cele trei metodede determinare ale PIA au devenit mai putin fidele
cand pacientul a fost pozitionat in pozitie Trendelemburg sau
anti-Trendelemburg.
Computer-tomograful.
Diagnosticul de SCA depinde in mare
masura de suspicionarea si recunoasterea pacientilor
cu risc, identificarea simptomelor clinice si in cele din urma
masurarea PIA.
TC abdominala poate ajuta la
stabilirea diagnosticului in putine cazuri de SCA. TC poate gasi:
-infiltrarea
retroperitoneului intr-un grad disproportionat cu afectiunea
peritoneala.
-compresiunea
extrinseca a venei cave inferioare cu hemoragie si exudate
retroperitoneale
-distensie
abdominala masiva cu un raport al diametrelor anteroposterior si
transvers crescut.
-compresiune sau
deplasare renala directa
-edem al peretelui
intestinal
-hernie
inghinala bilaterala
In 1999, Pickhardt a observat in plus la
pacientii cu SCA semnul ,,round-belly" (abdomen in cerc) - distensie
abdominala cu cresterea raportului diametrelor
anteroposterior/transvers; raport > 0,8, (p<0,001)
Echografia
abdominala
-anevrismul aortic (poate fi detectat in
special cand este mare)
-gazele intestinale si obezitatea fac ca
examinarea sa fie dificila
Rx abdomen
-examinari
abdominale seriate pentru a evidentia pneumoperitoneul sau obstructia
intestinala
-radiografia
abdominala pe gol este de
regula inutila pentru diagnosticarea SCA
Modificari
biologice in SCA:
-conturarea unui
tablou metabolic
-hemoleucograma
completa
-evaluarea amilazei
sanguine
-timpul de
protrombina TP si timpul de activare partiala a
tromboplastinei aPTT daca pacientii sunt heparinizati.
-testarea markerilor
cardiaci
-masurarea
acidului lactic seric
-gazele arteriale
sanguine ABG - este o cale rapida pentru masurarea pH, lactatul
si deficitul de baze.
-IL, TNF
Comentarii:
Nivelul PIA la care apare SCA este
variabil. In mod cert, variabilitatea raspunsului fiziologic la
cresterea gradata a presiunii, depinde partial de statusul
volumului intravascular al pacientului ca si de disfunctia
pulmonara sau renala existenta. In consecinta,
diagnosticul si tratamentul adecvat depinde de statusul clinic al
fiecarui pacient in parte.
Decelarea HIA si evaluarea
clinica a pacientilor are o deosebita importanta
pentru alegerea masurilor terapeutice.
Burc si col a propus o gradare a SCA,
care sa ajute in ghidarea terapiei. La pacientii cu presiuni mai mici
de 15 mmHg, tratamentul este rar indicat.
Nevoia de tratament pentru pacientii cu
SCA gradul II 15-26 mmHg) depinde in mare masura de statusul clinic
al pacientului. Pacientii fara oligurie si cu presiune
crescuta in caile aeriene justifica supravegherea riguroasa.
Pacientii cu SCA gradul III (25-35
mmHg) necesita de regula interventie. La acesti
pacienti disfunctiile hemodinamice si renale se dezvolta
adesea insidios, ducand o o intarziere atat a diagnosticului cat si a
tratamentului. Pacientii cu PIA mai mare de 35 mmHg (gradul IV) au de
regula conditii clinice grave ce necesita tratament imediat.
Monitorizarea presiunii compartimentului
abdominal are ca scop recunoasterea cresterii PIA inainte sa se
produca ischemia sau infarctizarea organelor abdominale. Cand pacientul
prezinta o distensie semnificativa a abdomenului, masurarea
presiunii compartimentului abdominal poate arata indicatia sau
momentul decompresiunii chirurgicale.
Metode farmacologice si chirurgicale utile in
scaderea presiunii intraabdominale
SCA este o entitate reala. Efectele
nocive produse de cresterea PIA, ca si metodele si beneficiile
decompresiunii au fost bine studiate, atat in laborator cat si in practica
clinica. Suspiciunea diagnostica poate fi obiectivata prin
masurarea PIA pentru a selectiona pacientii ce pot beneficia de
,,lasarea deschisa a abdomenului" cu proteze fSCAiale cum ar fi
,,artificial burr".
SCA afecteaza fiziologia organismului
si necesita tratament. In practica se intalneste mult mai
obisnuit HIA acuta fata de cea cronica. Deteriorarea
functionala implica:
-sistemul
cardiovascular
-sistemul respirator
-functia
renala, hepatica si gastrointestinala
-presiunea
intracraniana
Exista trei grade de severitate a
cresterii PIA. Cresterea acuta sustinuta a PIA la
valori de 10-20 mmHg se numeste HIA mica. Efectele fiziologice sunt in
general bine compensate si de regula nesemnificative clinic. Terapia
nonoperatorie poate fi necesara. HIA moderata este definita de cresterea
sustinuta a PIA intre 21-30 mmHg. Terapia este in general
necesara. Decompresiunea chirurgicala abdominala poate fi
critica. HA severa sau SCA este definita de o crestere
sustinuta a PIA peste 30 mmHg. Decompresiunea chirurgicala este
intotdeauna indicata. Spatiul liber dintre marginile inciziei
abdominale trebuie sa fie in mod provizoriu acoperite pentru a impiedica
retractia fSCAiei si formarea de hernii gigante.
Decompresiunea eficace este realizata
prin fSCAiotomie abdominala si acoperirea gaurii faciale cu
plasa tip Gore-tex, silastic sau cu proteze fSCAiale - artificial burr.
Toate tipurile de plasa ajuta la decompresiunea abdomenului.
Artificial burr ofera in plus avantajul de a reapropia treptat marginile
fSCAiei inainte de inchiderea fSCAiala si poate evita aparitia
fistulei si herniei observata la alte tipuri de plase.
Decompresiunea
terapeutica.
Decompresiunea terapeutica este
indicata in hipertensiunea abdominala (HA) severa. Sunt
disponibile mai multe metode chirurgicale si nonchirurgicale.
Decompresiunea poate anula toate efectele adverse ale cresterii presiunii
intraabdominale (PIA). Imediat dupa decompresiune poate fi observat un
raspuns paradoxal, ce consta cu o scurta crestere a
debitului cardiac si a fluxului in vena cava inferioara,
urmata de o revenire la valorile bazale.
Decompresiunea chirurgicala sau
nechirurgicala este incurajata direct intr-un numar mic de
rapoarte, bate pe decompresiunea abdominala prin ,,tehnica deschiderii
abdomenului". Desi aceste studii sunt concentrate pe managementul operator
in peritonitele difuze, importanta decompresiunii ca parte a tratamentului
nu este recunoscuta in mod adecvat.
Decompresiunea
nonchirurgicala.
Decompresiunea nonchirurgicala este
relatata in special la pacientii cirotici cu SCAita.
Indepartarea SCAitei la pacientii cirotici este urmata de
scaderea PIA si de o imbunatatire dramatica a
functiei renale, performantei cardiace si perfuziei hepatice.
Inlaturarea brutala a unui volum mare de lichid peritoneal este
hemodinamic stabila la pacientii care nu au depletie
volemica.
Optiuni de
tratament nechirurgical:
-Paracenteza
-Aspiratia
gastrica
-Rectal enemas and
suctioning
-Prokinetice gastrice:
cisapride, metoclopramid, domperidone, eritromicina
-Prokinetice colonice:
prostigmina
-Furosemid singur sau
in combinatie cu albumina umana 20%
-Hemofiltrare
continua veno-venoasa cu ultrafiltrare agresiva
-Presiune
abdominala continua negativa
-Sedarea
-Curarizarea
-Pozitia corpului
Decompresiunea
chirurgicala.
Decompresiunea chirurgicala abdominala
este metoda de ales la pacientii cu HA severa prin edemul peritoneal
sau tumori mari. S-au
publicat studii clinice cu decompresiunea posttraumatica sau
postoperatorie la 253 pacienti diagnosticati cu SAC. S-a produs o
imbunatatire a hemodinamicii dupa decompresiune precum
si a variabilelor functiei respiratorii, perfuziei tisulare si
parametrilor functiei renale. Dupa decompresiune
se obtine o ameliorare imediata a functiilor cardiaca,
respiratorie si renala, urmata ocazional de episoade tranzitorii
de hipotensiune. Au fost raportate deasemenea asistola imediat dupa
decompresiune cu rezultat fatal. Aceasta poate fi explicata prin faptul ca dupa decompresiune,
ejectia cardiaca creste in timp ce rezistenta
vasculara sistemica descreste, iar hipotensiunea arteriala
apare din cauza ca dilatatia vaselor periferice este mai
profunda. Ipoteza ca colapsul
cardiovascular postdecompresiune este consecinta eliberarii de acizi
metabolici din viscerele ischemiate reperfuzatesi din
extremitatile inferioare nu este bine documentata.
Tehnica de
decompresiune abdominala.
Pentru a preveni decompensarea
hemodinamica ce insoteste decompresiunea chirurgicala,
trebuie indeplinite cateva obiective: restabilirea volumului
intravascular, optimizarea aportului de
oxigen si corectarea hipotermiei si defectelor de coagulare.
Abdomenul trebuie sa fie deschis in conditii optime in sala de
operatie, incluzand monitorizare hemodinamica cu acces venos adecvat
si ventilatie controlata. Ca masura de combatere a
reperfuziei cu produsi ai metabolismului anaerob, poate fi benefica
incarcarea volemica profilactica cu solutii cristaloide,
manitol si bicarbonat.
Folosirea agentilor vasoconstrictori in
timpul decompresiunii pentru a preveni scaderea subita a presiunii
sanguine poate fi benefica.
Dupa decompresiune, incizia
fSCAiala si abdominala este lasata deschisa
folosind una din metodele de inchidere temporara mentionate mai jos.
Incizia de deschidere abdominala postdecompresiune trebuie
,,sigilata" ermetic folosind Hipobaric Wound Shield, autoaderenta ce
asigura o usoara presiune negativa ce previne contaminarea
cavitatii abdominale.
Inchiderea inciziei abdominale cu burr
closure. Este cea mai recomandata si consta in
parasirea fSCAiei si inchiderea doar a tegumentului cu suturi
sau clipsuri pentru a evita eviscerarea.
Cu toate acestea, cateodata, inchiderea
tegumentului singura nu poate asigura o decompresiune suficienta.
Spre exemplu, la PIA de 50 mmHg sau mai
mare, aceasta tehnica poate sa sa nu fie suficienta.
Cu siguranta, lasarea
nesuturata atat a fSCAiei cat si a tegumentului (tehnica abdomen
deschis) ofera reducerea maximala a PIA, dar aceasta poate avea ca
rezultat fistulizarea si eviscerarea. Acoperirea inciziei fSCAiale prin
utilizarea protezelor inlatura aceste probleme.
Protezele absorbabile sau neabsorbabile,
poroase sau neporoase au fost recomandate in aceste situatii cu rate de
succes variabile.
Folosirea absorbantilor prostetici este
asociata frecvent cu formarea herniei ventrale si a fistulei intestinale,
pe cand folosirea plasturelui Gore-tex, plasei Marlex si plasei silastice
la pacientii care au necesitat resuscitare volemica masiva
dupa trauma abdomino-pelvina mare sau anevrism aortic abdominal
rupt au avut rezultate acceptabile. Gore-tex in particular minimizeaza
riscul fistulizarii gastrointestinale asociat altor tehnici.
Cea mai buna optiune poate fi
,,artificial burr" (Wittmann-pach), un Velcro-like, dispozitiv care este
aprobat de autoritatea europeana Conformite Europeene si U. S. Food
and Drug Administration (FDA).
Inchiderea ,,artificial burr" consta in
doua foite de fibre sintetice impletite, fiecare cu elemente de
prindere pe o suprafata. Cand se aplica una pe cealalta,
aceste foite adera impreuna. La sfarsitul operatiei
cele doua foitesunt suturate cu nylon 0 de cele doua margini ale
inciziei abdominale.
Dupa aceea foile sunt aplicate una pe
cealalta, realizandu-se astfel inchiderea temporara. Scaderea
sau cresterea ariei de contact intre cele doua foite
regleaza tensiunea inchiderii.
Folosirea de rutina a ,,artificial
burr" in mai mult de 200 de cazuri, nu s-au intalnit nici un caz de
fistula intestinala.
Odata identificata patologia
si HA este controlata,
abdomenul poate fi inchis fSCAie la fSCAie ca la o laparotomie
necomplicata.
Reinchiderea
abdomenului.
Reanchiderea abdomenului trebuie sa fie
incercata doar la pacientii bine resuscitati la care oxigenarea
tisulara a fost bine restabilita si hipovolemia, hipotermia
si coagulopatiile au fost bine corectate. In mod ideal, in absenta
semnelor ce indica o reexplorare timpurie, reinterventia trebuie
sa fie programata cand este foarte probabil sa se realizeze
inchiderea fSCAiala completa. Aceasta se intampla de obicei la
3-4 zile de la injuria primara cand reinviorarea diurezei, balanta
fluida negativa, reducerea circumferintei abdominale si
scaderea edemului periferic proclama reducerea edemului parietal
si visceral. Cu toate acestea, sunt situatii in care abdomenul nu
poate fi inchis rezultand o hernie ventrala planificata care
necesita o ingrijire de lunga durata si lasa cicatrici
deformante.
De obicei, inchiderea fSCAiala
primara in timpul spitalizarii initiale poate evita problema mai
sus mentionata.
La reinterventie, cele doua
foite ale ,,artificial burr" se desfac una de pe cealalta si
cavitatea abdominala poate fi perfect explorata. Cand tensiunea
intraabdominala este excesiva, documentata prin cresterea
presiunii peste 20 mmHg, cele doua foite sunt aplicate din nou una pe
cealalta. De regula, in timpul reexplorarii, suprafata de
contact al celor doua foite poate fi scazuta si
suprapunerea poate fi scazuta realizand o scadere treptata
a defectului abdominal si inchiderea fSCAiala finala in timpul
unei proceduri urmatoare planificate.
Cand presiunea abdominala este mai
mica de 15-20 mmHg, inchiderea fSCAiala finala poate fi
incercata. Tentarea inchiderii finale presupune ca chirurgul este
satisfacut in ce priveste hemostaza, viabilitatea intestinului, debridarea
de tesut viabil sau necrozat si posibilitatea inchiderii finale strat
cu strat daca are certitudinea ca o laparotomie suplimentara nu
este necesara in viitorul apropiat.
ACS si
peritonitele.
Cresterea PIA ca efect secundar al
infectiei abdominale implica o selectie de pacienti cu un
prognostic grav. Chirurgul ce trata infectia intraabdominala
,,respecta" enorma crestere a PIA la sfarsitul secolului XIX.
Desi tratamentul efectiv al ACS
adevenit disponibil odata cu introducerea tehnicilor de abdomen deschis,
putini autori realizeaza influenta benefica a acestor
metode asupra tulburarilor fiziopatologice determinate de HA. Adeptii laparotomiei planificate pentru
infectia abdominala severa sau trauma, care nu au
apreciat efectele adverse ale PIA
initiala, au inchis abdomenele cu suturi de retentie sau
fermoare simple. Observand ca suturile de retentie (apropiere)
mentin o presiune marcat crescuta asupra peretelui abdominal
subjacent chiar si prin utilizarea placilor de plastic folosite
pentru a reduce aceasta tensiun, chirurgii au apreciat mai mult impactul
cresterii PIA, a modificarilor fiziopatologice produse si au
manifestat mai mult interes pentru dispozitivele de inchidere abdominala
temporara. Cavitatea abdominala
este inchisa folosind dispozitivul de inchidere Star.
O privire asupra variatelor tehnici de
inchidere abdominala arata ca pot exista
imbunatatiri. Rata mortalitatii la 869 cazuri de abdominostomie deschisa a
fost 41,7% si 39,1% din 439 de cazuri de abdominostomie cu plasa
(mesh). O posibila explicatie pentru lipsa de
imbunatatire a acestor rezultate poate fi tocmai existenta
a prea multe complicatii aditionale ce primejduiesc rezultatul unei
abdominostomii deschise. Fistula intestinala este intalnita in mai
mult de 16% din cazuri de abdominostomie deschisa si in mai mult de
10% din operatiile de abdominostomie cu plasa (ochi de plasa).
Folosirea unui dispozitiv mesh pentru inchiderea temporara
abdominala cu planificarea laparotomiei (Star abdominostomy) poate sa
evite problemele intalnite in timpul deschiderii abdomenului. Rata de mortalitate pentru 385 de cazuri
cuprinse in 11 studii care au cuprins cazuri cu Star abdominostomy a fost 28,1%
in timp ce in mod conventional mortalitatea la grupul martor a fost de
44,2%.
Studiile
facute nu au dat nici un raspuns la intrebarea ce dispozitiv este cel
mai bun pentru a acoperi spatiul liber intre marginile abdominale
deschise.
Dispozitivul Ethizip se poate desface cu
usurinta si se poate deschide spontan in unitatea de
terapie intensiva.
Folosirea Marlex cu fermoar necesita
frecvent resutura fermoarului pe masura ce edemul abdominal scade
si marginile peretilor abdominale trebuie sa fie reapropiate.
Foile de Gore-tex si materialele
similare sunt prea mici si sunt proiectate pentru a fi utilizate doar cateva
zile.
U. S. Food and Drug Administration (FDA) nu
a aprobat Ethzip, fermoarele (the zippers), sacii de plastic (Bogota Bags),
pentru utilizarea medicala. FDA a aprobat pe de alta parte
,,artificial burr". Acesta rezista unei forte de tractiune mai mare
decat lb si in consecinta acesta nu se poate deschide
niciodata spontan in mana noastra. Acesta permite foarte usor
ajustarea la modificarile circumferintei abdominale. El pare sa
fie dispozitivul cel mai avantajos.
Sindromul de
compartiment abdominal si trauma.
Pacientii cu injurii multiple sau cu
soc hemoragic din cauza unui traumatism abdominal penetrant este in
special susceptibil de a dezvolta ACS. Exista numeroase rapoarte in
literatura privind aceste traume si decompresiunea abdominala.
Sindromul de compartiment poate fi in plus agravat daca este necesara
o laparotomie imediata pentru controlul hemoragiei. Odata ce
abdomenul este deschis la acesti pacienti, resuscitarea lichidelor
sechestrate in peritoneu si peretele intestinal, ducand la iesirea
intestinelor prin incizia abdominala, unde protuzia este acoperita cu
,,artificial burr" sau Wittmann-pach. Este imposibila inchiderea
abdomenului in aceste conditii, ca si inchiderea fortata la
pacientii care au hematom retroperitoneal masiv, edem visceral,
infectie severa abdominala.
Fiecare din multiplele forme de inchidere
temporara au mai multi sustinatori, dar cei mai multi
sunt nemultumiti. Cu dispozitivul ,,burr" fSCAia abdominala
poate fi reajustata pe masura ce edemul abdominal se reduce
si inchiderea finala poate fi realizata prin inchiderea fSCAie
la fSCAie. Formarea de hernii abdominale imense este evitata.
Prevalenta SCA
Prevalence of
intra-abdominal hypertension and abdominal compartment syndrome in the ICU:
Many authors have
published data stating how common abdominal compartment syndrome is in their
clinical practice. Reported incidence ranges from a few percent to over 40
percent. However, as of 2004, only one article has systematically measured
intra-abdominal pressure in every single patient in multiple ICU's to determine
the prevalence of intra-abdominal hypertension and abdominal compartment
syndrome in a broad sample of patients.(Malbrain, Chiumello et al. 2004) (See
abstract of article at end of this discussion). Prevalenta SCA Prevalenta intra-abdominale si sindromul de
hipertensiune arteriala abdominale compartiment in UTI:
Multi autori au publicat date in care se
specifica sindromul abdominale cum comune compartiment este in practica
lor clinice. Raportat incidenta
variaza de la cateva procente de peste 40 la suta. Cu toate acestea,
din 2004, doar un singur articol a masurat sistematic intra-abdominale de
presiune in fiecare singur pacient in UTI multiple, pentru a determina
prevalenta intra-abdominale si sindromul de hipertensiune
arteriala abdominale compartiment intr-un esantion mare de
pacienti. (Malbrain, Chiumello et al. 2004) (A se vedea abstract de
articol la sfarsitul acestei discutii).
The study was
conducted in 13 separate ICU's in 6 different countries. The investigators
measured intra-abdominal pressure (PIA) in every patient in the ICU for a 24
hour period to determine how many had elevations of their pressures
(intra-abdominal hypertension - HIA) and how many developed abdominal
compartment syndrome (ACS). They defined HIA as a pressure over 12 mm Hg,
severe elevation as and PIA over 15 mm Hg and ACS as a pressure over 20 mm Hg
with evidence of at least one organ failure. The results are impressive for the
frequency of this disease process: Over half the patients had intra-abdominal
hypertension, one-third has severe HIA and almost 1 in 10 had abdominal
compartment syndrome -- a disease process that dramatically increases organ
failure and death. Interestingly, the medical ICU patients had as much or more
ACS as the surgical/trauma patients. Studiul a fost realizat in 13 de UTI separate, in 6
tari diferite. Anchetatorii intra masurat presiunea-abdominale (PIA) in
fiecare pacient din UTI, pentru o perioada de 24 de ore pentru a determina
cat de multe au avut cresteri ale presiunilor lor (intra-abdominale
hipertensiune arteriala - HIA) si modul in care au dezvoltat sindrom
de compartiment abdominal (SCA). Ei HIA definit ca o presiune de peste 12 mm
Hg, la o altitudine de sever ca si PIA peste mm Hg 15 si ACS ca o
presiune de peste 20 mm Hg, cu dovezi de insuficienta de organ cel
putin unul. Rezultatele sunt impresionante pentru frecventa acestui
proces bolii: Mai mult de jumatate dintre pacienti au avut
hipertensiune intra-abdominale, o treime a HIA severe si aproape 1 din 10
au avut sindrom de compartiment abdominal - un proces de boala care
creste in mod dramatic insuficienta de organ si deces.
Interesant, pacientii cu afectiuni medicale UTI au avut ACS cat de
mult sau mai mult ca pacientii traumatism chirurgical /.
|
Cut-off (mm Hg)
|
Total
prevalence
|
MICU
prevalence
|
SICU
prevalence
|
|
PIA >= 12 mm Hg
|
|
|
|
|
PIA >= 15 mm Hg
|
|
|
|
|
PIA >= 20 mm Hg
Plus organ failure
|
|
|
|
The authors also
tried to identify patients who were at risk versus those who were not --
obesity and total intravenous fluid infusion increased the risk of ACS, but no
group of clinical information could separate those patients with elevated PIA
from those with normal PIA. They conclude: Bladder pressure measurement is
accurate for screening for elevated PIA, PIA measurements should be taken as
often as is reasonably possible to detect elevated PIA early, and
'Our study
suggests that there is no specific type of patient or disease or treatment that
reliably indicates when PIA needs to be measured, or when measurement is not
necessary in a mixed ICU population. Indeed, it seems that ..PIA should be
routinely measured.' Cut-off mm
Hg () Total MICU prevalenta SICU prevalenta
prevalentei
PIA> = 12 mm Hg 58,8% 54,4% 65%
PIA> = 15 mm Hg 28,9% 29,8% 27,5%
PIA> = 20 mm Hg
Plus insuficienta de organ 8,2% 10,5% 5%
Autorii au incercat, de asemenea, la identificarea
pacientilor care au prezentat un risc, comparativ cu cei care nu au fost -
a obezitatii si a totala de perfuzie intravenoasa de
lichide a crescut riscul de SCA, dar nici un grup de informatii clinice ar
putea separa cele pacienti cu PIA ridicate de la cele cu PIA normale. Ei
concluzie: vezicii urinare masurarea presiunii sunt exacte pentru
screening-ul pentru PIA crescute, masuratorile PIA ar trebui sa
fie luate cat de des este posibil, in mod rezonabil pentru a detecta crescute
PIA timpurie, si
'Studiul nostru sugereaza ca nu
exista nici un tip specific de pacient sau de boala sau de un
tratament care indica in mod credibil atunci cand PIA trebuie sa fie
masurat, sau atunci cand de masurare nu este necesar intr-o
populatie mixta ATI. Intr-adevar, se pare ca .. PIA ar trebui
sa fie masurate de rutina . '
The importance of
this article:
There has been a
focus in the past on this disease as a traumatic disease. This article clearly
demonstrates the HIA and ACS are present in medical as well as surgical and
trauma ICU's. In fact, it is as common or more common in the medical
population. The clear point here - all ICU's need to measure PIA.
Prevalence: This is
the only study to define how common this disease process is in a multi-center,
mixed ICU population. The high prevalence of this disease in a broad ICU
population makes its detection and monitoring all the more important.
Prediction
parameters: The ability to determine in advance who would develop HIA or ACS
was very limited, making the importance of monitoring all critical patients
more important.
Other researchers
have duplicated these results. Efstathiou et al noted PIA levels greater than
12, 15 and 20 mm Hg in 67%, 25% and 4% of their septic population respectively,
while Hernandez et al found PIA > 20mm Hg in 51% of their critically ill septic
shock population.(Efstathiou, Zaka et al. 2005; Hernandez, Requeira et al.
2005) Even pediatric patients suffer a high prevalence of intra-abdominal
hypertension. Ejike, et al noted a 17.6% incidence if abdominal compartment
syndrome in her ventilated pediatric ICU population.(Ejike and Mathur 2005)
Critical care providers need to move beyond the outdated belief that
intra-abdominal hypertension is just a traumatic disease and begin thinking and
recognizing it as a critical care disease, ubiquitous throughout ICU
populations. Importanta
acestui articol:
Acolo a fost un accent in trecut despre aceasta
boala ca o boala traumatic. Acest articol demonstreaza in mod clar
HIA si SCA sunt prezente in medicale, precum si chirurgicale, precum
si trauma ATI's. De fapt, ea este la fel de comun sau mai frecvente in
randul populatiei medicale. Punct
de clar aici - nevoie de toate UTI de a masura PIA.
Prevalenta: Acesta este singurul
studiu pentru a defini modul in comun acest proces boala este intr-o
multi-center, populatie mixta ICU. Prevalenta inalta a
acestei boli intr-o populatie larg UTI face de detectare si in
monitorizarea cu atat mai important.
Parametrii Prediction: capacitatea de a stabili in
avans, care s-ar dezvolta HIA sau SCA a fost foarte limitat, ceea ce face
importanta monitorizarii tuturor pacientilor critice mai
important.
Alti cercetatori au duplicat aceste rezultate. Efstathiou et al observat niveluri de PIA mai mare de
12, 15 si 20 mm Hg la 67%, 25% si 4% din populatia lor septice,
respectiv, in timp ce Hernandez et al gasit PIA> 20 mm Hg la 51% din
populatia lor, in stare critica soc septic. (Efstathiou, Zaka et
al. 2005; Hernandez, Requeira et al. 2005) Chiar si copii si
adolescenti sufera de o prevalenta mare de hipertensiune
intra-abdominale. Ejike, et al observat o incidenta 17,6% in cazul
sindromului de compartiment abdominale in ea ventilate populatiei
pediatrice ATI. (Ejike si Mathur 2005) furnizorii de servicii de critice
trebuie sa treaca dincolo de credinta depasita
care intra-abdominale hipertensiune arteriala este doar o boala
traumatica si de gandire si de a incepe recunoscand-o ca o
boala de ingrijire critice, omniprezente in intreaga populatiile ICU.
XCXHCXCXVXCXVCXVCXVCXVCXVCXCXVCXVCXVCXVCXVCXVXC
References
Efstathiou, E., M.
Zaka, et al. (2005). 'Intra-abdominal pressure monitoring in septic
patients.' Intensive Care Medicine 31, Supplement 1(131): S183, Abstract
703.
INTRODUCTION.
Intra-abdominal pressure measurement through the urinary bladder in critically
ill patients is easily obtained by low cost means. Recent studies revealed the
possible significance of this parameter variation in critically ill. Special
attention was paid until now in cases of abdominal compartment syndrome (PIA
> 20 mm Hg). Intra-abdominal hypertension is recognized when the elevation
of the parameter exceeds 12 mm Hg.
METHODS. In a
prospective study, in our mixed ICU we monitored on six hour basis for 3 days
intra-abdominal pressure in 26 patients with sepsis (confirmed by elevated
Procalcitonin values) with a device standardized by our team through the
urinary bladder. The mean age of the patients was 64±5 years. 16 of them were
medical and 10 surgical admissions.
RESULTS.
Intra-abdominal hypertension is recognized in the majority of the cases we
included in the study. Specific procedures like neuromuscular blockade,
decompression of the gastro-intestinal tract (Levin / rectal tube, enemas) and
dialysis seem to lower intra-abdominal pressure. On the contrary, massive fluid
resuscitation (more than 5 liters) results in elevation of the parameter.
|
Cut-off
(mm Hg)
|
Total
|
MICU
|
SICU
|
|
> 12
|
|
|
|
|
> 15
|
|
|
|
|
>20
Plus organ failure
|
|
|
|
CONCLUSION. No
specific relation is revealed between sepsis and the fluctuation of the
intra-abdominal pressure but continuous PIA monitoring might prove to be a
significant index of fluid resuscitation in septic patients.
Ejike, J. C. and M.
Mathur (2005). 'Occurence and outcome of abdominal compartment syndrome in
critically ill children.' Critical Care Medicine 33(12 supplement): A95,
Abstract 158-M.
INTRODUCTION:
Abdominal compartment syndrome (ACS) is a potential problem in critically ill
children. The occurrence in adults ranges form 1- 8% with mortality as high as
61%.
HYPOTHESIS: ACS is a
significant problem in critically ill children with an occurrence similar to
critically ill adult patients.
METHOD: A
prospective, observational study done in a tertiary PICU to determine the
occurrence of ACS in critically ill children. Intra-abdominal pressures (PIA)
were recorded in 6 patients clinically suspected of ACS and 45 mechanically
ventilated pediatric patients if parental consent was given. Patients were
enrolled within 24 hours of PICU admission and monitored every 6 hrs for 24
hrs. The intra-vesical technique was employed using optimal bladder volumes
determined for each patient or 1cc/kg (up to 25cc) of 0.9%NaCl. Intra-abdominal
hypertension (HIA) was defined as PIA sustained at > 12mmHg and ACS was
defined as (PIA) >12 mm Hg accompanied by at least 2 acute organ system
dysfunction or decompensation. Data was presented as median (range) and
analyzed by Mann-Whitney U test. Significance was accepted as p <0.05.
RESULTS: Of 146
mechanically ventilated patients admitted, 51 (34.9%) were studied. Ten of 45
(22.2%) not clinically suspect for ACS had HIA of which 3 developed ACS. The 6
clinically suspected of having ACS had ACS. Therefore 9/51 (17.6%) mechanically
ventilated PICU patients had ACS. The median PIA with ACS was 18mmHg
(13-32mmHg). The mortality associated with ACS was significant, 3/9 (33.3%) ACS
vs 1/41 (2.4%) non-ACS; (p=0.01). Of the 6 ACS patients who survived, 1 had
decompressive laparotomy with open abdomen management and 1 had abdominal
decompression by peritoneal drain placement for SCAitis. The median length of
PICU stay for patients with ACS was 13d (5-35d) compared to 6d (1-72d) (p=0.06)
of non-ACS patients.
CONCLUSION: The
occurrence of ACS in a subset (mechanically ventilated) of patients admitted to
the PICU is higher than the occurrence in adults. It is associated with a long
PICU stay and significantly higher mortality compared to non-ACS patients.
Hernandez, G., T.
Requeira, et al. (2005). 'Intra-abdominal hypertension in septic shock
patients.' Intensive Care Medicine 31, Supplement 1(134): S91, Abstract
339.
INTRODUCTION.
Intra-abdominal hypertension (HIA) may contribute to splanchnic hypoperfusion
and multiple organ failure in critically ill patients. Nevertheless, limited
information exists about HIA in septic shock patients, where severe
distributive and microcirculatory abnormalities are present. Even moderate
increases in intra-abdominal pressure may worsen hypoperfusion during septic
shock. Our aim was to evaluate in septic
shock patients
compared to postoperative control patients with known risk factors for HIA: (a)
the incidence and time course of HIA during early ICU stay; and (b) the
consequences of HIA in lactate levels, maximum SOFA and norepinephrine
requirements.
METHODS. 27 septic
shock patients and 19 abdominal surgery patients with > 2 risk factors for HIA
admitted consecutively were included. Intra-abdominal pressure was measured
every 6 h during the first 48 h. HIA was diagnosed with 2 consecutive
measurements > 20 mm Hg. Clinical data and risk factors for HIA were registered.
During follow-up SOFA, peak norepinephrine doses and lactate levels were
registered daily. HIA incidence was established in both groups. Lactate levels,
norepinephrine requirements and SOFA scores in patients with and without HIA in
both groups were statistically compared.
RESULTS. 51% of
septic shock and 31% of control patients developed HIA. Septic shock patients
with and without HIA were comparable in peak norepinephrine dose, SOFA and
mortality. However, peak lactate levels were significantly higher in septic
shock patients with HIA compared with those without HIA (3.5 vs. 1.9 mmol/L,
p<0.04). There was a significant positive temporal correlation between
intra-abdominal pressure and lactate in septic shock patients with HIA. Peak
levels of both occurred early and decreased progressively over time. Control
patients with and without HIA exhibited comparable normal lactate levels.
CONCLUSION. We
demonstrated a very high incidence of HIA in septic shock. Lactate levels were
significantly higher in septic shock patients with HIA compared to those
patients without HIA or to control patients with HIA. There was a close
temporal correlation between lactate and intra-abdominal pressure values over
time.
Malbrain, M. L. N.
G., D. Chiumello, et al. (2004). 'Prevalence of intra-abdominal
hypertension in critically ill patients: a multicentre epidemiological
study.' Intensive Care Med 30(5): 822-9.
OBJECTIVE. Although
intra-abdominal hypertension (HIA) can cause dysfunction of several organs and
raise mortality, little information is available on the incidence and risk
factors for HIA in critically ill patients. This study assessed the prevalence
of HIA and its risk factors in a mixed population of intensive care patients.
DESIGN. A
multicentre, prospective 1-day point-prevalence epidemiological study conducted
in 13 ICUs of six countries.
INTERVENTIONS. None.
PATIENTS.
Ninety-seven patients admitted for more than 24 h to one of the ICUs during the
1-day study period.
METHODS.
Intra-abdominal pressure (PIA) was measured four times (every 6 h) by the
bladder pressure method. Data included the demographics, medical or surgical
type of admission, SOFA score, etiological factors such as abdominal surgery,
haemoperitoneum, abdominal infection, massive fluid resuscitation, and ileus
and predisposing conditions such as hypothermia, acidosis, polytransfusion,
coagulopathy, sepsis, liver dysfunction, pneumonia and bacteraemia.
RESULTS. We enrolled
97 patients, mean age 64+/-15 years, 57 (59%) medical and 40 (41%) surgical
admission, SOFA score of 6.5+/-4.0. Mean PIA was 9.8+/-4.7 mmHg. The prevalence
of HIA (defined as PIA 12 mmHg or more) was 50.5 and 8.2% had abdominal
compartment syndrome (defined as PIA 20 mmHg or more). The only risk factor
significantly associated with HIA was the body mass index, while massive fluid
resuscitation, renal and coagulation impairment were at limit of significance.
CONCLUSION. Although
we found a quite high prevalence of HIA, no risk factors were reliably
associated with HIA; consequently, to get valid information about HIA, PIA
needs to be measured.
a.
Monitorizarea parametrilor
clinici ai sindromului de compartiment
abdominal.
INDICATIILE DE
MONITORIZARE A PIA:
Postoperator in chirurgia
abdominala
Pacienti cu traumatisme
abdominale inchise sau deschise
- Pacienti ventilati
mecanic cu diferite disfunctii de organe ce sunt evaluate zilnic prin
scorul Sequential Organ Failure Assessment (SOFA)
- Pacienti cu abdomen
destins si semne mptome sugestive pentr SCA:
-oligurie
-hipoxie
-hipotensiune
-acidoza
inexplicabila
-ischemie
mezenterica
-PIC crescuta
5. Pacienti cu packing abdominal dupa inchiderea temporara
abdominala dupa multiple traume sau transplant hepatic
6. Pacienti care nu au suferit o interventie chirurgicala
dar care au primit volume mari de fluide pentru resuscitare in contextul
underlying capillary leak problem (pancreatita, soc septic, trauma)
RECOMANDARI
- Studiile stiintifice ce examineaza prevalenta
si incidenta HIA/SCA trebuie sa aiba la baza definitiile
si situatiile de mai sus.
- Rezultatele trebuie sa prevada pentru PIA valori ale mediei,
medianei si maximei pentru admiterea
and during the study stay.
- Evaluarea PIA prag trebuie sa fie bazata pe analiza
caracteristicilor operatorii primite (ROC) si a ariei de sub curba
ROC.
- Studiile ce examineaza noi modalitati de masurare
a PIA trebuie intotdeauna sa compare valorile PIA masurate prin
noua metoda si cu cele obtinute prin metodele standard de
aur
- Validarea unei noi tehnici trebuie sa nu se limiteze doar la
analiza semnificatiei corelarii coeficientului cu R2, dar trebuie de
asemenea sa cuprinda o analiza conforma cu Bland si
Altman;
- Prezenta HIA/SCA fie ca este primara, secundara
sau tertiara trebuie intotdeauna sa fie vazuta in
contextul etiologiei. Noi am identificar 4 mari categorii de
pacienti:
-chirurgical
-medical
-traumatism
-arsura
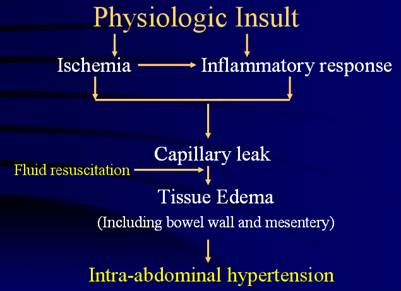
Miscellaneous
Elevated intra-abdominal pressure
causes:
Reduces perfusion of surgical and
traumatic wounds
Reduced blood flow to liver, bone
marrow, etc.
Blood pooling in pelvis and legs
"Second hit" in the two event
model of MOF?
The Result:
Poor wound healing and dehiscence
Coagulopathy
Immunosuppression
DVT and PE risks
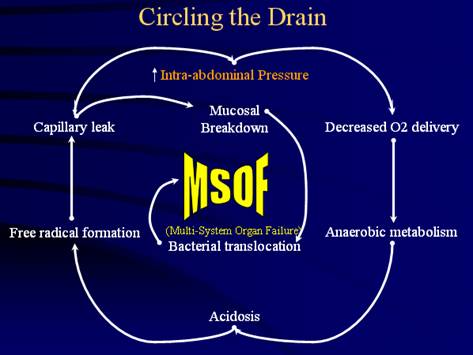
Intra-abdominal
hypertension and cardiac function
Intra abdominal hypertension adversely effects
cardiac function primarily from pressure-mediated decreases in cardiac
function. In addition, due to the pressure changes that develop in the
abdominal and thoracic cavities, traditional measurements of fluid
resuscitation status (central venous pressure - CVP and pulmonary artery
occlusion pressure - PAOP or wedge pressure) can be misleading. Failure to
recognize that these traditional measurements are misleading can lead to under
resuscitation, persistent global ischemia and worse patient outcomes. The
following paragraphs provide more detailed information into the impact of
elevated intra-abdominal pressure on cardiac function.
Elevated intra-abdominal pressure - impact on
cardiac physiology:
Preload:
Elevated intra-abdominal pressure causes dPHIAragmatic elevation resulting in
direct compression and reduction of volume within the thoracic cavity. This
compression, in combination with positive pressure mechanical ventilation,
leads to elevations in intra-thoracic pressure (ITP). Elevated ITP, in turn,
impedes blood flow from the inferior vena cava to the thoracic cavity.[1, 2]
Blood flow is further reduced by direct dPHIAragmatic compression of the IVC as
it enters the thorax, and by venous compression and blood flow restriction
within the abdominal cavity.[3] In addition, the compression of the venous
system within the abdominal cavity results in blood pooling in the pelvis and
lower extremities further reducing venous return to the heart.[4, 5] The end
result is a dramatic drop in preload with a resultant drop in cardiac
output.[2, 6] These effects are especially pronounced in patients who are
hypovolemic. Fortunately, these adverse effects are responsive to volume
loading, making maintenance of adequate intravascular volume critical to
maintaining cardiac output. However, the elevated pressures causing this
cardiac compromise also results in misleading measurements of pressures
traditionally used to determine adequacy of volume resuscitation - central
venous pressure (CVP) and pulmonary artery occlusion pressure (PAOP or wedge
pressure). For further information of these measurements please see HIA and
Hemodynamic Monitoring Errors.
Cardiac contractility:
Compression of the lungs by the dPHIAragms combined with elevation of
intra-thoracic pressure causes increases in pulmonary vascular resistance and
reduction in vascular return to the left heart. The resulting pulmonary
hypertension causes right ventricular dilation, leftward ventricular septal
bulging, higher right ventricular wall tension and increased right ventricular
work. The result is both higher right ventricular oxygen demand and lower left
ventricular cardiac output leading to reduced coronary blood flow and possibly
subendocardial ischemia - further reducing cardiac function in a vicious
cycle.[7, 8]
Afterload:
Reduced cardiac output leads to increased systemic vascular resistance as the
body attempts to maintain a stable blood pressure. This leads to an increase in
cardiac work while simultaneously leading to reduction of blood flow to the gut
- which in turn causes further ischemia and capillary leakage, further
increases in intra-abdominal pressure and further exacerbation of cardiac
dysfunction.[9-11]
Hemodynamic Monitoring:
Traditional intra-cardiac filling pressures such as central venous pressure
(CVP) and pulmonary artery wedge pressure (PCWP or PAOP) are directly impacted
by the pressure within the thoracic cavity.[2, 12-15] Because intra-thoracic
pressure is elevated in patients who are suffering from intra-abdominal
hypertension and in patients on mechanical ventilation with positive
end-expiratory pressure, these traditional pressure-based measurements tend to
be erroneously elevated and are not reflective of intravascular volume status.
In many situations, patients with elevated CVP and PCWP are still fluid under
resuscitated and will response to fluid loading with increases in cardiac output
and improvement in organ perfusion.
In contrast, right ventricular end-diastolic
volume index (RVEDVI) and/or global end-diastolic volume index (GEDVI) -
volumetric measurements rather than a pressure-based measurements -can
accurately predict preload status and are a useful indicators of volume status.
A number of studies have noted direct correlations with RVEDVI and patient
outcome, noting that patients with higher RVEDVI (>110 to 133 mL/m2) had
reduced incidence of MODS and lower mortality than those who had lower
volumetric indices.[13, 16]
Summary:
Intra-abdominal hypertension and the resulting elevations in intra-thoracic
pressure lead to substantial cardiovascular dysfunction. Most of these adverse
effects will respond to fluid resuscitation, but these fluids will also lead to
increased edema and may exacerbate intra-abdominal hypertension. Eventually,
the only solution to the vicious cycle may be the need for decompressive
laparotomy. In patients with limited cardiopulmonary reserve, early decompression
should be considered. Traditional pressure based measurements of vascular
volume status such as CVP and PCWP are erroneously elevated and do not reflect
the patients volume status. Volumetric measurements such as RVEDVI and GEDVI
should be used instead to determine the point when fluid resuscitation
endpoints are met.
Overview:
Intra-abdominal pressure and associated hemodynamic monitoring errors
Critically ill patients who have their
cardiopulmonary function optimized have reduced organ failure, reduced
mortality and improved outcomes.[2-4] However, elevated intra-abdominal
pressure substantially effects the cardiopulmonary system and may impact the
clinicians ability to optimize function. Elevated intra-abdominal pressure
causes dPHIAragm elevation with resulting reduction in intra-thoracic volume
and increase in intrathoracic pressure. Simultaneously HIA causes vena-caval
compression, pooling of blood in the pelvis and legs, restriction of flow into
the chest and a dramatic drop in venous blood flow to the heart.[5-10] The end
result is decreased stroke volume and cardiac output. This effect is especially
pronounced in the hypovolemic patient, making hemodynamic monitoring
particularly important in these patients to ensure they are not fluid under
resuscitated. [7, 11]
In an attempt to optimize cardiopulmonary
function, many critically ill patients undergo some form of hemodynamic
monitoring. Central venous pressure (CVP) and pulmonary artery occlusion
pressure (PAOP or wedge pressure) are two hemodynamic parameters commonly used
to optimize care through their ability to assess fluid status, guide fluid
resuscitation and to determine when to use vasopressors or diuretics. What is
often not recognized is that these two hemodynamic measurements are
dramatically effected by outside influences (mechanical ventilation and
intra-abdominal pressure) that effect intra-thoracic pressure.[7, 9, 12-14]
(See the attached figures, which graphically demonstrate the effect of elevated
PIA on CVP and wedge measurements.) The result is a 'false elevation'
of CVP and PAOP that does not reflect actual volume status and may lead to
fluid under-resuscitation. In actuality, patients with intra-abdominal
hypertension will have elevated CVP and PAOP measurements despite substantial
reductions in venous return to the heart and cardiac output.[13, 15-17] In many
situations, patients suffering intra-abdominal hypertension will respond to
fluid loading with increases in cardiac output and improvement in organ
perfusion despite elevated CVP and PAOP.[13, 16]
In an attempt to improve the interpretation of
CVP and PAOP data, Malbrain evaluated a number of formulas to correct for these
erroneous elevations and concluded that a simple calculation will allow better
estimates of transmural filling pressure.[18]
CVPcorrected = CVPmeasured - PIA/2
PAOPcorrected = PAOPmeasured - PIA/2
Summary:
Optimizing cardiopulmonary function is
important to improve critically ill patient outcomes. CVP and PAOP are
parameters commonly used to guide therapy in critically ill patients. However,
these two pressure measurements are erroneously elevated in the setting of
intra-abdominal hypertension. Failure to recognize these erroneous elevations
may lead to inPPAropriate treatment and increased morbidity and mortality. By
monitoring PIA and correcting for its impact on CVP and PAOP, clinicians will
be better able to optimize the cardiopulmonary status of their patients.
Figure 1: Effect of PIA elevation on CVP &
PIC
This figure from Citerio el al demonstrates
the direct correlation between PIA and multiple other physiologic pressure
measurements.[19] As demonstrated in the graph, PIA elevation leads to
immediate (in seconds) and significant increases in PIC, IJP and CVP due to
direct transmission of the PIA into the thorax and the central veins
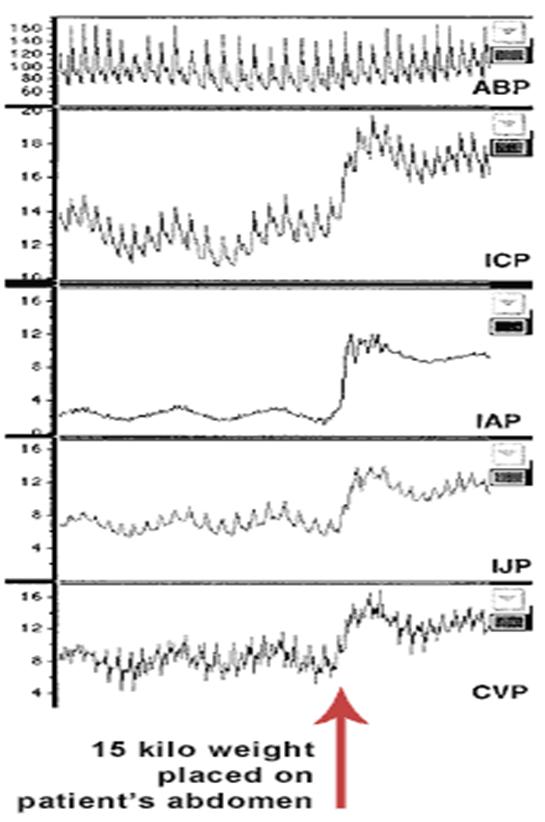
For those clinicians who base fluid resuscitation and preload assessment on CVP
(or on wedge pressures) this diagram graphically demonstrates that PIA causes a
direct, non-fluid related increase in CVP - in effect a 'false
elevation' of the central venous pressure that has nothing to do with
preload. Interpretation and use of CVP measurements without concomitant PIA
data to correct for this false elevation may cause clinicians to misinterpret
cardiac pressure data. It is not uncommon to see a very high CVP and PAOP
(wedge) with poor cardiac index and suspect heart failure, when in fact these
cardiac measurements are all a result of PIA elevation that has caused severe
reduction in venous return to the heart with simultaneous elevations in
intrathoracic pressure. In this setting, an echocardiogram of the heart will
demonstrate an actively contracting left ventricle (i.e. not a failing heart)
that simply cannot fill due to venous obstruction from the elevated PIA.
Failure to recognize these PIA induced pathophysiologic changes may lead to
treating the patient for heart failure rather than treating the cause of the
problem - elevated intra-abdominal pressure.
Figure 2: 
|
Figure:
Effect of rising PIA on wedge pressure (PAOP) measurement and cardiac index
As intra-abdominal
pressure increases, there is a corresponding increase in
intra-thoracis/pleural pressure and simultaneous increase in measured wedge
pressure. However, despite an increasing wedge pressure, the cardiac index
drops precipitously due to both reduced return of venous blood to the the
heart and increased workload/reduced stroke volume due to the higher
intra-thoracic pressure. (Diagram from Ridings, et al, Surg Forum
1994;45:74-76.)[1]
|
Pulmonary
impact of intra-abdominal hypertension and abdominal compartment syndrome
HIA and pulmonary mechanics:
The early effects of HIA on pulmonary function are largely mechanical. As
intra-abdominal pressure increases, it pushes the dPHIAragms cephlad. This
results in reduced intra-thoracic volume (reduced functional residual capacity,
total lung capacity and residual volume), reduced chest wall compliance and
increased intra-pleural pressure. Simultaneously there is alveolar collapse due
to the smaller intra-thoracic space and the higher intra-thoracic pressure.[1]
This leads to ventilation-perfusion mismatching, hypoxia, hypercarbia and
respiratory acidosis. To maintain ventilation, airway pressures must be
increased and high peak airway and plateau pressures are often generated. The
combination of elevated intrathoracic pressure and hypoxic pulmonary
vasoconstriction can lead to pulmonary hypertension.[2]
ACS and ARDS:
Elevated intra-abdominal pressure initially causes direct mechanical pulmonary
problems as described above. However, as the pressure remains elevated and
ischemic injury progresses, inflammatory mediators are released from the gut.
These inflammatory mediators cause pulmonary capillary damage leading to
interstitial edema and an ARDS like syndrome.[1]
The ARDS that evolves as the result of ACS is
a combination of alveolar collapse, high intra-thoracic pressure and
interstitial edema. Ventilatory strategies such as PEEP, inspiratory
recruitment and prone positioning more effectively improve respiratory
mechanics, alveolar recruitment and gas exchange in these patients than in
those with direct pulmonary injury.[1]
Summary:
In summary, elevated intra-abdominal pressure causes direct mechanical effects
on the lung, which result in reduced intra-thoracic volume and elevated
intra-thoracic pressure. This results in reduced blood return to the heart and
decreased cardiac output due to the pressure effect on preload. It also may
result in hypoxia, hypercarbia, elevated peak inspiratory pressures and
pulmonary barotrauma. Eventually, the ischemia that develops due to hypoxia and
reduced cardiac output may cause inflammatory mediator release, which can cause
an ARDS syndrome to occur.
Intra-abdominal
hypertension and renal function
Renal dysfunction due to elevated
intra-abdominal pressure is well described in the literature. Oliguria is seen
at intra-abdominal pressures over 15 to 20 mm Hg and anuria is common once
pressures exceed 25-30 mm Hg.
The causes of renal dysfunction are likely
multifactorial: reduced cardiac output, increased renal vascular resistance,
increased glomerular filtration gradient.
Renal arterial flow is decreased for several
reasons. First of all, the reduction in cardiac output seen due to cardiovascular
effects of HIA lead to increases in systemic vascular resistance and vasoconstriction
of the arterial tree including the renal artery. There may also be some direct
renal artery compression from the elevated PIA. Arterial blood flow is further
exacerbated by humeral factors such as increased antidiuretic hormone and
increased plasma renin and aldosterone activity. Venous drainage is also
impeded by HIA. Elevated intra-abdominal pressures cause direct compression of
the renal veins leading to reduction of venous drainage and renal congestion.
The combination of renal congestion, direct
renal compression and reduced arterial blood flow to the kidneys probably lead
to a reduction in the renal filtration gradient. The filtration gradient is the
mechanical force across the glomerulus that drives renal function. Filtration
gradient (FG) equals glomerular filtration pressure minus proximal tubular
pressure.[1] When PIA is elevated, proximal tubular pressure is essentially the
same as intra-abdominal pressure and glomerular filtration pressure is the
difference between PAM and PIA. So Filtration gradient = PAM-(2 x PIA).
Therefore, changes in PIA will have a more profound effect on urine formation
than will changes in arterial pressure.[1]
Sugrue, et al, demonstrated the importance of PIA
as a predictor of renal impairment.[1] These authors prospectively studied 263
ICU patients and found intra-abdominal pressure to be an independent predictor
of renal impairment. In this study, 40% of patients developed HIA (PIA >18
mm Hg) and one third of these developed renal impairment (compared to one
eighth of patients with lower PIA, p=0.004). They also noted a lag time between
development of elevated HIA and renal impairment suggesting that the effect on
renal function is gradual rather than immediate. Although not addressed in this
study, multiple other studies have demonstrated immediate improvement in renal
function once HIA is lowered.
In summary, HIA is a proven contributor to
renal impairment in critically ill patients. It occurs gradually and responds
to interventions that reduce PIA. The cause is multifactorial, but PPAears to
be due to a combination of reduced renal blood flow, increased renal
parenchymal pressure (impeding glomerular filtration) and hormonal changes
induced by intra-abdominal hypertension.
Intra-abdominal
pressure and the gut
The effect of elevated intra-abdominal
pressure has direct impact on gut and liver physiology. Numerous events are
occurring simultaneously:
Direct compression of mesenteric and hepatic
capillaries leading to reduced tissue flow.[1, 2]
Direct compression of mesenteric, vena caval
and portal veins leading to venous congestion, edema and worsened PIA.[1-3]
Reduced cardiac output (see cardiovascular
physiology) and increased afterload further exacerbating arterial flow.
Reduced oxygenation (see pulmonary physiology)
further exacerbating tissue ischemia.
Elevated PIA results in tissue ischemia
throughout the abdominal cavity, affecting all organs (except perhaps the
adrenal gland). These events begin with pressures as low as 8 to 12 mm Hg.[1,
4] The process is a vicious cycle - as the pressure increases, venous
congestion increases and arterial blood flow drops leading to tissue ischemia.
Ischemia leads to further capillary leak and cellular damage, which causes more
edema. Increasing edema results in further increases in intra-abdominal
pressure and a self-perpetuating condition of ischemia, capillary leak and
increased pressure.
As the gut becomes increasingly more hypoxic,
inflammatory mediators are released and bacterial translocation occurs. These
events may lead to sepsis and multiple organ dysfunction syndromes.[5] Hypoxia
and congestion of the liver also result in reduced clotting factor production
and coagulopathies may develop.[3] Finally, as the abdominal wall tension
increases, blood flow decreases and significant problems may occur with wound
healing.[6]
In summary, elevated intra-abdominal pressure
leads a vicious cycle of ischemia, inflammation, bacterial translocation and
additional edema with resultant worsening abdominal hypertension. The end
result is multiple organ failure and possibly death.
Intraabdominal
pressure effects on the brain
Interestingly, intra-abdominal hypertension
impacts intra-cranial pressure. In fact, HIA is an independent risk factor for
secondary brain injury after traumatic brain injury.[1] The physiology is
fairly straight forward: As intra-abdominal pressure goes up, it pushes up the
dPHIAragms, reducing intra-thoracic volume and causing elevated intrathoracic
pressure. Elevated intra-thoracic pressure results in elevated central venous
pressure and subsequent elevated internal jugular venous pressure. The result
is a functional obstruction of cerebral venous outflow, resulting in increases
in intra-cranial pressure and reduction in cerebral perfusion pressure.[2, 3]
Citerio et al graphically demonstrated the direct correlation between HIA and PIC
in a clinical setting.[2] They found that artificially induced PIA elevation
led to immediate (in seconds) and significant increases in PIC, internal
jugular pressure and central venous pressure (See figure). The impact of HIA on
PIC has implications in trauma surgery since any use of laparoscopic techniques
leads to substantial elevations in HIA and may cause further CNS ischemia.[4,
5]
Figure: Effect of PIA elevation on PIC and CVP
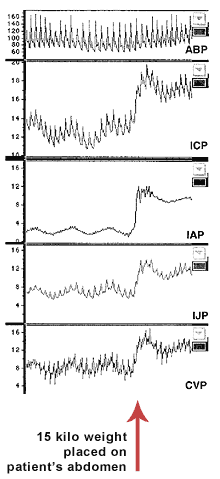
This figure from Citerio el al demonstrates
the direct correlation between PIA and multiple other pressure measurements.[2]
As demonstrated in the graph, PIA elevation leads to immediate (in seconds) and
significant increases in PIC, IJP and CVP due to direct transmission of the PIA
into the thorax, the central veins and the jugular veins. The result is venous
outflow obstruction from the brain and concomitant elevations of PIC.
Another interesting insight from this data is
the direct and immediate impact PIA has on CVP. For those clinicians who base
fluid resuscitation and preload assessment on CVP (or on wedge pressures) this
diagram graphically demonstrates that PIA causes a direct, non-fluid related
increase in CVP - in effect a 'false elevation' of the central venous
pressure that has nothing to do with preload. Interpretation and use of CVP
measurements without concomitant PIA data to correct for this false elevation
may cause clinicians to misinterpret cardiac pressure data. It is not uncommon
to see a very high CVP and PAOP (wedge) with poor cardiac index and suspect
heart failure, when in fact these cardiac measurements are all a result of PIA
elevation that has caused severe reduction in venous return to the heart with
simultaneous elevations in intrathoracic pressure. In this setting, an
echocardiogram of the heart will demonstrate an actively contracting left
ventricle (i.e. not a failing heart) that simply cannot fill due to venous
obstruction from the elevated PIA. Failure to recognize these PIA induced
pathophysiologic changes may lead to treating the patient for heart failure
rather than treating the cause of the problem - elevated intra-abdominal
pressure.
HIA
and Pancreatitis
Pancreatitis may be the ultimate medical
disease to cause intra-abdominal hypertension. It involves both of the major
processes that can cause HIA - direct injury to the peritoneal or retroperitoneal
space and a massive systemic inflammatory response syndrome. Initially, severe
acute pancreatitis causes inflammation and fluid sequestration in the
retroperitoneal space leading to local vascular permeability and edema
formation. As this progresses, pro-inflammatory cytokines are released and a
systemic inflammatory response occurs, leading to system wide vascular leak
with massive amounts of fluid sequestration in the mesentery and bowel wall.
The current estimate of the prevalence of intra-abdominal hypertension in
severe acute pancreatitis is about 40%, with about 10% overall developing
abdominal compartment syndrome.[1] In addition, multiple organ dysfunction, ICU
length of stay and mortality are all significantly increased in those pancreatitis
patients who develop HIA.[1, 2]
Treatment of HIA in pancreatitis is dependent
first on early detection. Numerous authors strongly emphasize the need to
monitor PIA in all severe pancreatitis patients to allow early detection and
early intervention to reduce intra-abdominal pressure.[2-4] Once HIA is
detected an established treatment algorithm should be used to guide therapy
based on the pressure and the unique characteristics of the patient (see
treatment algorithm provided on this web site). Specific therapies found to be
helpful in pancreatis include percutaneous drainage of any fluid pocket present
in the retroperitoneal space[5], early hemofiltration to remove
pro-inflammatory cytokines as well as excess interstitial fluid[6, 7] and
decompressive laparotomy without pancreatic exploration when ACS developes.[1,
3, 4, 8]
Sepsis,
Intra-abdominal hypertension and intra-abdominal pressure monitoring : Emerging
evidence for bundling treatment modalities
An emerging body of evidence demonstrates a high
prevalence of intra-abdominal hypertension (HIA) following resuscitation of
septic patients.[1-3] Recently presented data at the Amsterdam European Society
of Intensive Care Medicine (Sept 2005) showed HIA and ACS were at least if not
more prevalent in septic patients than in surgical patients.[1, 2] Efstathiou
et al investigated the prevalence of this syndrome in their mixed ICU. They
found intra-abdominal hypertension (define as PIA>12 mm Hg) present in52% of
septic medical patients and 67% of septic surgical patients.[1] The abdominal
compartment syndrome (defined as PIA>20 mm Hg with organ dysfunction) was
present in 1 out of 10 medical sepsis cases and 1 out of 25 surgical cases (see
table). They found 5 liters of fluid resuscitation to be a major risk factor
for elevated PIA. They also found that gut emptying, neuromuscular blockade and
hemofiltration were effective in lowering PIA. They conclude that noninvasive
interventions can be effective, and that PIA measurement may be a good marker
of extravascular volume and fluid resuscitation.
Efstathiou data:
|
PIA (mm Hg)
|
Medical Admissions (%)
|
Surgical Admissions (%)
|
Total (%)
|
|
> 12
|
|
|
|
|
> 15
|
|
|
|
|
>20
|
|
|
|
Hernandez investigated an even higher risk
population of septic patients -- those suffering from septic shock.[2] These
authors recognize that HIA contributes to splanchnic hypoperfusion and multiple
organ failure, and that HIA is related to vascular permeability problems that
abound in patients with the microcirculatory problems seen in septic shock.
They conducted a study investigating the incidence of HIA in patients with
septic shock versus critically ill post-operative abdominal surgical cases.
Their results demonstrated a 52% incidence of intra-abdominal pressure over 20
mm Hg for 6 hours or longer in septic shock patients, versus 31% in abdominal
surgery patients. In addition, they found markedly higher lactate levels in the
group that developed intra-abdominal hypertension. Both the Efstathiou and the
Hernandez studies suggest that septic patients are at considerable risk for
developing hypoperfusion, lactic acidosis and organ dysfunction partially
related to elevated intra-abdominal pressure. Additional evidence notes
improved patient outcomes when early detection and early intervention for HIA
is implemented.[4-6] The combination of this prevalence data and outcome data
suggests that more attention should be paid to PIA in the setting of sepsis
resuscitation. Currently there is a worldwide focus on improving survival in
septic patients, with the concept of 'treatment bundling' to further
improve outcomes. Since HIA commonly occurs in critically ill septic
patients[1, 2] and HIA is associated with an increase in ICU mortality[7],
simple interventions to reduce intra-abdominal pressure may further improve
outcomes in septic patients and should be considered in sepsis bundles. The
evidence that suggests these two syndromes are inter-related and that treatment
interventions bundling may be helpful are listed here:
Severe sepsis causes a massive immune
inflammatory response with cytokine release leading to the systemic
inflammatory response syndrome. This results in system wide capillary leak,
hypovolemia, ischemia and eventually organ failure and death if untreated.
Intra-abdominal hypertension is directly
caused by a capillary leak phenomenon occurring in the vascular bed of the GI
tract (the ARDS of the abdomen). Elevated intra-abdominal pressure causes
multiple organ dysfunction as a result of both direct mechanical compression of
tissue as well as further release of inflammatory mediators from the edematous
bowel. The pathophysiology of this process mimics and may be confused with
and/or caused by sepsis.[8]
Despite initial data in the trauma literature,
HIA is not just a traumatic disease, it is a critical care disease and is just
as common in MICU patients as in trauma and surgical patients.[1-3, 9]
Surviving sepsis using early goal directed
therapy (EGDT) depends in part on early fluid resuscitation to replenish capillary
leak induced hypovolemia, followed by inotropic and/or vasopressor support to
preserve essential organ blood flow.[10]
CVP is the primary measurement used in EGDT to
assess fluid status and help determine when to continue fluid resuscitation
versus begin inotropic support.[10]
Intra-abdominal hypertension causes erroneous
elevations in CVP that may lead to inadequate fluid resuscitation unless the
intra-abdominal pressure is known and the CVP is corrected for that
pressure.[11-15]
Intra-abdominal hypertension is very common in
MICU patients who are over 5 liters positive in their fluid status.[1, 9, 16]
Intra-abdominal hypertension is very common in
severely septic patients who have undergone fluid resuscitation.[1, 2]
Mild to moderate intra-abdominal hypertension
(stage I-III) is associated with increased length of stay, morbidity, and
mortality in the ICU.[7, 16-19]
Mild to moderate intra-abdominal hypertension
is amenable to medical treatment modalities that reduce intra-abdominal
pressure.[4, 20, 21] Surgical intervention for the end stage process of
intra-abdominal hypertension (i.e. the abdominal compartment syndrome) also
reduces morbidity and mortality.[5, 6, 22, 23]
Monitoring of high-risk patients allows
clinicians to detect HIA early and intervene before organ failure or abdominal
compartment syndrome occurs. In small series these interventions reduce both
morbidity and mortality.[4, 5, 20, 21]
Currently, most ICU's rarely monitor
intra-abdominal pressure despite a number of large studies demonstrating the
high prevalence of HIA.[3, 24] In addition, most clinicians who have some
insight into this syndrome consider it to be a problem associated with trauma
patients. Finally, very few clinicians are even aware of medical interventions
that can be implemented early in the process to prevent progression to end
stage disease where emergent surgical intervention is the only option. The
literature is now compelling enough to suggest it is time to prospectively look
into bundling HIA monitoring and interventions along with other standardized
care in critically ill septic patients, pancreatitis patients, liver failure
patients, etc.
Intra-abdominal
hypertension in pediatrics
How common is HIA and ACS in pediatrics:
Compared to the adult literature, relatively
little research has been published regarding intra-abdominal hypertension in
critically ill children. In 2001 an article by Beck et al suggested full blown
abdominal compartment syndrome (elevated PIA plus organ failure) it was
extremely rare, occurring in less than 1% of pediatric ICU admissions.[1]
However, the authors did note that progression to ACS carried a 60% mortality
rate, that abdominal compartment syndrome occurred at intra-abdominal pressures
as low as 15 mm Hg, and that the syndrome existed in a broad array of medical
and surgical patients, not just trauma patients. In contrast to Beck's data, a
prospective study presented at the society of critical care medicine in January
2006 suggested a dramatically higher incidence of ACS. Ejike et al found ACS to
be present in 17.6% of ventilated PICU patients (they were only able to consent
1/3 of patients to enter the study, but even those who they had no clinical
suspicion carried a 22% incidence of HIA and 7% of them progressed to ACS).[2]
Those with ACS had a significantly higher mortality (33.3%) and length of stay
(13 d) than those without ACS (2.4% mortality, 6 day LOS). Both of these
studies as well as numerous other case series demonstrate this syndrome is not
confined to trauma patients. It is ubiquitous to critically ill patients and
occurs in children with many conditions including sepsis, Wilms tumor,
perforated bowel, necrotizing enterocolitis, intussusception, meningococcemia
and gastroschisis.[1, 3-5]
How much saline should be infused into a
child's bladder to obtain an adequate pressure measurement?
Accurate pressure transduction requires a
small pocket of fluid within a cavity connected via a continuous column of
fluid to the transducer. (See 'Volume of infusion' discussion and
diagram on this web site). The size of this pocket can be small as long as that
fluid pocket is equilibrated with the pressure in the cavity being measured.
When using the bladder to reflect pressure within the abdomen there needs to be
some fluid to passively transmit intra-abdominal pressure, but not too much
fluid. If the bladder is overdistended, the bladder wall begins to stretch and
pressure measurements will rise to reflect bladder wall compliance, not
intra-abdominal pressure. Two investigators have conducted research in
pediatric ICU's to determine the optimal volume of infusion to accurately
transduce intra-abdominal pressure. Davis et al compared intra-abdominal
pressure measured via a peritoneal dialysis catheter (gold standard) against PIA
measured via the stomach and via the bladder using infusion volumes of 0, 1, 3
and 5 ml/kg. He found 1 ml/kg infused into the bladder to be the most accurate,
while smaller or larger volumes were less accurate as was any volume infused
when measuring gastric pressure.[6] Ejike measured bladder compliance curves in
children by infusing increasing volumes and measuring each pressure obtained
with that volume.[7] She found that optimal volumes ranged from 6 ml to 25 ml
in children between 3 kg and 50 kg. She concluded that 6 ml was enough in all
situations and one never needed more than 20-25 ml in any child to obtain
accurate PIA transduction via the bladder. Therefor, these two studies suggest
that one can either use 1 ml/kg (not ever needing more than 20-25 ml) or just
use 6 ml infusion volume in pediatric patients to obtain accurate pressure
transduction.
HIA
and ACS: Available interventions
Prevention: Careful fluid management
The best treatment for ACS is prevention. The
key to prevention is to recognize patients who are at risk (SIRS, sepsis,
ischemia/reperfusion injury followed by large volume resuscitation, major
intra-abdominal problem such as trauma, surgery or obstruction), monitor them
carefully and intervene prior to end stage complications. Many articles support
this PPAroach.[1-6]
The first step is careful fluid management.
Under-resuscitation will lead to organ ischemia, increased capillary leak,
tissue edema and further elevation of PIA. If the patient is under
resuscitated, fluid loading to increase blood flow to the gut and inotropic
support to increase cardiac output should begin.[7] Ironically these same
methods intended to improve intestinal perfusion may in fact exacerbate ACS
through increasing the rate of extravasation of fluid into the abdominal
viscera. Therefor over-resuscitation, must be carefully avoided.[8] This fine
balance between under and over resuscitation makes assessment of fluid status a
critical part of management of patients at risk for ACS and it is complicated
by misleading information obtained from fluid status evaluations based on
pressure measurements (CVP and PAOP - wedge: See cardiovascular physiology).
Interventions:
Intra-abdominal hypertension -- Treatment
options
Given the past focus on the end stage process
- the abdominal compartment syndrome - most treatment discussions have
emphasized emergent surgical decompression. Based on other commonly treated
full blown compartment syndromes - intracranial (epidural or subdural
hematoma), thoracic (tension pneumothorax), pericardial (cardiac tamponade),
and extremity - all true compartment syndromes are surgical diseases requiring
emergent surgical interventions as soon as possible to prevent permanent tissue
damage or death. True abdominal compartment syndrome is no different. Failure
to provide emergent surgical decompression leads to prolonged severe mesenteric
ischemia as well as multiple organ hypoperfusion with its attendant high
morbidity and mortality.
On the other hand, intra-abdominal
hypertension detected early is amenable to non-surgical interventions. By
implementing these options early, abdominal compartment syndrome can be
prevented in many patients. To accomplish this, intra-abdominal hypertension
must be detected before clinical signs of the abdominal compartment syndrome
develop. Newer evidence suggests that intra-abdominal pressure measurements
done every one to two hours are necessary to establish a trend and avoid
missing a rapid increase in pressure.[9, 10] ICU's should implement effective,
reproducible methods for accomplishing this task. Several companies now
manufacture devices that allow noninvasive, rapid and reliable PIA monitoring
to occur with little nursing effort. All these devices use either bladder
pressure or intra-gastric pressure as surrogates for intra-abdominal pressure.
These commercially available systems are the AbViser (www.wolfetory.com), the
Foley Manometer (www.holtech-medical.com), the PIA-Monitor
(www.spiegelberg.de), and the CiMON (www.pulsion.com).
Once PIA pressures are obtained and a trend is
established, treatment options will depend on patient characteristics as well
and pressure levels (See treatment algorithm). The first intervention necessary
for intra-abdominal hypertension is to ensure optimal fluid resuscitation.[11]
Over resuscitation may cause increased edema, while under resuscitation causes
prolonged ischemia which worsens capillary leak problems. The complex
interactions of intra-abdominal, intrathoracic and intravascular pressures make
accurate volume assessment using CVP and PAOP somewhat difficult. End-diastolic
volumetric indices and/or echocardiographic indices will improve clinician's
ability to interpret vascular filling. If these are not available, PIA values
can be used to correct standard CVP and PAOP measurements to obtain a more
accurate reflection of volume status (see correction formula in HIA and
hemodynamic monitoring errors section).
Following PPAropriate volume resuscitation,
abdominal blood flow show be optimized.[12] This is reflected in the concept of
abdominal perfusion pressure (PPA). The concept is essentially identical to
that related to cerebral perfusion pressure. Tissue blood flow is directly
related to the mean arterial pressure delivered to the tissue (PAM) minus the
pressure within the abdominal compartment (PIA): PPA = PAM-PIA. Abdominal
perfusion pressure, which more accurately reflects actual tissue oxygen
delivery may be more predicative of patient outcome that the PIA measurement
alone.[12, 13] Once patients are adequately fluid resuscitated, inotropic
support to improve tissue blood delivery should be considered if abdominal
perfusion pressure is less than 60 mm Hg.[12]
Non-surgical options: Sedation and pain
control, gut emptying, paracentesis, neuromuscular blockade, continuous renal
replacement therapy, continuous negative abdominal pressure.
If intra-abdominal pressure continues to rise
despite optimization of fluid status and abdominal perfusion pressure, numerous
other interventions are available. These include sedation and pain control, gut
emptying, paracentesis, neuromuscular blockade, continuous renal replacement
therapy, and continuous negative abdominal pressure. Sedation and pain control
assist in reduction of PIA in any patient suffering from significant pain or
agitation. Most patients suffering a severe enough illness to develop HIA
should be sedated and pain should be carefully controlled. All patients with
rising PIA should also have nasogastric suction considered to remove all excess
air and fluid from the intestinal lumen. Simultaneously, stool and other
intraintestinal contents should be purged to create a larger volume for
expansion of bowel edema. This can be done with cathartics, enemas and rectal
tubes. Neuromuscular blockade may further relax the abdominal wall and improve
organ perfusion in those situations where sedation is inadequate.[14-17] It
works by giving total relaxation to the abdominal and thoracic wall musculature
and may buy time for the patient to begin mobilizing fluid. In many situations,
dramatic reductions in PIA with substantial increases in urine output and
reduction in total body edema are witnessed.[18] However, if capillary leak
continues this treatment effect may only have transient effects. Another
similar option for reducing PIA is via epidural analgesia. Hakobian and
colleagues performed a small study on 11 critically ill postoperative patients
where epidural analgesia was began when PIA exceeded 15 mm Hg.(personal
communication) They found a reduction in PIA from 15.7 mm Hg to 5.9 mm Hg one
hour after institution of epidural analgesia. There was no associated drop in PAM
that is often seen with epidural analgesia. They hypothesized that the absence
of hypotension and further hemodynamic compromise was due to a decrease of PIA
which in turn compensated for decreased preload secondary to medication induced
sympathectomy.
Patients with substantial SCAites or a large
retroperitoneal fluid collection are often amenable to percutaneous drainage of
that fluid with substantial reduction in PIA.[19-21] In fact, recent research
suggests even in the absence of visible SCAites, PIA can be reduced in high
risk patients with percutaneous catheter placement. In one small study n 8
patients, Reed et al were able to reduce PIA by 6 mm and increased abdominal
perfusion pressure by 16 mm Hg and PAM by 10 mm Hg within 30 minutes of
catheter placement in patients whose PIA crossed the 20 mm Hg threshold.[21]
Six of these patients did not require decompressive laparotomy, avoiding the
need to manage and open abdomen. Survival was 75% (3 of 4) in whom intervention
was done early. Paracentesis and drainage of any free fluid visible on
ultrasound can be very effective in the burn population as well as liver
failure patients and some pediatric cases.[17, 19, 20] It results in an
immediate reduction in abdominal contents with a corresponding drop in
intra-abdominal pressure as well as an improvement in physiologic parameters
such as urine output. Paracentesis often needs to be repeated to maintain a low
pressure - making PIA monitoring all that much more important to assist in
predicting when the procedure needs to be repeated.
Unfortunately, most patients with
intra-abdominal hypertension do not have fluid collections available for
drainage. Rather they have substantial interstitial edema present. This edema
can be reduced or avoided via two mechanisms in PPAropriate candidates- colloid
infusions and continuous hemofiltration. O'Mara et al found that colloid
resuscitation of patients at very high risk of intra-abdominal hypertension
(major burn patients) resulted in dramatic reductions in PIA and a trend
towards improved outcomes.[22] Oda et al, after substantial investigation into
the effects of cytokines on intra-abdominal hypertension, determined that continuous
hemofiltration was able to reduce cytokine blood levels as well as intersitial
fluid. They predicted that this in combination with colloid infusion to
maintain adequate intravascular volume could reduce progression of
intra-abdominal hypertension to abdominal compartment syndrome and improve
outcome in severe pancreatitis. In a prospective study, they began continuous
hemofiltration on all severe pancreatitis patients with PIA of 15 mm Hg or
higher.[6] Using this protocol on 17 patients, they successfully reduced
cytokine levels and PIA levels (from 15 mm Hg to less than 10) in all their
severe acute pancreatitis cases - reducing their historical mortality from 40%
down to 6%. Other recently presented abstracts confirm the survival benefits
seen with hemofiltration in both pancreatitis cases as well as in patients
suffering from severe sepsis.[23-25] Hernandez, et al, who demonstrated a 51%
incidence of HIA/ACS in septic shock patients[26] also found that
implementation of hemofiltration in hemodynamically unstable sepsis patients
failing all other therapy resulted in a dramatic reduction in mortality in
those that responded (mortality 21% in rsponders versus 83% in
non-responders).[24] Picinni et al, also found a survival advantage to early
hemofiltration in septic shock patients, demonstrating a survival improvement
and reduced ICU length of stay in those who underwent hemofiltration compared
to those who did not (55% survival versus 27.5% survival, LOS 9 days versus 16
days).[25] Clearly, medical interventions for intra-abdominal hypertension
exist and early research into their efficacy PPAears very promising. Larger
prospective studies will hopefully be conducted to improve our understanding of
these interventions.
Continuous negative abdominal pressure devices
have been tested on small groups of patients and are effective at reducing
intra-abdominal pressure.[27, 28] However, in their current designs they are
not practical for everyday ICU PPAlication and further research is needed to
ensure they do not cause injury to the abdominal wall and to determine whether
they improve physiologic parameters.
Surgical options: Decompressive laparotomy
When all else fails and patients progress from
intra-abdominal hypertension to the abdominal compartment syndrome, the patient
has progressed from an urgent medical process to a surgical emergency.[29]
These patients are suffering from end stage tissue ischemia that has progressed
to severe cellular dysfunction with impending cell death. The most PPAropriate
treatment is emergent surgical decompression.[29] Waiting just a few hours will
lead to higher incidence of dead bowel and higher mortality. The exact pressure
at which abdominal decompression should occur is dependent on a number of host
factors including age, underlying co-morbidities and physiologic evidence of
developing ACS. With the exception of very high intra-abdominal pressures there
are no established guidelines where a definite intervention is necessary. Many
experts recommend that the entire clinical picture must be taken into account
and one specific pressure cutoff cannot be used.[5, 30] However, since several
experts note improved outcomes with decompression at lower pressures, if there
is any question it is probably best to err on the side of early
decompression.[3, 5, 31]
In the case of trauma laparotomies --
especially after damage control surgery where the patient has had substantial
fluid resuscitation, the surgeon should probably just leave the abdomen open.
While this results in a reduced risk of ACS, it is not a guarantee. Gracias et
al found 25% of surgical patients with their abdomens left open after trauma
laparotomies still developed ACS within a relatively short time period.[32]
They point out that this complication occurs because no abdomen is truly "open"
since all have some type of a dressing. Those patients who developed ACS
despite an "open abdomen" did poorly: 60% mortality with ACS versus 7%
mortality if ACS did not occur. The authors use this data to emphasize the
importance of continued intra-abdominal pressure monitoring in all at risk
patients, including "open abdomens" because fluid can re-accumulate in the
space beneath the dressing and ACS can develop.
b.
Metode farmacologice si
chirurgicale utile in scaderea presiunii abdominale.
Referat 3
2
Multiple organ failure and intra-abdominal hypertension
Intra-abdominal hypertension leads to organ dysfunction via two distinct and
separate pathways. First, early on in the disease process there is a purely
mechanical effects that cause significant and measurable organ dysfunction
largely related to the effect of the elevated pressure on organ function and
organ perfusion (please see individual organ system discussions for further
detail). However, untreated HIA also causes immune and inflammatory effects
that can result in progressive organ failure. In fact, an emerging body of
experimental and clinical evidence suggests that untreated intra-abdominal
hypertension (HIA) acts as the second insult in the two-event model of multiple
organ failure (MOF).[1-8] The two-event model of multiple organ failure
postulates that an initial insult causing cellular ischemia primes the patients
immune system for an exaggerated response to any secondary insult.[9] This
'priming' occurs for a limited time - about 3-16 hours following the
initial insult - at which point the hyperresponsiveness of the immune system
begins to taper.[10, 11] Interestingly, the most common time for HIA to develop
is within an 8-16 hour time range following an initial tissue insult - the
exact period of maximal immune responsiveness.[1, 10, 11] Rezende-Neto el al
found that HIA causes elevated levels of pro-inflammatory cytokines (tumor
necrosis factor, and interleukins IL-6 and IL-1) as well a lung myeloperoxidase
(MPO) in an animal model.[2] They also found that the presence of HIA during
the 8-16 hour 'critical' time period resulted in a 3-fold increase in
inflammatory neutrophil expression.[3] However, animals subjected to HIA
insults < 2 hours or > 18 hours after initial insult fared much better.
These authors conclude that a vulnerable period exists following ischemic
injury and a second insult such as HIA causes a hyper-inflammatory immune
response leading to a high incidence of MOF and death.[3] Other investigators
have also found increases in inflammatory mediators as well as bacterial
translocation across the bowel wall during the ischemic insult that occurs
during from intra-abdominal pressure.[4-6, 12-15] These data suggest that
abdominal compartment syndrome is not the terminal event caused by refractory
shock/multiple organ failure. Instead, elevated intra-abdominal pressure acts
as a 'secondary insult' in the two-event model of multiple organ
failure, leading to an overly aggressive immune response with inflammatory
cytokine release.[1-8] The end result of this undetected and untreated
'secondary insult' is multiple organ failure.
Solutions proposed to reduce the incidence of MOF related to elevated
intra-abdominal pressures are several:
Optimizing crystalloid infusion to avoid
over-resuscitation and reduce the amount of capillary leak that occurs.[1,
16](See HIA algorithm in this web site for a multi-pronged PPAroach to managing
these patients. Also see cardiovascular physiology to understand some of the downfalls
associated with standard CVP and wedge pressure measurements in the face of HIA).
Further investigation into the role of
colloids, blood substitutes and hypertonic saline in this patient group since
there is evidence that these fluids reduce the hyper-inflammatory response.[1,
16-22]
Early recognition of intra-abdominal
hypertension through serial measurements of PIA (and perhaps pHi) with prompt
medical and/or surgical interventions to prevent the development of significant
mesenteric ischemia and the inflammatory cSCAade that accompanies this ischemia
Intra-abdominal
pressure and abdominal perfusion pressure
Although intra-abdominal pressure clearly
correlates with patient outcome, the PIA at which an individual patient
develops problems is highly variable and dependent upon a numerous factors
including patient comorbidities and mean arterial blood pressure. This insight
led to the concept of abdominal perfusion pressure as a better method to assess
end organ perfusion and resuscitation endpoints. The amount of blood flow (and
therefor oxygen delivery) delivered to intra-abdominal tissue is directly
impacted by both the pressure resisting flow (intra-abdominal pressure: PIA)
and the pressure head delivering that blood (mean arterial pressure: PAM). This
pressure is called Abdominal Perfusion Pressure: PPA (PAM - PIA = PPA).
Abdominal perfusion pressure is more predictive of survival than either PAM or PIA
according to several recent abstracts and published studies. [1, 2] In the
future, adequate PPA may be the primary endpoint that intensivists consider
during the management of patients suffering from intra-abdominal hypertension.
The concept of abdominal perfusion pressure is similar to the concept of
cerebral perfusion pressure that is used in neuro-critical care when monitoring
intracranial pressure. Because the brain is enclosed within a non-compliant
bony container (the skull), as the volume within the brain expands, the
pressure within the brain begins to increase. At a critical volume there is no
additional space and the pressure dramatically increases, leading to
significant tissue ischemia due to reduction in blood flow (see diagram of
Monro-Kellie Doctrine).
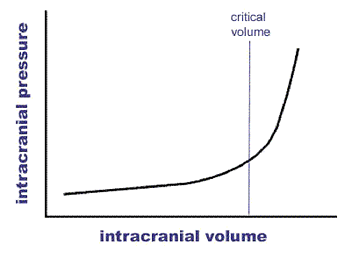
While the abdominal cavity is more compliant
than the skull, it is not freely compliant and becomes increasingly rigid as it
distends. At some point the compliance of the abdominal wall drops dramatically
and the pressure begins to increase precipitously in a similar fashion as that
shown in the Monro-Kellie diagram. At that point, abdominal perfusion pressure
drops dramatically and significantly worsening intra-abdominal organ ischemia
occurs. Attempts to maintain abdominal perfusion pressure and provide adequate
intra-abdominal organ blood flow are instrumental to improving patient
survival. [1] A management strategy that includes frequent PIA monitoring,
optimization of abdominal perfusion pressure (greater than 50 to 60 mm Hg
preferred) through careful fluid and vasopressor support, medical interventions
to reduce PIA, and immediate abdominal decompression should PIA continue to
rise or PPA remain inadequate is necessary to ensure optimal patient survival.
(See Management Algorithm for a graphic display of such a management method).
Utilizing an PPAroach like this, Cheatham et al were able to improve patient
outcomes - reducing the incidence of ACS from 64% to 43% and reducing patient
mortality from 44% to 28% in a high risk surgical population.[1]
What
is the proper amount of fluid to infuse into the urinary bladder to obtain
accurate pressure transduction measurements?
The volume of fluid infused into the urinary
bladder to obtain intra-abdominal pressure (PIA) measurements vary greatly in
the literature -- ranging from very small amounts (a few ml) to 250 ml or
greater. Several studies report that injecting over 50 ml of fluid into a
non-compliant bladder will result in distention and resistance to stretching of
the non-complaint bladder wall, resulting in an overestimation of the true
intra-abdominal pressure.[1, 2] Similarly, infusing very large volumes (250 ml
or more) into a compliant bladder will eventually result in intrinsic bladder
wall muscle contraction, again leading to overestimation of the true PIA.[3]
Malbrain et al, constructed bladder volume/pressure compliance curves on
several patients, elegantly demonstrating this phenomenon and noting that 50 ml
was a reasonable volume of infusion to obtain accurate pressure without causing
overestimation of PIA (see figure for an example).[3] Based on these studies,
most intuitions have reduced the volume of infusion to 50 ml in adult ICU
patients.
However, newer researchers suggest that even
50 ml can result in over-estimation of intra-abdominal pressure. DeWaele
hypothesized that bladders will become 'stiffer' or have less
compliance if a Foley catheter continuously drains them. He is concerned that
using 50 or 100 ml of saline will result in an overestimation of PIA in many
situations. To test his hypothesis he constructed bladder volume/pressure
compliance curves in 20 critically ill adult patients who had a Foley catheter
in for 5 days or longer.[4] He noted that a minimum volume of 10 ml was
required to get accurate pressure transduction, but that measured pressures
increased 21% when 50 ml was infused and increased by 40% when 100 ml was
infused. He concluded that 10-20 ml infusion volume was adequate, and that
higher volumes risked overestimation of the incidence of HIA and ACS. Kimball
and colleagues conducted a similar bladder volume/pressure compliance study in
all patients in their ICU who were undergoing PIA monitoring.[5] They found
volumes of 10-20 ml were adequate to obtain reproducible PIA measurements, and
that volumes over 30 ml resulted in higher values being measured (about 2 mm Hg
higher at 50 and 60 ml that at 10 or 20 ml).
Two investigators have conducted research in
pediatric ICU's to determine the optimal volume of infusion to accurately
transduce intra-abdominal pressure. Davis et al compared intra-abdominal
pressure measured via a peritoneal dialysis catheter (gold standard) against PIA
measured via the stomach and via the bladder using infusion volumes of 0, 1, 3
and 5 ml/kg. He found 1 ml/kg infused into the bladder to be the most accurate,
while smaller or larger volumes were less accurate as was any volume infused
when measuring gastric pressure.[6] Ejike measured bladder compliance curves in
children by infusing increasing volumes and measuring each pressure obtained
with that volume.[7] She found that optimal volumes ranged from 6 ml to 25 ml
in children between 3 kg and 50 kg. She concluded that 6 ml was enough in all
situations and one never needed more than 20-25 ml in any child to obtain
accurate PIA transduction via the bladder. Therefor, these two studies suggest
that one can either use 1 ml/kg (not ever needing more than 20-25 ml) or just
use 6 ml infusion volume in pediatric patients to obtain accurate pressure
transduction. It is also worthy to note that curves plotting intra-abdominal
pressure versus volume of infusion are effected by the baseline PIA: A patient
with a relatively low PIA will see minimal increases in PIA as increasing fluid
is infused into the bladder since the extra volume infused into the
bladder/abdominal compartment has little effect on the entire compartmental
pressure. However, a patient with very high PIA who has a very tight abdominal
compartment, will demonstrate more substantial increases in PIA as increasing
volume is infused into the bladder.[2]
Theoretically, all that is necessary to
accurately transduce PIA through the urinary bladder is a static fluid column
in the Foley and a very small amount of fluid within the bladder that is in
direct communication with the static fluid column in the Foley. It is PPAarent
now that infusion volumes of around 6-20 ml are sufficient to measure
meaningful PIA in children,[6, 7] and 10-20 ml are sufficient in adults.[4, 5]
Balough, et al, used this knowledge to design and conduct a study using a 3-way
Foley to continuously measure PIA.[8] Because of the unique properties of the
collapsible, complaint human bladder they were able to create a small pocket of
fluid at the tip of the Foley with a nearly static fluid column within the
flush lumen. They maintained this pocket of fluid through continuous infusion
of saline at 4 ml/hour via a standard arterial line set-up attached to a
specially modified 3-way Foley catheter. They proved the reliability of this
method by showing that the pressures measured continuously were essentially
identical to those recorded using the traditional method of PIA measurement
using a 50 ml saline infusion.
In summary, the amount of fluid needed to
accurately transduce bladder pressure through the Foley catheter in children is
6-10 ml (or 1 ml/kg) and in adults is 10-20 ml. On occasion, infusing more
volume than this risks overestimation of actual intra-abdominal pressure due to
compliance issues of the bladder wall.
HIA
and ACS: Available interventions
Prevention: Careful fluid management
The best treatment for ACS is prevention. The
key to prevention is to recognize patients who are at risk (SIRS,
ischemia/reperfusion injury followed by large volume resuscitation), monitor
them carefully and intervene prior to end stage complications. Many articles
support this PPAroach.[1-5]
The first step is careful fluid management.
Under-resuscitation will lead to organ ischemia, increased capillary leak,
tissue edema and further elevation of PIA. If the patient is under
resuscitated, fluid loading to increase blood flow to the gut and inotropic
support to increase cardiac output should begin.[6] Ironically these same
methods intended to improve intestinal perfusion may in fact exacerbate ACS
through increasing the rate of extravasation of fluid into the abdominal
viscera. Therefor over-resuscitation, must be carefully avoided.[7] This fine
balance between under and over resuscitation makes assessment of fluid status a
critical part of management of patients at risk for ACS and it is complicated
by misleading information obtained from fluid status evaluations based on
pressure measurements (CVP and PAOP -- wedge: See cardiovascular physiology).
Interventions:
Non-surgical options: Paracentesis, neuromuscular blockade, continuous
renal replacement therapy, continuous negative abdominal pressure, gut emptying
If the pressure rises despite careful fluid balancing, a number of potentially
effective interventions are available early in the course of care. These
include paracentesis, neuromuscular blockade, continuous renal replacement
therapy, continuous negative abdominal pressure and gut emptying. Paracentesis
and drainage of any free fluid visible on ultrasound can be very effective in
the burn population as well as liver failure patients and some pediatric
cases.[8-10] It results in an immediate reduction in abdominal contents with a
corresponding drop in intra-abdominal pressure as well as an improvement in
physiologic parameters such as urine output. Paracentesis often needs to be
repeated to maintain a low pressure -- making PIA monitoring all that much more
important to assist in predicting when the procedure needs to be repeated.
Neuromuscular blockade is also an option for
reducing intra-abdominal pressure.[9, 11, 12] It works by giving total
relaxation to the abdominal and thoracic wall musculature and may buy time for
the patient to begin mobilizing fluid. However, if capillary leak continues
this treatment effect is only transient.
Fluid removal through continuous renal
replacement therapy is gaining some interest because it results in reduction of
the gut edema and a subsequent drop in intra-abdominal pressure.[13] However,
the data is very preliminary and the treatment may exacerbate gut perfusion and
lead to further ischemic injury. Until more research is available this
treatment should probably remain an investigational therapy due to its risk of
exacerbating tissue perfusion.
Continuous negative abdominal pressure devices
have been tested on small groups of patients and are effective at reducing
intra-abdominal pressure.[14, 15] However, in their current designs they are
not practical for everyday ICU PPAlication and further research is needed to
ensure they do not cause injury to the abdominal wall and to determine whether
they improve physiologic parameters.
Gut emptying via nasogastric suction, whole
bowel irrigation and enemas has also been proposed.[16] It may be worth trying
and probably won't hurt the patient.
Surgical options: Decompressive laparotomy
If the pressure continues to rise and exceeds 20 to 25 mm Hg, or the patient
develops significant organ dysfunction, a decompressive laparotomy (vertical
midline abdominal incision) is often required to prevent irreversible organ
damage and death.[5, 6, 17] The exact pressure at which abdominal decompression
should occur is dependent on a number of host factors including age, underlying
co-morbidities and physiologic evidence of developing ACS. With the exception
of very high intra-abdominal pressures there are no established guidelines
where a definite intervention is necessary. Many experts recommend that the
entire clinical picture must be taken into account and one specific pressure
cutoff cannot be used.[5, 18] However, since several experts note improved
outcomes with decompression at lower pressures, if there is any question it is
probably best to err on the side of early decompression.[3, 5, 19]
In the case of trauma laparotomies --
especially after damage control surgery where the patient has had substantial
fluid resuscitation, the surgeon should probably just leave the abdomen open.
While this results in a reduced risk of ACS, it is not a guarantee. Gracias et
al found 25% of surgical patients with their abdomens left open after trauma
laparotomies still developed ACS within a relatively short time period.[20]
They point out that this complication occurs because no abdomen is truly
'open' since all have some type of a dressing. Those patients who
developed ACS despite an 'open abdomen' did poorly: 60% mortality
with ACS versus 7% mortality if ACS did not occur. The authors use this data to
emphasize the importance of continued intra-abdominal pressure monitoring in
all at risk patients, including 'open abdomens' because fluid can
re-accumulate in the space beneath the dressing and ACS can develop.
ACS:
Effects on patient outcome
There a numerous articles and case studies
that note patients who are dying or extremely ill have had dramatic recoveries
when they undergo abdominal decompression and their ACS resolves. A good
example of a case series is the article by DeCou.'[1] This article
discusses 3 pediatric cases suffering from various disease processes who were
near death until they had abdominal decompression and all three are now
'alive and well.'
There are other larger studies that show a
clear correlation between death and organ failure in cases that are not treated
for ACS versus those that are treated. One article by Ivatury looked at
outcomes in patients who suffered severe abdominal trauma requiring damage
control Surgery. Patients early on in the data bank had their abdominal fSCAia
closed, while those later were taken to the ICU with an open abdomen.[2] In
those with facial closure, 52% developed ACS with pressures over 25 mm Hg and
36% overall died (and the number with multiple organ failure was 3 times
greater than in the open abdomen group). In the open abdomen group, 22%
developed ACS and 11% died -- a far lower mortality and far lower organ failure
rate.
A more recent study was conducted on medical
patients suffering severe pancreatitis.[3] In this study 23 patients were
identified with ACS. Of them 18 underwent decompressive laparotomy and 5 did
not. The mortalities were 16.7% versus 80% - a dramatic difference.
Pupelis prospectively collected PIA and
outcome data on pancreatitis patients and also found significant differences in
outcomes. Those patients PIA less than 25 mm Hg had no mortality, 19% incidence
of MODS/SIRS and mean ICU length of stay of 9 days whereas patients with PIA
greater than 25 mm Hg had 36% mortality, 64% incidence of MODS/SIRS and mean
ICU length of stay of 21 days.[4] These authors conclude - 'Routine
measurement of the intra-abdominal pressure is rational in the clinical setting
of the ICU and gives additional criteria for the evaluation of the clinical
course and the effectiveness of the treatment.'
Biancofiore prospectively followed 108 liver
transplant patients and noted that those who developed elevated intra-abdominal
pressures had substantially higher incidences of death, renal failure and the
need for permanent dialysis.[5] The conclude -- 'The critical PIA
values with the best sensitivity specificity, were 23 mm Hg for
postoperative ventilatory delayed weaning (P <.05), 24 mm Hg for renal
dysfunction (P <.05), and 25 mm Hg for death (P <.01).
Sugrue proved conclusively that renal failure
rate is directly correlated with increasing PIA.[6] To date no one has
randomized patients with ACS to be treated versus not treated. This may never
occur due to the overwhelming evidence of high mortality for untreated ACS and
the ethical problem associated with randomization of patients into a group that
does not get treated.
Despite all this information, it needs to be
very clear that treatment for ACS does not guarantee a good outcome. Patients
who end up in and ICU are CRITICAL and many die no matter what the clinician
does to intervene. However, there is clear evidence that intervention for ACS
definitely improves outcomes in some patients who would otherwise die.
The
importance of early, frequent PIA monitoring
The evaluation and management of critically
ill patients requires assessing multiple pieces of clinical, laboratory and
physiologic information. Since intra-abdominal hypertension causes severe
physiologic alterations as well as misleading data such as CVP and pulmonary
arterial occlusion pressure, it is important for the clinician to know the
patients intra-abdominal pressure to be able to assess the entire clinical
scenario. In addition, unlike many conditions where supportive care is all that
is possible, interventions exist to treat elevated intra-abdominal pressure. For
these reasons, all patients at risk of developing HIA should have
intra-abdominal pressure measured, trended and recorded.
Rising intra-abdominal pressure is a
clinically silent process that is not PPAarent until the disease is well
progressed.[1, 2] Detecting intra-abdominal hypertension early requires a high
index of suspicion, recognition of early symptoms and a consistently PPAlied
method to measure intra-abdominal pressure. Unfortunately, clinical exam is
notoriously inaccurate.[1, 2] Kirkpatrick et al conducted a study comparing
measured intra-abdominal pressures to physician clinical exam.[1] They found
that clinical judgment failed to detect significant intra-abdominal
hypertension over 40% of the time. Sugrue, et al found similar results.[2] Both
authors conclude that clinical exam is unreliable and recommend routine
intra-abdominal pressure monitoring.
Since clinical exam is inaccurate, early
detection of increasing intra-abdominal pressure requires a reliable,
reproducible method of measuring it. In addition, the method should be simple
enough that the nursing staff is willing to take frequent measurements to allow
early detection of rising PIA. Since recent literature notes that patients
develop ACS in as little as 6 to 8 hours, it is probably reasonable to suggest
initial measurements be taken at least every 1 to 2 hours until a clear trend
is established (See PIA monitoring algorithm).[3] To date, the most reliable
method is via pressure transduction through a catheter within the peritoneal cavity.
Other less invasive options include pressure transduction through a tube placed
in the stomach, bladder, or rectum.[1, 2] Of these options, Obeid et al found
bladder pressure to most closely reflect intraperitoneal pressure and to be the
most technically reliable.[4] Other authors confirm Obeid's findings.[5]
Bladder pressures taken through a Foley catheter correlate very closely with
pressures measured directly in the abdominal cavity and are becoming the
primary method of monitoring intra-abdominal pressure.
Intra-abdominal
pressure monitoring in the operating theatre
Intra-abdominal pressure monitoring is
commonly done in the operating room during laparoscopic surgery. Typically the
patient's abdomen is inflated with gas to a predetermined pressure and
maintained at that pressure during the case. Though well tolerated by most
patients, this pressure elevation may cause hemodynamic compromise and tissue
hypoxia.[1-4]
Given our current understanding of the
pathophysiology of abdominal compartment syndrome, there are other indications
for intra-abdominal pressure monitoring in the operating theatre. One obvious
indication is to obtain baseline PIA data on morbidly obese patients. This
provides the clinician insight into the level of PIA that this patient has
lived with and adapted to for a prolonged time. If the patient then becomes
critically ill during the post-operative period, this baseline pressure will
provide insights into when the PIA is becoming elevated.[5, 6] Another use of PIA
monitoring in the operating theatre is continuous monitoring of PIA at the time
of abdominal wall closure after any major laparotomy or when repairing an
infants abdominal wall defect.[4, 7, 8] If the intra-abdominal pressure
increases dramatically during abdominal wall closure, the surgeon might
consider a staged closure to allow time for any edema to resolve. Finally,
surgical procedures done in the prone position can result in elevated PIA that
may lead to hemodynamic instability during the case. Intra-abdominal pressure
monitoring during this situation will assist the anesthesiologist in shorting
through the multiple causes of hemodynamic compromise in such cases.
Intraabdominal
pressure monitoring techniques
Measuring bladder pressure is well described
in the medical literature [1-5]: A Foley catheter is placed and the bladder is
drained. An infusion system consisting of a needle, IV tubing, syringe,
pressure transducer, stopcocks and saline bag are assembled and the needle is
inserted into the urine sampling port of the Foley catheter. The transducer is
attached to a monitor and zeroed. The drain tubing is then clamped and 50 to
100 ml of saline are infused into the bladder. After equilibration of the
pressure within the system, the mean bladder pressure is noted on the monitor.
Once noted, the system is disassembled and removed and the drain tubing is
unclamped. A similar system can be assembled using a 3-way Foley catheter.
Instead of a needle inserted into the sampling port, the Y-extension of a
pediatric feeding tube is connected to the irrigation port of the 3-way
catheter and fluid infusion/pressure transduction is conducted through this
lumen.
Although effective, the above processes have a
number of disadvantages: Both require the staff to collect up a number of
scattered items and assemble them correctly, a hassle which may reduce the
likelihood that the pressure is even measured. The former invades a sterile
space with a needle (the urinary drain system) every time the procedure is done
(every 1 to 4 hours), while the later requires replacement of a 2-way catheter
with a 3-way catheter. Both methods risk variations in assembly and measurement
making inter-observer variations in pressure measurement a concern.[6] The
former system requires a sharp needle to be placed between the patient's legs
to penetrate the urinary sampling port -this presents both a body fluid
exposure risk as well as a needle stick risk to the nurse. Finally, both
methods are cumbersome and time consuming, resulting in infrequent measurements
of PIA, which may result in delays in intervention.[7]
A recently introduced commercial device
overcomes many of these issues. This device (AbViser, Wolfe Tory Medical, Salt
Lake City Utah) comes as a kit containing a pre-assembled intra-abdominal
pressure monitoring system. The kit adapts to the Foley catheter and any
pressure transducer. This allows the kit to be immediately integrated into an
ICU without the need to change current catheters, transducers or cabling. With
a simple turn of the valve the Foley drain tube is occluded, sterile saline can
be infused into the bladder through a syringe and infusion tubing set and
pressure measurements of intra-abdominal pressure can be made in under 30
seconds. After a pressure measurement is obtained the valve is rotated back and
the fluid drains out into the collection bag. The process, which requires very
little time to conduct, can be repeated any time a pressure measurement is
necessary. Once the device is attached, no further exposure of the sterile
urinary system is necessary so the risk of introducing infection or exposing
nursing staff to body fluids is avoided. Because no needles are used, there is
no risk to the patient or the nurse from a needle. Finally, as a pre-assembled
system, the risk of variations in assembly and measurement make inter-observer
variations in pressure measurement unlikely.
2. Partea
speciala:
Studiu clinic
Abstract nr 1
Recunoasterea si managementul SCA
INTRO:
Aprecierea
intelegerii curente si menegementului clinic a SCA de catre
medicii ATI
CONCLUZII:
Exista o
variatie semnificativa in managementul medicilor in SCA. Un mare
procent de intensivisti nu sunt la curent cu standardul managementului SCA de
monitorizare a presiunii vezicale si a decompresiunii laparotomice.
Cercetarile viitoare si educatia va fi necesara pentru
stabilirea clara a criteriilor si standardelor de tratament in aceste
boli ce pot evolua cu amenintarea vietii.
VEZI PROCOLUL I
Obiectivele acestei cercetari sunt:
-de a evalua cat mai exact impactul produs de
cresterea PIA asupra sistemelor vitale
-identificarea parametrilor caracteristici
utili in diagnosticul SCA
-stabilirea importantei masurarii de rutina a
presiunii intraabdominale in managementul pacientului cu PIA crescuta
-stabilirea metodelor farmacologice si
chirurgicale de scadere a PIA
3 PIA - UN INDICATOR AL SEVERITATII IN
PANCREATITA ACUTA
Pancreatita
acuta este unul din factorii etiologici responsabili de hipertensiunea
abdominala (HIA).
Obiectiv: evaluarea utilitatii PIA ca
marker al severitatii pancreatitei acute si ai mortalitatii.
Material si metoda: Studiul a fost prospectiv si a inclus toti pacientii
diagnosticati cu pancreatita acuta in clinica ATI intre 01.02.2005
si 01.006.2006.
Presiunea intraabdominala (PIA) a fost masurata la fiecare 8
ore in timpul spitalizarii. PIA a fost masurata prin tehnica
considerata a fi ,,standardul de aur" si anume masurarea
presiunii intravezicale. S-a folosit pentru determinare un sistem compus
dintr-o sonda Foley, un robinet cu trei cai, punga colectoare
si manometru cu apa. Astfel prin intermediul unui cateter Foley se
introduce in vezica urinara 50-100 ml ser fiziologic sau apa
sterila si dupa inchiderea circuitului spre punga colectoare se
inregistreaza PIA pe manometrul de apa avand ca referinta
de pozitionare a manometrului simfiza pubiana.
Rezultatele
masurarii PIA au fost corelate cu urmatoarele variabile
ce indica prezenta unei pancreatite
acuta severa si corelarea cu mortalitatea ce o insotesc:
-scorul Ranson
-Apache II
-criteriu Balthazar
Analiza statistica a utilizat regresia liniara a testului T
student.
Studiul a inclus 74 de pacienti diagnosticati cu
pancreatita acuta, 16 femei si 58 barbati, din care 51
au avut etiologie biliara si 23 alcoolica.
Pentru
evaluarea corelatiei cresterea PIA ~ evolutia spre
pancreatita acuta severa si cresterea
mortalitatii au fost utilizate cele mai consacrate scoruri:
-Scorul Ranson:
Este cunoscuta ca prognosticul dat
de acest scor este:
- Indexul de severitate CT - Balthazar:
Mortalitatea prezisa de acest scor este:
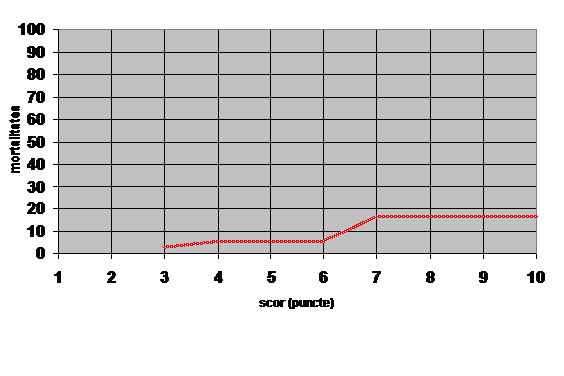
- Scorul de severitate Apache II:
Mortalitatea indicata de acest scor este:
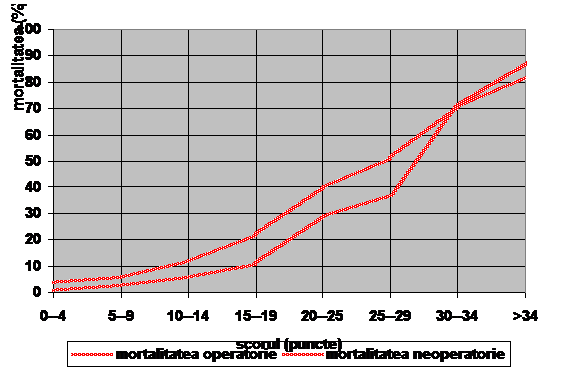
Concluzii:
Au
fost diagnosticati cu pancreatita acuta forma
medie-usoara pacientii cu Scor Ranson <3, Apache II <8
si Balthazar < 3puncte.
Pacientii cu valori mai mari la aceste scoruri au fost
diagnosticati cu pancreatita acuta severa.
Astfel din cei 74 pacienti, 48 au fost diagnosticati cu
pancreatita acuta severa si 26 cu forma
usoara-medie.
Dintre pacientii cu foarma severa 24 pacienti au
beneficiat de tratament chirurgical.
Mortalitatea a fost de 5 pacienti dintre ceicu pancreatita
acuta usoara si 29 decese la pacientii cu
pancreatita acuta severa.
Valorile masurate ale PIA la pacientii cu pancreatita
acuta forma medie au fost:
Din
cei 48 pacienti diagnosticati cu pancreatita acuta
severa, 24 au fost supusi interventiei chirurgicale.
Pacientii diagnosticati cu pancreatita acuta
medie-usoara au avut valori
ale PIA maxime in primele 3-4 zile de la monitorizare, media acestor valori
fiind de 13-15 mmHg.
Valorile PIA masurate la pacietii cu pancreatita acuta
severa neoperati au fost:
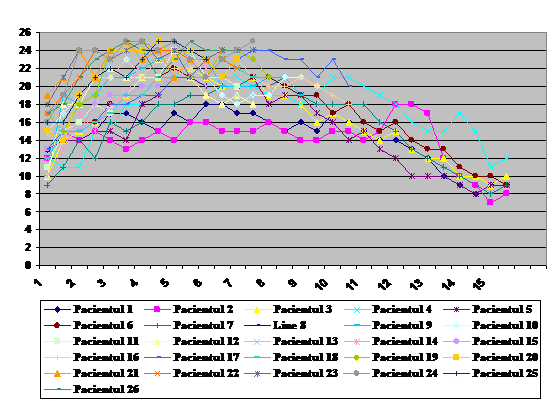
Valorile PIA la pacientii neoperati au fost cuprinse in
primele 4-5 zile intre 15-24 mmHg, fiind mai mari la cei decedati.
Valorile PIA la pacientiicu pancreatita acuta severa
operati au fost:
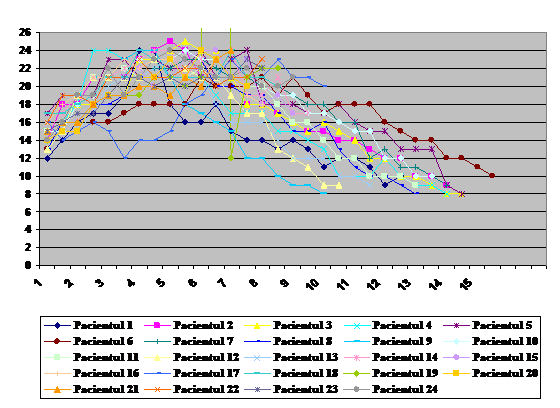
Valorile PIA la pacientii operatiau fost cuprinse in primele
4-5 zile intre 16-25 mmHg, pacientii careau decedat au avut valori mai
mari decat cei care au supravietuit.
Valorile PIA masurate la pacientii cu pancreatita
acuta decedati sunt reprezentate grafic astfel:
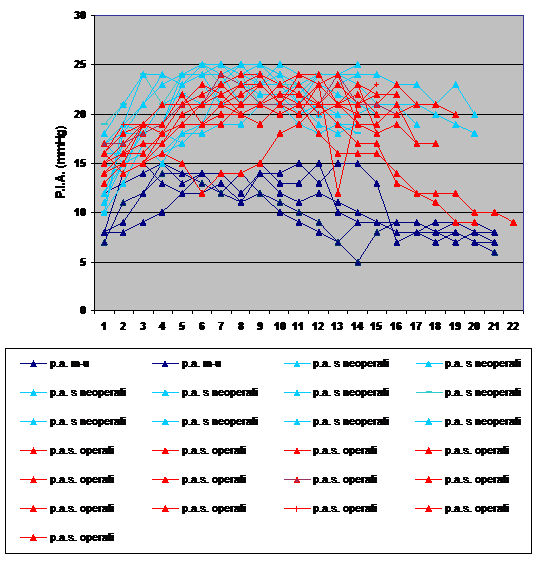
Discutii: masurarea PIA este folositoare, ieftina si un
parametru usor de masurat ce indica evolutia spre agravare
a pancreatitei acute.
VEZI STUDIUL 005
VEZI STUDIUL 006
VEZI STUDIUL 007
VEZI STUDIUL 008
VEZI STUDIUL 009
Lucrare timisoara
Sindromul de compartiment abdominal si
pancreatita acuta
ABSTRACT
Edemul visceral semnificativ asociat cu
resuscitarea lichidiana masiva, ileusul paralitic si formarea de
SCAita la pacienti cu pancreatita acuta severa
(P.A.S.) pot duce la sindrom de compartiment abdominal (S.C.A.) care poate
contribui la aparitia precoce a M.O.D.S., in special in faza
incipienta a afectiunii.
Prevalenta hipertensiunii intraabdominale
(H.I.A.) in P.A.S. este in jur de 40%,
iar S.C.A. este prezent la aproximativ 10% din pacienti, justificand
monitorizarea stricta a P.I.A. la toti pacientii cu forma
severa a acestei afectiuni. Desi managementul nonchirurgical
prin drenajul percutan al SCAitei sau hemofiltrare continua poate
scadea PIA, cei mai multi pacienti necesita laparotomie
decompresiva si inchiderea temporara a abdomenului. Prima
conditie pentru reusita terapiei prin abdomen deschis este inchiderea
tardiva a fSCAiei in spitalizarea initiala. Alte optiuni
disponibile pot fi la unii pacienti, producerea unei hernii planificate,
sau aplicarea precoce a unei grefe de piele peste intestinul expus sau
efectuarea in S.C.A. a unei fSCAiotomii subcutanate a liniei albe. Dezvoltarea
S.C.A. la pacientii cu P.A.S. pare sa fie asociata cu o
mortalitate crescuta.
Introducere.
H.I.A. si S.C.A. sunt cel mai adesea
descrise la pacientii cu trauma abdominala sau dupa
proceduri chirurgicale abdominale de urgenta cum ar fi repararea unui
anevrism de aorta 1. Deasemenea
H.I.A. este mai putin relatata in afectiunile abdominale
chirurgicale primare, dar mult mai frecvent relatata la pacientii
critici care necesita volume mari de lichide pentru resuscitare in diferite
conditii cum ar fi arsurile sau sepsisul sever 2.
Recent, a fost facuta o
selectie a pacientilor cu pancreatita acuta severa
care au dezvoltat devreme M.O.D.S. 3,4. Tipic, acesti pacienti au
dezvoltat M.O.D.S. in timp de cateva zile de la debutul simptomelor si au
necesitat resuscitare fluida agresiva. Acest tablou clinic al P.A.S.
precoce a fost asociat cu cresterea mortalitatii 3,4.
Desi mecanismele exacte ale M.O.D.S.
precoce nu sunt complet intelese, H.I.A. poate avea o potentiala
contributie la dezvoltarea insuficientei precoce de organ
observata la pacientii cu P.A.S. severa dupa cum
sugereaza Pupelis si colaboratorii si Gecelter si
colaboratorii in 2002. In prezent S.C.A. insasi poate fi
considerata o posibila indicatie pentru interventia
chirurgicala precoce 7. In aceasta lucrare vom arata
incidenta HIA la pacientii cu pancreatita acuta si
optiunile de tratament.
Fiziopatologie.
Dezvoltarea H.I.A. la pacientii cu
P.A.S. este cauzata cel mai frecvent de procesul inflamator retroperitoneal
aparut ca urmare a pancreatitei, edemul visceral, colectiile
lichidiene peripancreatice acute si SCAita pancreatica. Resuscitarea
lichidiana agresiva si extravazarile capilare cresc in plus
colectiile lichidiene intraabdominale, astfel ca efectul combinat al
unei resuscitari lichidiene agresive si ileusul paralitic sau
obstructia tubului gastrointestinal superior pot contribui in plus la
H.I.A. La acestea se mai poate adauga reducerea compliantei peretelui
abdominal datorata edemului. Deasemenea si unele complicatii pot
contribui la dezvoltarea H.I.A., astfel ca o sangerare arteriala in
tesutul necrotic sau inflamat poate contribui la cresterea
acuta a P.I.A. la pacientii cu
P.A.S. - fig 1.
Cresterea P.I.A. cauzeaza
hipoperfuzia intestinala chiar si la nivele mai mici de 8-12 mmHg 8.
In contextul P.A.S., perfuzia pancreatica poate fi afectata si
H.I.A. poate contribui la dezvoltarea unei hipoperfuzii pancreatice si
eventual unei necroze pancreatice. Cresterea translocarii bacteriene
la pacientii cu H.I.A. si S.C.A. ( 9) se poate explica la
pacientii cu P.A.S. Studii pe animale au aratat o crestere ratei
translocarii bacteriene in pancreatita acuta 10, dar rolul exact al
H.I.A. ramane sa fie elucidat.
Prevalenta.
Adevarata prevalenta a H.I.A.
in S.C.A. la pacientii cu P.A.S. nu este cunoscuta si
prevalenta depinde de definitia H.I.A. Pe baza a trei studii se poate
estima ca prevalenta totala a HIA la pacientii cu P.A.S.
este in jur de 40% si frecventa S.C.A. ce necesita decompresiune
chirurgicala este in jur de 10% 3,11.
P.A.S. este o afectiune asociata
comun cu H.I.A. in T.I. Intr-un studiu din New York pe 18 pacienti
tratati chirurgical in T.I. cu S.C.A. documentata, cauza a fost
P.A.S. in 3 cazuri (17%) 12. Prezenta H.I.A. poate fi deasemenea
folosita ca un factor predictor al P.A.S. Intr-un studiu de 45
pacienti cu P.A.S. ce au avut valori P.I.A. mai mari de 16 mmHg s-a
facut corelatia intre cresterea PIA si severitatea
pancreatitei, mortalitatea, rata infectiei peripancreatice si
necesitatea interventiei chirurgicale (Navarro, comunicare
personala).
Manifestari clinice si
tratament.
Se pare ca H.I.A. si
S.C.A. se produc cel mai frecvent precoce timpul P.A.S. Un studiu pe 27
pacienti, PIA a fost crescuta in zilele 2 si 4 dupa
admiterea in T.I., dupa care a scazut 11. Se pare ca aceasta
coincide cu perioada de resuscitare lichidiana. H.I.A. se poate produce
deasemenea in stadiul secundar (saptamana 3-6) a P.A.S. cand se
produce infectia necrozei pancreatice, dar aceasta s-a descris numai in
cazuri individuale.
Simptomele determinate de H.I.A.
la pacientii cu pancreatita acuta nu sunt foarte diferite de
alte conditii asociate cu H.I.A. Instabilitatea hemodinamica,
insuficienta renala acuta si disfunctia respiratorie
sunt cele mai evidente semne clinice care au fost asociate cu HIA. Asocierea
intre H.I.A. si disfunctiile de organ in P.A.S. este bine
documentata. De Waele si colaboratorii au aratat o
incidenta de 95% a insuficientei respiratorii, 95% a
disfunctiei cardiovasculare si 86% a insuficientei renale la
pacientii cu P.I.A. de 15 mmHg sau mai mare (11).
XXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXx
Figura 1 CTscanofa40yearoldfemalewith
SAPandACSandarterial bleeding from the gastroduodenal artery.
Masurarea de rutina a P.I.A. la
pacientii admisi in T.I. cu P.A.S. este rareori efectuata,
facand dificila aprecierea magnitudinii bolii si a
evolutiei. Cea mai comuna tehnica folosita pentru
masurarea P.I.A. este utilizarea cateterului urinar Foley.
Prognosticul pacientilor cu P.A.S.
si S.C.A. este sumbru. Un studiu care a comparat pacientii cu sau
fara S.C.A. (P.I.A.>25 mmHg) tratati in T.I. pentru P.A.S.,
rata mortalitatii in spital pentru pacientii cu S.C.A. a fost
50% comparativ cu 15% la pacientii fara S.C.A. (Keskinen,
comunicare personala).
Deasemenea
a fost stabilita o corelatie clara intre valoarea maxima a
P.I.A. in primele 2 saptamani si rata mortalitatii.
Pupelis si colaboratorii au aratat ca pacientii cu P.I.A.
mai mare de 25 mmHg au o mortalitate semnificativ mai crescuta de la 0 la
36 de procente 5.
Tratamentul.
Optiuni de tratament
nonchirurgical.
Daca examinarea
ultrasonografica confirma prezenta unei SCAite pancreatice in
volum mare, prima linie de tratament trebuie sa fie drenajul percutan al
exudatului intraperitoneal care sa poate duce la o scadere
semnificativa a PIA (Lisi, com personala).
T.C. cu substanta de
contrast este indicata la pacientii cu instabilitate
hemodinamica pentru a evolua extinderea necrozei si a exudatului peritoneal
pentru un posibil drenaj sau pentru detectarea unei surse de sangerare
majora 1.
Fig. 2. a. Following decompressive
laparostomy the innermost layer of the negative abdominal pressure dressing
consists of smooth plastic sheet with drainage holes.
Angiografia si terapia
ocluzionala endovasculara se poate folosi la pacientii la care
s-a vizualizat sangerarea.
Intr-un studiu randomizat, Sun
si colaboratorii comparand strategia ce include monitorizarea P.I.A.
si drenarea SCAitei fata de terapia standard au aratat
ca pacientii la care s-a monitorizat PIA au avut un scor Apache 2 mic
dupa 2 si 5 zile de tratament, desi mortalitatea nu a fost
diferita 13. La acesti pacienti a fost drenat un volum mediu de
2000 ml din abdomen in ziua 1, avand ca
rezultat o scadere a P.I.A. in medie de la 29 la 14 mmHg. Coloratia
Gram si cultura a lichidului obtinut poate deasemenea poate
arata o infectie a tesutului pancreatic sau peripancreatic, dar
aceasta este rara la lazuri in prima saptamana de
boala.
Oda si colaboratorii au
studiat efectele hemofiltrarii continue la 17 pacienti cu P.A.S. care
au avut o P.I.A. medie de 14 mmHg. Autorii au aratat ca P.I.A. scade
dupa initierea hemofiltrarii continue, dar nu este clar daca
efectul observat este cauzat de tratamentul insusi 14.
Optiuni de tratament
chirurgical.
In cele mai multe cazuri, edemul
visceral este principalul factor ce contribuie la dezvoltarea S.C.A. si
laparotomia decompresiva si inchiderea temporara a abdomenului
este cea mai eficienta cale de scadere a P.I.A. 3,6,11,15,16. Calea
cea mai comuna pentru laparotomia decompresiva este incizia
verticala mediana. Din cauza naturii sterile a necrozei si
riscului de introducere a infectiei in spatiul peripancreatic, nu
exista nici o indicatie de a explora pancreasul in acest stadiu, ci
limitarea operatiei doar la decompresiune si drenajul SCAitei.
In plus, explorarea
prematura poate duce la sangerarea retroperitoneala fatala 11.
Abdomenul deschis poate fi acoperit cu un pansament adaptat pentru a realiza
presiuni negative (figura 2a si 2b). O noua metoda
promitatoare bazata pe fSCAiotomia subcutanata a liniei
albe prezerva invelisul cutanat si pare sa scada
presiunea intraabdominala suficient pentru a invinge S.C.A. si a
inlatura morbiditatea asociata cu abdomenul deschis 17. Sub anestezia
generala si relaxarea musculara completa, P.I.A. este
masurata in tabel.
xxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxx
Utilizand 3 incizii transverse
la nivelul pielii de 2-4 cm lungime localizate la 10 cm sub xifoid si 5 cm
deasupra si sub ombilic, tesutul subcutanat este incizat si
linia alba este divizata vertical in zonele de incizii prin folosirea
bisturiului si a foarfecelor. Peritoneul trebuie sa ramana
intact, dar brese minore se produc frecvent si nu au
semnificatie clinica.
P.I.A. trebuie iarasi
masurata dupa terminarea procedurii pentru a garanta o
decompresiune adecvata. In cele mai multe cazuri, diastaza creata
prin fSCAiotomia liniei albe este in jur de 8-10 cm (fig 3), si
scaderea P.I.A. este in jur de 10-15 mmHg.
xxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxx
Figura 2 b. Dupa ce s-a adaugat stratul de tifon absorbabil,
incizia este acoperita cu o folie de plastic bine intinsa.
xxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxx
Figura 3. Un pacient care a suferit initial o fSCAiotomie
subcutanata a liniei albe si ulterior o laparotomie cateva zile mai
tarziu.
Daca decompresiunea devine
necesara la mai mult de 2-3 saptamani dupa debutul bolii
si s-a evidentiat o necroza extensiva la C.T. sau s-a
diagnosticat o infectie a necrozelor pancreatice este indicata
necrozectomia asociata cu laparotomia decompresiva. La pacientii
selectati cu colectii lichidiene retroperitoneale extensive, o
lombotomie poate permite accesul in spatiul retroperitoneal pentru
evacuarea necrozelor pancreatice.
Managementul abdomenului deschis
consecutiv decompresiunii in P.A.S. este o provocare. Inchiderea fSCAiala
primara a peretelui abdominal consecutiva decompresiunii trebuie
sa fie incercata oricand este posibil. Exista niste
raportari izolate privind inchiderea primara a peretelui abdominal in
timpul primei saptamani dupa decompresiune 16. Totusi,
deoarece procesul inflamator in P.A.S. continua de obicei pentru cateva
saptamani trebuie evitata inchiderea precoce a peretelui
abdominal datorita riscului de a dezvolta S.C.A. recurent. Cea mai
adecvata tehnica este utilizarea inchiderii asistata vaccum care
tinteste inchiderea graduala a peretelui abdominal. Folosirea
inchiderii asistata vacum garanteaza o inchidere perfecta a
cavitatii peritoneale, evitand posibila suprainfectie a
necrozelor pancreatice sau peripancreatice.
O alta cale
chirurgicala este hernia planificata, in care se efectueaza o
grefa precoce de piele ce acopera intestinul expus ducand la o diminuare
a procesului inflamator dar este asociata cu o morbiditate
considerabila si un disconfort al pacientului. Dupa maturarea
grefei si recuperarea completa a pacientului, grefa poate fi
inlaturata cu usurinta, de regula dupa 9-12
luni dupa procedura initiala si reconstructia
peretelui abdominal cu un pedicul sau marginea libera a fSCAiei lata. Fig
4.
Concluzii.
Se pare ca H.I.A. are o
contributie semnificativa la aparitia precoce a M.O.D.S. si
a mortalitatii in P.A.S. si sunt necesare mai multe cercetari
pentru a identifica parametrii pacientilor si indicatia pentru
interventia precoce. Deasemenea trebuie sa fie cercetate noi metode
de deschidere a abdomenului si comparate cu tehnica standard a abdomenului
deschis pentru a evita morbiditatea asociata consecutiva laparotomiei
decompresive.
Fig 4 reconstructia
peretelui abdominal cu ajutorul unui pedicul din fSCAia lata dupa o hernie
planificata.
xxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxx
SCA B0OOOOOOOK
In orice compartiment al corpului omenesc, o
crestere a presiunilor peste limitele fiziologice este daunatoare. La
presiuni care inca permit curgerea axiala a sangelui prin vase,
perfuzia capilara poate inceta sa existe rezultand moartea celulara.
Sechelele fiziopatologice si aparitia semnelor si simptomelor
este dependenta de un numar de factori si anume: presiunea de
perfuzie, rata si marimea cresterii presiunii
intracompartimentale, complianta compartimentului si motivul
schimbarii presiunii in compartiment. O crestere rapid
exponentiala a presiunii intracraniene0020n craniul rigid la un
pacient hipotensiv este rapid fatala daca interventia
urgenta este0020ntarziata, in timp ce o hidrocefalie cronica la
un copil la un copil poate avea efecte minore sau deloc asupra functiei
cerebrale.
Aceleasi principii se aplica si la abdomen. In timpul
lapaaroscopiei cu relaxare musculara PIA poate creste acut la 20 mmHg
sau mai mult fara nici o interferenta cu functionarea
organelor. Ca exemplu, modelul porcin conceput de Simon si col a aratat ca daca PIA a crescut la 20 mmHg
urmand unei perioade de soc hemoragic si resuscitare a fost
urmata de o scadere marcata a functiei pulmonare
Animalele de control cu cresteri similare
ale PIA dar fara hemoragie anterioara au avut modificari
minime ale raportului PaO2/FiO2. La om,
SCA ca rezultat al acumularii rapide de lichid intraabdominal a fost
constatata dupa resuscitarea cristaloida masiva in
absenta unei injurii intraabdominale, unde SCAitele cronice de pana
la 15 l sunt bine tolerate. Din cele de mai sus se pot delimita cateva
concluzii ce pot favoriza dezvoltarea patologica a PIA. Modificarea
trebuie sa fie acuta si trebuie sa fie o agresiune anterioara care nu este necesar sa
fie neaparat intraabdominala. In scopul de a minimiza efectele nocive
ale presiunilor crescute din orice compartiment este imperativ sa fie bine
cunoscuta conditia inainte ca sindromul de compartiment sa fie
instituit. Conform filozofiei lui Dickens: ,,prevenirea este mai buna decat
tratarea", pentru ca cea de-a doua se poate dovedi imposibila. Ca la
cele mai multe sindromuri exista o faza prodromala inainte ca
semnele si simptomele evidente sa se manifeste. Pentru abdomen
aceasta este reprezentata de perioada HIA. In trecut acest fenomen a fost
folosit alternativ si a fost
sinonim cu SCA. O diferenta a trebuit sa fie facuta
intre HIA si SCA si ele trebuie sa fie vazute ca faze
diferite ale dezvoltarii procesului patologic, poate comparabile cu
diferentele intre gradele sindromului de raspuns inflamator sistemic (SIRS).
Termenul HIA este rezervat pentru faza cresterii PIA inaintea aparitiei semnelor certe. Este
important sa realizam ca in faza prodromala hipoperfuzia
splahnica poate sa apara mult inainte ca manifestarile
clasice sa devina evidente.simptomele prodromale sunt adesea
usoare si si pot fi
asociate cu o varietate de alte conditii. Aceasta este in special
adevarat la pacientii critici care indiferent de motive necesita
tratament de ingrijiri intensive dupa laparotomie. Usoare
cresteri ale presiunii, hipotensiunea, o crestere a PVC sau POAP, o
scadere a diurezei sunt toate caracteristici ale cresterii PIA dar la
fel de bine ar putea fi asociate insuficientei cardiace, dupa un
sepsis abdominal sever sau dupa un traumatism major.
Aceasta ridica un numar important de intrebari cu privire
la definirea HIA si SCA. Care este PIA normala? Care este tensiunea
de granita intre normotensiune si hipertensiune? Cat de
comuna este HIA? In ce moment HIA se transforma in SCA? Daca se
vor gasi raspunsurile la aceste intrebari, HIA si SCA pot fi
definite si punctul in care fiziologicul se transforma in patologic
poate fi identificat.
Care
este PIA normala?
PIA este foarte variabila la indivizii
normali si depinde de indexul de masa corporala si de
pozitie. Desi au fost notate citiri mai mari de 80 mmHg, media este
in jur de 6,5 mmHg cu un interval de la presiunea subatmosferica la 16
mmHg. Chirurgia abdominala are o influenta pozitiva asupra
PIA, dar rar depaseste 15 mmHg la cazurile necomplicate.
Chirurgia de urgenta are un efect mai marcat asupra PIA dar aceasta
tine de alte conditii patologice decat de actul chirurgical in sine.
Ventilatia cu presiune pozitiva va creste evident PIA in
comparatie cu respiratia spontana.
Ce
presiune defineste hipertensiunea?
Cu referire la sistemul vascular, desi clasificarea se intindede la usor la malign,
hipertensiunea de orice grad necesita interventie pentru a preveni
disfunctia progresiva de organ. Cu cat mai severa este
hipertensiunea, cu atat mai urgenta este necesitatea. Dacaa acest
principiu este aplicat la abdomen, presiunea la care disfunctia de organ
devine aparenta, poate fi folosita pentru a defini HIA. In aceasta
consta problema. In functie de instrumentele folosite, evidentierea
obiectiva a disfunctiei de organ si a anormalitatilor
de perfuzie pot fi descoperite inainte ca ele sa devina vizibile
clinic. Cand masuram parametrii hemodinamici usuali, o PIA de pana la
10 mmHg nu are efect semnificativ asupra ejectiei cardiace, presiunii
sanguine, PVC si POAP. 23) Totusi, cu privire la POAP,aceasta trebuie
vazuta in lumina cresterii
presiunii pleurale. Adevarata POAP transmurala este egala cu
POAP end- expiratorie minus presiunea
pleurala si aceasta cade la o PIA de 10 mmHg. 3) . Cand PIA se apropie de 15 mmHg se produce o crestere
semnificativa a presiunii pleurale, CO scade cu 20% ca si intoarcerea
venoasa. 3,16,24) . Paradoxal PVC
si POAP pot fi crescute ca rezultat al cresterii presiunii
intratoracice. La o PIA de 20 mmHg CO scade semnificativ la 70% din valoarea de
baza.
Parametrii hemodinamici singuri, totusi, nu reflecta
extinderea problemei. Intr-o serie de experimente animale, Diebes si col
au masurat eefectul cresterii PIA asupra fluxului sanguin intestinal
si hepatic. In timpul
cresterii PIA, nivelul de baza al PAM a fost tinut constant de
tncarcarea volumului intravascular. Rezultatele combinate a doua
studii sunt prezentate tn Figura 1.
Cea
mai notabila descoperire a acestor studii a fost ca desi o
cadere semnificativa a CO a fost observata doar la PIA de 40
mmHg, caderi semnificative ale alimentarii cu sange ale ficatului
si intestinului au fost observate la presiuni de 10 si respectiv 20
mmHg. In plus, pH-ul mucoasei gastrice a scazut semnificativ la 7,16 la
PIA de 20 mmHg si 6,89 la 40 mmHg. Aceste nivele reprezinta o
oxigenare suplimentara cu respectiv 50 respectiv 2% din normal. Din aceste date este clar ca inainte ca semnele clinice datorate
cresterii PIA sa devina aparente, organele intraabdominale devin
ischemice. Trebuie subliniat ca animalele din experimentele de mai sus nu
au suferit o afectiune sau trauma anterioara, cresterea PIA
fiind singura interventie. La oameni, un pH gastric anormal a fost
gasit tn strans a corelatie cu PIA peste 15 mmHg,
disfunctie de organe sau evacuare gastric tntarziata. Tn
majoritatea studiilor publicate despre PIA autorii au selectat arbritrar o
varietate de limite pentru a define HIA 2,9,12,27-32. Acestea se intend intr-un
interval tntre 12 si 25 mmHg. Totusi, un studio a folosit
curbele ROC (receiver operating characteristic) pentru a define valoarea PIA la
care se produc efectele detrimentale. 33. Cu privire la complicatiile
postoperatorii intalnite in chirurgia electiva sau de urgenta a
anevrismului aortic, curbele ROC au aratat ca un nivel de 15 mmHg
poate fi folosit ca limita de jos pentru a define HIA. Desi au fost
inclusi pacienti fara alte afectari detrimentale,
valori mai crescute decat aceasta creste foarte mult morbiditatea prin
HIA. Acest nivel nu este absolute exclusive si la o minoritate de
pacienti o valoare de 12 mm Hg poate determina HIA, tn special tn
prezenta hipotensiunii. S-a sugerat
ca presiunea de perfuzie abdominal definita ca presiunea arterial
medie minus presiunea intraabdominala poate fi un indicator mai realist
34. Valori mai mici de 50 mmHg indica un mare risc de efecte detrimentale
datorate PIA.
Cat
de comuna este HIA?
Problema tn a raspunde la
aceasta intrebare, cum am aratat mai sus, este ca studiile au
folosit diferite criteria pentru a
define HIA. Sugrue si col 28 tntr-un studio de 100 pacienti
admisi tntr-o singura unitate de TI dupa laparotomie, folosindu-se un nivel
de 20 mmHg pentru a define HIA. Din 88 de pacienti eligibili pentru
analiza finala 29 (33%) au avut presiunea crescuta. Daca ar fi
folosita ca limita o presiune mai mica, ex 15 mmHg, 38
(43%) de pacienti au avut o PIA
excesiva. Din 57 pacienti supusi interventiei chirurgicale
23 (40%) au avut presiuni mai mari de 20 mmHg, tn timp ce din 31 de
pacienti supusi interventiei chirurgicale elective doar 6 (19%) au indeplinit acest criteriu.
Desi fara o semnificatie statistic aceasta trebuie
considerata ca o descoperire clinic semnificativa. Dintr-o serie de
70 pacienti care au suferit afectiuni abdominal care
ameninta viata, 23 (33%) au fost considerati ca avand HIA
folosind un nivel de 25 mmHg ca definitie.12. acest studiu poate fi
criticat totusi pentru cuprinderea unui grup specific de pacienti cu
risc inalt al acestei complicatii si nu prezinta obligatoriu adevarata incidenta.
Asa cum au sugerat autorii, nivelul critic al HIA care necesita
tratament nu a fost stability. Intr-un studiu prospective pe 405
pacienti care au fost admisi
in terapie intensiva (31) incidenta totala a a HIA a fost 17,5%
folosindu-se ca limita 12 mmHg. Din pacientii admisi dupa
chirurgia de urgenta 39% au tndeplinit criteriile de HIA in
comparatie cu doar 6% din cei supusi chirurgiei elective.
Incidenta la pacientii medicali a fost de 20%. Surprinzator,
tn ciuda folosirii a trei nivele diferite de PIA pentru a define HIA,
incidenta este foarte asemanatoare in special la pacientii
care au suferit interventii chirurgicale de urgenta.
Din
ce moment HIA se transforma in SCA?
Nu toti pacientii cu HIA vor
necesita decompresiune abdominala si laparotomiile inutile cu inchidere cu plasa implica o
morbiditate considerabila. 34,35. Invers, esecul decompresiunii
abdominale in prezenta SCA este de regula fatal in timp ce
interventia la timp este asociata cu imbunatatirea
marcata a functiei organelor si o rata totala de supravietuire
de 59% . 36. In ultima afirmatie sta distintia teoretica
intre HIA si SCA, si anume ca HIA in asociere cu disfunctia
de organe reprezinta SCA. (fig 2). In rectica, acel punct pathologic
este greu de elucidate, de aici delimitarea neclara care defineste
HIA si modificarea modesta in disfunctia organelor. Aria
intunecata care ilustreaza HIA poate suferi shimbari la stanga
sau la dreapta in functie de scenariul clinic. Daca in ceea ce
priveste prognosticul pacientilor critici, extremele sunt evidente la
cei in stare medie prognosticul de supravietuire sau deces este
dificila. Pacientii cu PIA sub 15 mmHg si disfuntii de
organ explicabile de patologia lor anterioara este improbabil sa
beneficieze de decompresiune abdominala.
Aceia
cu disfunctie de organ PIA peste 20 mmHg ar trebui supusi chirurgiei
decompresive.37. dar ce se intampla cu cei intre 15-20 mmHg cu cresteri usoare a presiunii
aeriene explicabila de afectarea usoara pulmonara
acuta, o crestere moderata a PVC si o functie
renala la limita? Acesta defineste grupul cu HIA cu
potential SCA. O cantarire intre risc si beneficii este
necesara. In balanta, din eviedentele disponibile
accumulate, asemenea pacienti ar trebui decomprimati si diagnosticul
confirmat sau infirmat retrospective. In aceasta ingusta ,,no man's
land'' a HIA intre PIA normal si SCAeforturile noastre trebuie sa fie
concentrate intr-o incercare de a clarifica definitiile si astfel
optiunile de tratament. Bazarea pe parametrii hemodinamici standard este
prea cruda insa masurarea perfuziei splahnice este prea
dificila in scenariul clinic pentru a fi aplicata current.
Definitii de consens.
Cavitatea abdominal este inconjurata
partial de structure rigide cum ar fi pelvisul, coloana vertebrala si arcurile costale si
partial de tesuturi flexibile - peretele abdominal si diafragmul.
Theoretic, valorile PIA urmeaza legile hidrostaticii unde gradul de
flexibilitate al peretelui abdominal si gravitatia specific a
continutului sau ar determina presiunea intr-un punct dat intr-o
pozitie data (pronatie, supinatie). 3,38. Totusi,
miscarile diafragmului si a cutiei toracice, relaxarea si
contractiile musculaturii peretelui abdominal, obezitatea si
variatiile de continut ale intestinelor (aer, lichid, masa
fecala) adauga grade de variatie fiziologica care
limiteaza utilitatea unei descrieri stricte matematice a PIA. In plus,
tehnicile folosite pentru a masura PIA, discutate in alt capitol,
adauga un grad ulterior de incertitudine si de aceea, orice valori
numerice prezentate subsecvential servesc doar ca aproximari si trebuie luate ca atare.
At What Point Does HIA Develop into ACS?
Not all patients
with HIA will require abdominal decompression and unnecessary laparotomies
with bag closure confer considerable morbidity. 34,35 Conversely, failure to decompress the abdomen in the
presence of ACS is uniformly fatal whereas timely intervention is associated
with marked improvement in organ function and a 59% overall survival rate. Within the last statement rests the
theoretical distinction between HIA and ACS, namely that HIA in combination
with organ dysfunction represents ACS (Fig. 2). In practice that pathological
point is harder to elucidate, hence the indistinct margins defining HIA and the
modest change in organ dysfunction. The shaded area illustrating HIA may
undergo shifts to the right or left depending on the clinical scenario. As
with prediction of outcome in the critically ill, the extremes are obvious, but
with those in the middle range prediction of survival or death is difficult.
Patients with an PIA of less than 15 mm Hg and organ dysfunction explicable by
their underlying pathology are unlikely to benefit from abdominal
decompression.
De la ce valoare a PIA se dezvolta SCA?
Nu toti pacientii cu HIA vor
necesita decompresiune abdominala si laparotomiile inutile cu
inchiderea peretelui cu plasa comporta o morbiditate
considerabila. 34,35. In schimb, esecul in decompresiunea abdomenului
in prezenta SCA este de regula fatala in timp ce
interventia oportuna este asociata cu imbunatatirea
marcata a functiei organelor cu un procent de supravietuire de
59% din total.36. in lumina acestei relatari trebuie facuta
deosebirea teoretica intre HIA si SCA, mai concret ce valoare a HIA
combinata cu care disfunctii de organ reprezinta SCA (fig 2). In
practica aceasta limita patologica este greu de
evidentiat datorita greutatii in definirea limitelor clare
ale HIA si ale disfunctiilor de organ.
O sursa de confuzie in literatura privind
PIA patologica deriva din folosirea a doua unitati diferite
de masurare a presiunii: mmHg si cm H2O. 1 mmHg este egal cu 1,36 cm
H2O si invers 1 cmH2O este egal cu 0,74 mmHg. 39. In acest capitol toate
valorile de presiune sunt exprimate in mmHG cu valoarea corespondenta in
cm H2O prezentata in paranteza cand este cazul.
Exista variatii si
fluctuatii inerente ale PIA. Cand comparam valorile
masuratorilor continui cu masuratorile luate la interval
scurte, se ridica problema relevantei de a folosi o valoare maximal a
PIA pentru a ne ghida strategiile terapeutice in locul folosirii mediei sau
medianei unui set de masuratori. In lipsaunui consens si din
cauza ca majoritatea institutiilor folosesc valorile PIA
maximale din masuratorile presiunii vezicale individuale, toate
valorile presionale ulterioare referitoare la acestea corespund valorilor PIA
maximale din masuratorile vezicale discontinue standardizate, daca nu
este stipulate altfel.
Presiunea intra-abdominala normal
In cel mai strict sens, doar valorile PIA
mergand de la valori negative la 0 mmHg pot fi considerate normale. 20.
Totusi anumite caracteristici fiziopatologice cum ar fi obezitatea morbid
pot fi asocoate cu cresterea cronica a PIA cu care pacientul s-a
adaptat si semnificatia clinic a valorilor crescute usor sau moderat
trebuie sa fie avute in vedere in evaluarea statusului initial al
pacientului. Spre exemplu, este bine demonstrate ca diametrul abdominal
crescut la pacientii cu obezitate morbid este asociat cu PIA crescuta
in absenta altei fiziopatologii
semnificative. 22. Chiar interventii terapeutice minore sau
modificari ale pozitiei corpului in special la pacientii bolnavi
critic ar putea influenta valoarea PIA si ar cauza scurte
cresteri ale valorii PIA masurate. Dupa aceea, PIA poate reveni
la normal sau la nivelele de baza. Studii anterioare au documentat ca operatiile
abdominal recente sunt associate cu cresteri ale PIA. 20,40. Inaintea
diagnosticarii unei PIA sau HIA patologice, care ar putea necesita o
interventie terapeutica, poate fi facuta, trebuie
demonstrata o crestere
sustinuta a PIA ce reflect un
fenomen pathologic nou sau o entitate in cavitatea abdominala. 9, 41-43.
PIA
este presiunea produsa in cavitatea abdominal, ea variaza cu
respiratia si este normal sub 10 mmHg. Ar trebui intotdeauna sa
fie masurata la sfarsitul expirului in pozitie de decubit
dorsal.
Patologia PIA
Evident, patologia PIA este o continua
insiruire, de la cresteri usoare ale PIA fara efecte
adverse semnificative clinic la cresteri substantiale ale PIA cu
consecinte grave pentru aproape toate organelle si sistemele.
Desi folosirea unui singur parametru PIA pentr a define HIA poate fi
pusa sub semnul intrebarii, este important sa se ajunga la
un consens asupra acestui punct in viitor. Un test accepta pentru a identyifica
HIA va facilita acuratetea interpretarii datelor derivate de la
diferite institutii sau studii individuale. Current, definirea HIA in
literatura variaza cel mai comun intre 12 si 25 mmHg.
2,12,15,18,27,42,44-49. Unele studii au aratat efecte de deteriorare a
functiiei organelor dupa cresteri usoare ale PIA de 10 sau
15 mmHg. 3,31,33,38,50,51. Recent si pana acum singurul, a fost efectuat un studiu multicentr ce
a avut ca scop stabilirea prevalentei, etiologiei si factorilor predispozanti
asociati cu HIA pe o populatie mixta de pcienti de terapie
intensiva. HIA a fost definita ca o valoare maxima a PIA de 12
mmHg sau mai mult obtinuta la cel putin o masurare. 2.
Pana la stabilireaunui consens acceptat
universal in definirea HIA si in scopul de a exclude cresteri
temporare, scurte ale PIA care nu sunt semnificative clinic, autorii acestui
capitol propun ca HIA sa fie definita cao valoare PIA de varf
≥12 mmHg care este inregistrata de doua masurai ale
presiunii care sunt effectuate la un interval de 1-6 ore.
Dupa stabilirea unui preg minim pentru
definirea HIA, este necesara stratificarea valorilor PIA patologice pentru
a calibra si a cuantifica potentialul de producer a unor
manifestari clinice semnificative. In final, un asemenea system de
stratificare ar putea fi folosite ca un indicator pentru variatele
interventii terapeutice. In 1996 Burch si col au prezentat un system
gradat pe 4 nivele pe care trebuie sa se bazeze tratamentul. Transformand
din unitati de cm H2O folosit
scala original in valori mmHg,
gradul I - 7,5-11 mmHg (10-15 cm H2O)
gradul II - 11-18 mmHg (15-25 cm H2O)
gradul III - 18-25 mmHg (25-35 cmH2O)
gradul IV - >25 mmHg (>35cmH2O).
Ei au recomandat ca tratament pentru HIA de
gradele I si II sa fie in principal conservator in timp tratamentu
pentru gradele III si IV implica interventii operatorii.
Xxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxx
Xxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxx
Xxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxxx
Capitolul
4 Cosmin
Presiunea de perfuzie Abdominala
Michael L. Cheatham si Manu L. N. G.
Malbrain
Rezumat
Cresterea presiunii intra-abdominale (PIA)
este intalnita in mod obisnuit la pacientii critici si se
asociaza cu o morbiditate si mortalitate semnificativa. 'PIA
critica' ce produce disfunctie de organ difera de la pacient
la pacient in functie de fiziologia si comorbiditatile
preexistente ale fiecaruia. Prin urmare, o singura valoare-prag a PIA
nu poate fi folosita pentru luarea deciziilor clinice la toti
pacientii critici. Calcularea 'Presiunii de perfuzie
abdominala' (PPA), definita ca Presiunea arteriala medie (PAM)
minus PIA, estimeaza nu numai severitatea PIA existente, dar si
daca debitul sanguin al pacientului este adecvat. PPA este superioara
si fata de PIA si fata de end-point-urile
generale de resuscitare ca pH-ul, deficitul de baze si lactatul din
sangele arterial, in ce priveste capacitatea sa de a stabili prognosticul
si de a fi un parametru util pentru ghidarea resuscitarii si
managementului pacientului cu HIA sau ACS.
Introducere
Desi au fost observate acum aproape 150
de ani, implicatiile fiziopatologice ale presiunii intra-abdominale
crescute au fost de fapt redescoperite doar in deceniul trecut. PIA crescuta
sau 'Hipertensiunea intra-abdominala' (HIA) este acum in mod
obisnuit identificata la pacientii critici, si
recunoscuta drept cauza a unei morbiditati si
mortalitati semnificative. HIA a fost recunoscuta ca un sir
de modificari fiziopatologice incepand cu perturbarea fluxului sanguin
regional si in final culminand cu insuficienta organica
indusa de PIA, denumita 'Sindrom de compartiment abdominal'
(ACS). Un studiu epidemiologic multicentric recent a descoperit ca HIA
(definita ca PIA≥12 mmHg) a fost prezenta la 51% din
pacientii medicali si chirurgicali de la terapie intensiva
(ICU), iar ACS (definita ca PIA≥20 mmHg cu una sau mai multe
insuficiente de organ) a fost gasit la 8%. Prevalenta PIA
crescute la pacientii care ajung la insuficienta organica
sugereaza ca HIA poate foarte bine sa joace un rol major in
dezvoltarea insuficientei organice multiple (MSOF), o cauza
majora a mortalitatii in ICU.
Faptul
ca HIA este greu de descoperit numai prin examenul fizic, complica
si mai mult diagnosticul si managementul acestor pacienti
critici. PIA crescuta poate usor sa ramana
nedescoperita, rezultand o importanta disfunctie si
insuficienta organica. Masurarea PIA, cel mai adesea prin
masurarea surogat a presiunii intravezicale, a fost identificata ca
esentiala pentru diagnosticul si tratamentul corect al
pacientilor cu HIA sau ACS. Avand in vedere prevalenta HIA in ICU,
dificultatea diagnosticului, si morbiditatea si mortalitatea
asociate, trebuie subliniata importanta masurarii PIA,
identificarii prezentei insuficientei de perfuzie, si a
restabilirii perfuziei sistemice si regionale la nivel de organ la
pacientii cu HIA sau ACS.
the detrimental effects of
elevated PIA has evolved, so has our understanding of what constitutes HIA.
Desi primele studii au sugerat ca o PIA
de 30 pana la 40 mm Hg ar fi acceptabila, acum se recunoaste
ca si cresteri mici ale PIA la 10-15 mmHg pot sa aiba
un impact enorm asupra perfuziei organelor si asupra prognosticului
pacientului. Prin urmare, definitia HIA a necesitat o ajustare
continua de-a lungul anilor, iar valoarea 'PIA critice' care
necesita interventia terapeutica a fost micsorata. De asemenea au fost extinse categoriile de pacienti cu risc pentru
HIA si ACS. Considerate initial ca apar la pacientii cu
traumatisme, acum se stie ca HIA si ACS apar practic la toate
categoriile de pacienti. Rapiditatea instalarii si prezenta
comorbiditatilor s-a constatat ca au un impact semnificativ
asupra prezentarii clinice si managementului PIA crescute. Varsta,
obezitatea, sarcina, mecanismul injuriei, difunctia sau insuficienta
pulmonara, cardiaca sau renala, necesitatea ventilatiei mecanice
si aparitia SIRS, au fost recunoscute ca factori ce
influenteaza evolutia si tratamentul acestor bolnavi
critici.
La
inceputul procesului de intelegere a HIA si ACS s-a incercat
gasirea unei singure valori-prag a PIA care sa poata fi
folosita simplu si universal pentru luarea deciziilor la
pacientii critici cu HIA. 'PIA critica' ce necesita
interventia terapeutica poate fi considerata 'graalul'
cercetarii HIA si ACS. Totusi, o astfel de abordare
simplifica prea mult un proces fiziologic care de fapt este foarte complex
si variabil. Desi PIA este un factor determinant major al
prognosticului pacientului critic, PIA care defineste HIA si ACS in
mod evident difera de la pacient la pacient si chiar in cazul
aceluiasi pacient, in functie de evolutia bolii. In intervalele
acceptabile clinic, PIA este un predictor specific, dar insensibil al
severitatii bolii si al caracterului adecvat al
resuscitarii. Cresterea sensibilitatii diagnostice a PIA ar
necesita ca pacientii sa fie lasati sa aiba
valori ale PIA mai mari. Dar se stie ca astfel de valori ale HIA
produc tulburari de perfuzie organica, si o astfel de
practica ar fi inacceptabila clinic, avand in vedere nivelul actual
de intelegere a morbiditatii si mortalitatii HIA.
Astfel, cu toate ca este o metoda utila de screening, PIA nu are
o sensibilitate suficienta pentru a fi folosita ca enpoint al
resuscitarii. Tinand cont de variabilitatea marcata a valorilor PIA
la pacientii critici, este putin probabil ca se putea folosi
vreodata o singura valoare-prag la toti pacientii critici.
O
abordare alternativa pentru imbunatatirea
sensibilitatii PIA este incorporarea ei in modul de evaluare a
perfuziei abdominale ca endpoint al resuscitarii. Asemanator cu
notiunea unanim acceptata de presiune de perfuzie cerebrala (PPC),
calculata ca presiunea arteriala medie (PAM) minus presiunea
intracraniala (PIC), presiunea de perfuzie abdominala (PPA),
calculata ca PAM minus PIA, a fost propusa drept un marker mai precis
al bolii critice si endpoint al resuscitarii.
PPA = PAM - PIA
Acest capitol evalueaza suportul
stiitific si potentialul folosirii clinice a PPA in
managementul pacientilor cu HIA si ACS.
Fiziologie
PIA crescuta produce o deteriorare
semnificativa a functiei cardiace, pulmonare, renale,
gastrointestinale si hepatice, fiecare organ avand o vulnerabilitate
particulara. PIA care poate tulbura perfuzia unui organ poate avea un
efect mult mai mic asupra altuia. Acest raspuns diferentiat,
impreuna cu susceptibilitatea crescuta la PIA observata la pacintii cu hipovolemie si
comorbiditati asociate, complica managementul acestor
pacienti critici si impune folosirea PIA ca endpoint al
resuscitarii. Este importanta determinarea presiunii de perfuzie
si nu doar a presiunii din compartiment. Efectul daunator al PIA
asupra fiecarui organ in parte este discutat in detaliu in alte capitole;
in continuare sunt rezumate aspectele proeminente care justifica folosirea
PIA si PPA ca endpointuri ale resuscitarii.
Cardiovascular
Dupa cum a
descris-o initial Emerson in urma cu peste 80 de ani, cresterea PIA
mareste presiunea intratoracica prin deplasarea cefalica a
diafragmului. Presionea intratoracica crescuta reduce semnificativ
intoarcerea venoasa si debitul cardiac, si comprima aorta
si parenchimul pulmonar, cu cresterea rezistentei vasculare
sistemice. S-a demonstrat ca aceste modificari apar la o PIA de numai
10 mmHg. Pacientii hipovolemici, cei cu contractilitate cardiaca
scazuta si cei care necesita ventilatie mecanica
cu presiune pozitiva par sa sufere reduceri ale debitului cardiac la
valori mai mici ale PIA decat pacientii normovolemici.
Pulmonar
Cresterile
presiunii intratoracice, prin ridicarea diafragmului, duc la compresiunea
extrinseca asupra parenchimului pulmonar cu aparitia atelectaziei
alveolare, scaderea difuziunii oxigenului si a dioxidului de carbon
prin membrana alveolo-capilara si cresterea fractiei de
sunt intrapulmonar si a spatiului mort alveolar. Aceste
disfunctionalitati incep la o PIA de 15 mmHg si sunt
accentuate de prezenta hipovolemiei. Combinate, aceste efecte duc la
hipoxemia arteriala si hipercarbia care caracterizeaza ACS.
Renal
PIA crescuta
reduce semnificativ fluxul arterial renal si comprima vena
renala, ducand la disfunctie si insuficienta
renala. Oliguria apare la o PIA de 15 mmHg si anuria la 30 mmHg in
prezenta normovolemiei, si la valori mai mici ale PIA la pacientul cu
hipovolemie. Presiunea de perfuzie renala (RPP) si gradientul de
filtrare renala (FG) au fost propusi ca factori-cheie in
aparitia insuficientei renale indusa de PIA. FG este forta
mecanica de la nivelul glomerulului si este egala cu
diferenta dintre presiunea de filtrare glomerulara (GFP) si
presiunea din tubul proximal (PTP).
FG = GFP - PTP
In prezenta HIA
se poate admite ca PTP este egala cu PIA, si GFP se
calculeaza ca PAM - PIA. FG se calculeaza dupa formula:
FG = PAM - 2 x PIA
Astfel,
modificarile PIA au un impact mai mare asupra functiei renale si
a productiei de urina decat modificarile tensiunii arteriale
medii (PAM). Astfel nu este surprinzator ca scaderea
functiei renale, evidentiata de aparitia oliguriei, este
unul dintre primele semne vizibile ale HIA.
Gastrointestinal
Intestinul pare sa fie deosebit de
sensibil la HIA, si practic toate organele intraabdominale si
retroperitoneale prezentand scaderea fluxului sanguin in prezenta PIA
crescute. Reduceri ale fluxului sanguin mezenteric apar la o PIA de numai 10
mmHg. Fluxul sanguin in artera celiaca este redus cu pana la 43%, iar
in artera mezenterica superioara cu pana la 69% in prezenta
unei PIA de 40 mmHg. Efectele negative ale PIA asupra perfuziei mezenterice
sunt amplificate de prezenta hipovolemiei sau a hemoragiei. Ischemia
intestinului si perfuzia inadecvata initiaza un cerc vicios
de inrautautatire a perfuziei, permeabilitate capilara
crescuta, scaderea pH-ului mucoasei, si acidoza
metabolica sistemica. O PIA de 20 mmHg diminua perfuzia mucoasei
intestinale si a fost propusa ca posibil mecanism pentru
aparitia ulterioara a translocatiei bacteriene, a sepsisului
si a MSOF. S-a demonstrat ca translocatia bacteriana in
nodulii limfatici mezenterici apare in prezenta hemoragiei la o PIA de
numai 10 mmHg.
Hepatic
Fluxul in artera
hepatica este afectat direct de scaderea debitului cardiac
indusa de PIA, iar fluxul sanguin al venei hepatice si al venei porte
este redus prin compresiune extrinseca. Aceste modificari au fost
observate la cresteri ale PIA de numai 10 mmHg si in prezenta
unui debit cardiac si a unei presiuni arteriale medii normale.
Teorie
Presiunea de
perfuzie dintr-un compartiment anatomic depinde de trei factori:
1. Presiunea
influxului arterial
2. Presiunea
afluxului venos
3. Complianta
sau abilitatea compartimentului de a se dilata ca raspuns la
cresterea volumului. Probabil ca cea mai acceptata exemplificare
a presiunii de perfuzie este in cazul traumatismului cranian. Deoarece creierul
este inchis intr-o 'cutie' osoasa si in general nu poate
poate sa se expandeze dincolo de limitele craniului, complianta
craniana este nesemnificativa si PPC se calculeaza ca
influx arterial (PAM) minus eflux venos (PIC). PAM este determinata
de volumul intravascular,
contractilitatea cardiaca, si rezistenta vasculara
sistemica, iar PIC depinde de volumul creierului, al lichidului
cefalorahidian, al sangelui intracranian si al oricarui proces
inlocuitor de spatiu, cum ar fi un hematom sau o tumora. Dupa
Doctrina Monro-Kellie, o crestere a volumului uneia sau mai multora din
aceste patru componente ale craniului va duce la o crestere a PIC.
Optimizarea PPC se face fie prin cresterea PAM (prin folosirea
adecvata a rescitarii lichidiene si a vasopresoarelor), sau prin
scaderea PIC (prin administrarea de diuretice, drenajul LCR, sau evacuarea
proceselor inlocuitoare de spatiu). Este interesant faptul ca studii
recente au readus in discutie conceptul de hemicraniectomie (indepartarea
unei portiuni mari din calota craniana) pentru a mari
complianta craniana, asa cum decompresiunea abdominala
creste complianta cavitatii abdominale. Perfuzia
abdominala poate fi considerata asemanatoare cu a
creierului (Tabelul 1).
Tabelul 1. Compartimentele
cranian si abdominal
|
Abdomen
|
Craniu
|
|
Organ(e)
|
Ficat, splina, rinichi, stomac,
intestine
|
Creier
|
|
Fluid(e)
|
SCAita, aer, fecale
|
Lichid cefalorahidian
|
|
Delimitare
|
Peretii abdominali
|
Cutia craniana
|
|
Leziuni
|
Sange, edem, SCAita, aer, tumori
|
Tumori, hematoame
|
|
Presiune
|
PIA
|
PIC
|
|
Perfuzie
|
PPA = PAM - PIA
|
PPC = PAM - PIC
|
PIC: presiunea
intracraniana; PIA: presiunea intraabdominala; PPC: presiunea de
perfuzie cerebrala; PAM: presiunea arteriala medie; PPA: presiunea de
perfuzie abdominala
Abdomenul
contine mai multe organe solide (ficatul, rinichii, splina, etc) si
fluide (sange, urina, continut intestinal) cu complianta
limitata, dar si organe cavitare care contin aer (stomacul,
intestinul subtire, colonul) cu distensibilitate marcata, si
spatii potentiale (peritoneul, retroperitoneul) care pot sa se
mareSCAa semnificativ ca raspuns la o leziune sau boala.
Abdomenul poate sa contina si procese patologice
inlocuitoare de spatiu, cum ar fi sange, aer, SCAita, sau o
tumora. La fel ca in creier si conform cu doctrina Monro-Kellie, o crestere a volumului continutului
cavitatii abdominale va duce la o crestere a PIA. Desi nu
este inchis intr-un invelis rigid cum este creierul, abdomenul nu este
nici pe departe perfect compliant si expansibil. Unele parti din
abdomen, cum ar fi coloana vertebrala, pelvisul si arcurile costale
sunt rigide, in timp ce altele, ca diafragmul si in special peretele
abdominal, sunt compliante numai pana la un punct determinat de
diversi factori.
Varsta,
obezitatea, musculatura peretelui abdominal, sarcina si chirurgia
abdominala pot sa altereze complianta peretelui abdominal.
Durerea si edemul spatiului 3 de asemenea reduc complianta
si maresc efectele negative ale PIA crescute. Toti acesti
factori pot sa aiba un impact semnificativ asupra
capacitatii pacientului de a tolera HIA, ca si asupra
adecvabilitatii perfuziei abdominale.
Studii clinice
In 2000, Cheatham et al au propus pentru prima
data folosirea PPA ca factor predictiv al supravietuirii la
pacientii cu HIA sau ACS. A fost facut un studiu retrospectiv care a
evaluat toti pacientii admisi intr-o unitate de terapie
intensiva cu profil chirurgical / traumatologic, care prezentau semne ale HIA
(definita ca PIA ≥ 15 mmHg). S-a instituit monitorizarea PIA atunci
cand au fost prezente unul sau mai multe semne ale disfunctiei organice
induse de HIA, aici fiind incluse distensia abdominala, oliguria
refractara la resuscitarea volemica, hipercarbia, hipoxemia
refractara la cresterea FiO2 si a PEEP, presiuni
inspiratorii de varf mari, sau hipotensiunea refractara. Monitorizarea PIA
a fost instituita si in absenta acestor semne daca
clinicianul banuia prezenta unei PIA crescute. A fost
masurata presiunea intravezicala din 4 in 4 ore folosind tehnica
descrisa de Cheatham and Safcsak, pana cand PIA s-a normalizat sau
masuratorile au fost constante si nu s-a mai considerat ca
pacientul risca sa faca disfunctie organica din cauza HIA.
S-au urmarit endpointurile obisnuite ale resuscitarii: pH-ul,
deficitul de baze, lactatul arterial, si diureza orara.
Decompresiunea abdominala deschisa si inchiderea temporara
a abdomenului au fost facute in cazul HIA simptomatice sau aparitiei
ACS (definit ca PIA ≥ 25 mmHg insotita de unul sau mai multe
semne de insuficienta organica indusa de HIA). Analiza
regresiei logistice multivariate a identificat acele variabile fiziologice
si endpointuri ale resuscitarii care se coreleaza in mod
semnificativ cu supravietuirea.
In
cele 25 de luni cat a durat studiul, la 144 de pacienti (68% pacienti
cu traumatisme, 14% de chirurgie generala, 14% chirurgie vasculara,
2% chirurgie colorectala, si 2% de obstetrica-ginecologie) le-au
fost facute 2298 de masurari ale PIA in timpul tratamentului HIA
si ACS. PIA medie pentru toti pacientii a fost de 22 ± 8 mm Hg
(interval 2-94), in ciuda aplicarii liberale a decompresiunii abdominale.
Pacientilor li s-a monitorizat PIA in medie 2-3 zile (interval 1-11 zile),
timp in care s-au facut 16 ± 14 masuratori (interval 1-61).
Mortalitatea totala a fost de 53%. Un numar semnificativ mai mic de
pacienti au facut ACS in a doua jumatate a studiului (64%
fata de 43%; p = 0.01) si mortalitatea a scazut
semnificativ (44% fata de 28%; p = 0.049) ca rezultat al
educarii medicilor si al cresterii acceptabilitatii
decompresiunii abdominale.
Analiza
regresiei logistice multivariate a demonstrat ca PIA, PAM, PPA, lactatul arterial, pH-ul arterial, deficitul de baze
si debitul urinar pe ora influenteaza supravietuirea
pacientilor cu HIA, iar debitul urinar pe ora si PPA au valoarea
predictiva cea mai mare (Tabelul 2).
Tabelul 2.
Parametrii resuscitarii in HIA/ACS aranjati dupa
supravietuire
|
Supravietuitori
|
Decese
|
Relevanta
Regresiei Logistice Multiple
|
|
Debitul urinar
pe ora (ml/h)
|
|
|
< 0.0001
|
|
PPA (mm Hg)
|
|
|
|
|
Acidul lactic
arterial L (mmol/L)
|
|
|
|
|
PAM (mm Hg)
|
|
|
|
|
pH-ul arterial
|
|
|
|
|
Deficitul de
baze
|
|
|
|
|
PIA (mm Hg)
|
|
|
|
PAM: tensionea
arteriala medie; PIA: presiunea intra-abdominala; PPA: presiunea de
perfuzie abdominala
O analiza care a folosit valorile cele mai rele ale parametrilor
masurati in timpul resuscitarii a gasit ca valoarea
cea mai mica a PPA este semnificativ mai buna fata de
alti parametri pentru stabilirea prognosticului pacientului cu HIA
(Tabelul 3).
Au fost calculate curbele ROC (Receiver operator
characteristic, curba caracteristica performantei unui test) pentru PIA si PPA pentru a identifica
acele valori prag ale fiecarui parametru - care au valoarea
predictiva cea mai mare pentru prognostic. Curba ROC consta in
reprezentarea pe un grafic a sensibilitatii unui test diagnostic
(procentul de rezultate real pozitive) pe abscisa, fata de
1-specificitate (procentul de rezultate fals pozitive) pe ordonata -
si este apreciaza bine valoarea discriminatorie a unui test, deoarece
curbele ROC iau in consideratie toate valorile prag posibile. Un test
diagnostic cu valoare predictiva de 100% are suprafata de sub curba
ROC egala cu 1,0 , iar un test care prezice supravietuirea din
intamplare are suprafata de sub curba ROC egala cu 0,5. Se
considera ca punctul de pe curba ROC situat cel mai aproape de
coltul din stanga-sus optimizeaza sensibilitatea si
specificitatea testului.
In acest studiu, aria de sub curba ROC
a fost 0.726 pentru PPA si 0.748 pentru PIA (Figura 1; PIA a fost
trasata in functie de mortalitate si nu fata de
supravietuire cum era in studiul original).
Figura 1. Curbele
ROC pentru PIA si PPA si punctele importante pentru luarea deciziilor
clinice.
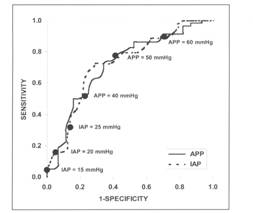
Desii ariile
de sub curbele ROC pentru PPA si PIA nu sunt diferite statistic, aceste
curbe demonstreaza ca sensibilitatea si specificitatea PPA sunt
superioare fata de PIA pentru luarea deciziilor clinice. (Tabelul 4).
Tabelul 4. Sensibilitatea
si specificitatea PPA, PAM si PIA pentru prognosticul
supravietuirii la pacienti cu hipertensiune intraabdominala
si sindrom de compartiment abdominal.
|
Cheatham
|
Malbrain
|
CHIA
|
|
SENS
|
SPEC
|
SENS
|
SPEC
|
SENS
|
SPEC
|
|
PPA
|
|
|
|
|
|
|
|
40 mm Hg
|
|
|
|
|
|
|
|
50 mm Hg
|
|
|
|
|
|
|
|
60 mm Hg
|
|
|
|
|
|
|
|
70 mm Hg
|
|
|
|
|
|
|
|
PAM
|
|
|
|
|
|
|
|
60 mm Hg
|
|
|
|
|
|
|
|
70 mm Hg
|
|
|
|
|
|
|
|
80 mm Hg
|
|
|
|
|
|
|
|
PIA
|
|
|
|
|
|
|
|
12 mm Hg
|
|
|
|
|
|
|
|
15 mm Hg
|
|
|
|
|
|
|
|
20 mm Hg
|
|
|
|
|
|
|
|
25 mm Hg
|
|
|
|
|
|
|
|
30 mm Hg
|
|
|
|
|
|
|
|
35 mm Hg
|
|
|
|
|
|
|
|
40 mm Hg
|
|
|
|
|
|
|
Mentinerea
unei PPA de cel putin 50 mmHg pare sa maximizeze sensibilitatea (76%)
si specificitatea (57%) PPA ca predictor al supravietuirii. PAM de 70
mmHg, utilizata de obicei ca parametru al resuscitarii are o
sensibilitate de numai 57% si o specificitate de 61%. Desi o valoare
a PIA de 30 mm Hg are o sensibilitate de 70% si o specificitate de 72%,
acest endpoint depaseste valorile care sunt considerate acum
acceptabile clinic, si ar supune pacientul unui risc de perfuzie
organica insuficienta. In intervalul acceptat actual de 10 pana
la 25 mm Hg, PIA a avut specificitate, dar nu si sensibilitate pentru
stabilirea prognosticului. PPA pare sa fie superior clinic ca endpoint al
resuscitarii si predictor al supravietuirii in tratamentul HIA
si ACS, deoarece ea are legatura nu numai cu severitatea HIA,
dar si cu caracterul adecvat al perfuziei organelor.
Pentru a evalua
validitatea clinica a diferitilor parametri ai resuscitarii la
pacientii cu HIA, inclusiv a PPA, Malbrain et al au evaluat prospectiv 8
pacienti tratati de catre chirurgi cu un corset abdominal pentru
a reduce dehiscenta postoperatorie si hernia incizionala. S-a
observat ca PIA creste semnificativ dupa aplicarea braului
abdominal, cu scaderi semnificative ale debitului cardiac si
cresteri ale presiunii venoase centrale si a presiunii de ocluzie a
arterei pulmonare dupa 30-45 de minute. Odata cu cresterea PIA
perfuzia viscerala s-a inrautatit, fapt indicat de
scaderea PPA, FG, a pH-ului arterial, a pH-ului intramucos (pHi) si a
diferentei dintre PCO arterial si gastric (CO2-gap). Adaugarea unui PEEP
de 15 cm H2O combinat cu PIA crescuta are un si mai mare
efect negativ asupra PPA si a perfuziei viscerale. Aceste efecte au fost
reversibile la desfacerea corsetului abdominal (simuland decompresiunea
abdominala) si la scaderea PEEP. Acest studiu a confirmat
impactul negativ semnificativ al PIA crescute si al presiunii
intratoracice asupra PPA si a perfuziei viscerale. Decompresiunea
abdominala a marit PPA li a scazut PIA, restabilind perfuzia
abdominala. S-a observat ca markerii regionali ai perfuziei adecvate
cum ar fi PPA, FG, pHi si CO2-gap se modifica mai repede
decat indicii generali ca PAM, pH-ul arterial, deficitul de baze si
bicarbonatul calculat (HCO3), ceea ce sugereaza ca
markerii regionali sunt superiori ca si parametri ai resuscitarii.
Ulterior Malbrain et al au studiat
prospectiv aparitia HIA la 405 pacienti internati intr-o unitate
de TI mixta, intr-o perioada de 12 luni. PIA a fost evaluata de
rutina la toti pacientii si au fost notate valorarea PIA
maxime si valoarea cea mai mica a PPA din primele 72 de ore. HIA
(definita ca PIA>12 mm Hg) a fost asociata cu o valori
semnificativ mai mari ale mortalitatii in Terapie Intensiva (65% vs. 8%; p<0.0001) si ale mortalitatii
intraspitalicesti (69% vs. 18%; p<0.0001). PPA a fost semnificativ mai
mica la cei care nu au supravietuit (61 ± 23 vs. 76 ± 23 mm Hg;
p<0.0001), la fel a fost si PAM (72 ± 22 vs. 83 ±22 mm Hg;
p<0.0001), in timp ce PIA a fost semnificativ mai mare (11± 5 vs. 7±4 mm Hg;
p<0.0001). S-a constatat ca o PPA de 60 mm Hg are o sensibilitate de
55% si o specificitate de 76% pentru prezicerea supravietuirii, iar o
PAM de 70 mm Hg are o sensibilitate de 58% si o specificitate de 64%
(Tabelul 4).
Tabelul 3.
Parametri care influenteaza prognosticul in HIA/ACS
aranjati in functie de supravietuire.
|
Survivors
|
Non-Survivors
|
Significance of Multiple Logistic Regression
|
|
Lowest PPA (mm Hg)
|
|
|
|
|
Lowest PAM (mm Hg)
|
|
|
|
|
Highest PIA (mm Hg)
|
|
|
|
|
Highest arterial lactate (mmol/L)
|
|
|
|
|
Highest base deficit
|
|
|
|
|
Lowest arterial pH
|
|
|
|
|
Lowest hourly urinary output (mL/h)
|
|
|
|
PAM: presiunea
arteriala medie; PIA: presiunea intra-abdominala; PPA: presiunea de
perfuzie abdominala.
O PIA de 9 mm Hg a
avut cea mai buna sensibilitate (65%) si specificitate (72%) pentru
stabilirea prognosticului pacientului, totusi aceasta valoare a PIA
poate sa fie nerealista pentru o populatie de pacienti cu
stare mult mai grava. Cum numai 18% din pacientii din acest studiu au
avut semne de HIA si numai 2% au avut ACS (definit ca PIA>20
mm Hg), rezultatele acestui studiu sugereaza faptul
ca PPA se poate folosi ca endpoint al resuscitarii nu numai la
pacientii cu HIA sau ACS, ci si la categoria mai larga a tuturor
pacientilor din Terapie Intensiva.
Grupul de studiu CHIA
(The Critically Ill and Abdominal Hypertension) a facut ulterior un studiu
prospectiv multicentric international in care la 257 pacienti s-a
facut screening pentru HIA (definita ca PIA≥12 mm Hg). Au fost
47% pacienti medicali, 28% chirurgie programata, 17% chirurgie de
urgenta si 9% traumatisme. Mortalitatea generala a
pacientilor in spital a fost 35% (48% la pacientii medicali, 11% la
cei cu operatii programate, 44% in chirurgia de urgenta, si
18% la traumatisme). Situatiile care s-au asociat cu aparitia HIA
includ acidoza, hipotermia, transfuziile multiple, resuscitarea volemica,
tulburarile de coagulare, sepsisul, chirurgia abdominala, ileusul,
si disfunctia hepatica. PIA a fost corelata semnificativ cu
aparitia insuficientei organice si cu mortalitatea. PPA a fost
semnificativ mai mica la pacientii care nu au supravietuit (54 ± 16 vs. 69 ±23 mm Hg; p<0.0001); la fel a fost
si PAM (68 ± 15 vs. 81 ±23 mm Hg; p<0.0001), in
timp ce PIA a fost semnificativ mai mare (15 ± 6 vs. 12 ± 5 mm Hg;
p<0.0001). In subgrupul celor 145 de pacienti cu HIA, PPA a fost de
asemenea semnificativ mai mica la cei care nu au supravietuit (52 ±
14 vs. 65 ± 23 mm Hg; p<0.001), in timp ce PIA nu a mai fost diferita
(17 ± 5 vs. 17 ±4 mm Hg), confirmand superioritatea folosirii PPA ca predictor
al prognosticului clinic. Aria de sub curba ROC a fost 0,732 pentru PPA si
0,678 pentru PIA. O PPA de 60 mm Hg a avut cea mai buna sensibilitate
(79%) si specificitate (62%), in timp ce o PAM de 70 mm Hg a avut o
sensibilitate de 69% si o specificitate de 61%. O valoare-prag a PIA de 12
mm Hg a avut o sensibilitate de 75% si o specificitate de 59%.
Pe baza acestor studii grupul de
studiu CHIA a recomandat mentinerea PPA peste 60 mm Hg si a PIA sub
12 mm Hg pentru optimizarea prognosticului pacientului.
Studiul CIRFAH (Critically Ill Renal
Failure and Abdominal Hypertension) a evaluat prospectiv PIA si PPA ca
predictori ai prognosticului la 60 de pacienti cu insuficienta
renala acuta (IRA) (definita de o creatinina serica
> 2 mg/dL). Intr-o perioada de 12 luni, pacientilor admisi
cu, sau care au facut IRA in timpul stationarii in Terapie
Intensiva, li s-a facut screening pentru HIA (definita ca PIA>12
mm Hg) prin masurarea presiunii intravezicale. PIA a fost notata de
doua ori pe zi impreuna cu valoarea PPA maxime si minime,
balanta hidrica, si scorul SOFA (Sequential Organ Failure
Assessment). Au fost 78% pacienti medicali si 22% pacienti
chirurgicali. Scorul renal SHARF-II (Stuivenberg Hospital Acute Renal Failure)
a fost 67 ± 22 la admisie si 76 ± 24 dupa 48 de ore. Scorul SOFA in
prima zi a fost 9,4 ± 3,5 cu 1,7 ± 1,1 insuficiente organice. PIA in prima
zi a fost 12 ± 5 mm Hg, iar PPA a fost 55 ± 18 mm Hg. PIA maxima dupa
48 de ore (PIAmax) a fost 14 ± 6 mm Hg. HIA > 12 mm Hg in primele 48 de ore
de la includerea in studiu a fost gasita la 63% dintre pacienti.
Datele de la 46 de pacienti indica o mortalitate la 28 de zile de
63%. Prognosticul nu a fost diferit prin prezenta HIA, desi cei care
nu au supravietuit au avut o PIA semnificativ mai mare si o PPA mai
mica in ziua a treia (Figura 2).
Figura 2. Evolutia PIA si PPA la
pacientii cu insuficienta renala acuta
clasificati in supravietuitori si nesupravietuitori.
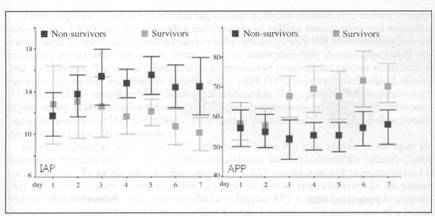
A existat o
tendinta spre o balanta hidrica zilnica
pozitiva si o balanta hidrica neta
cumulativa pozitiva la cei care nu au supravietuit. Astfel
incidenta HIA este mare la pacientii cu IRA si se asociaza
cu o mortalitate semnificativa care este subestimata de scorurile de
gravitate clasice. Scorul SHARF-II prezice mai bine prognosticul acestor
pacienti. Persistenta HIA si a unei PPA mici pana in ziua a
treia a facut distinctia dintre supravietuitori si
nesupravietuitori. Monitorizarea indeaproape a PIA si PPA este astfel
justificata la pacientii cu IRA.
Aplicatii clinice
Tratamentul
inceput devreme cu scopul de a restabili perfuzia prganelor si aportul de
oxigen la nivel celular este esential pentru reducerea
morbiditatii si mortalitatii. Deoarece PIA
critica difera de la pacient la pacient, doar PIA singura nu
poate fi folosita ca scop terapeutic la aceasta categorie de
pacienti. PPA, calculata ca PAM minus PIA, evalueaza nu numai
severitatea PIA, dar si caracterul adecvat al perfuziei abdominale. PPA
este o marime usor de calculat care s-a demonstrat ca
depaseste rata de predictie clinica a PIA in primele
trialuri clinice. PPA imbunatateste sensibilitatea PIA
mentinand specificitatea diagnostica, si pare sa se
coreleze bine cu perfuzia viscerala. Timpul si studiile viitoare vor
stabili daca PPA sau poate un alt parametru al resuscitarii inca
nedefinit, isi vor dovedi utilitatea in studii clinice mari.
Coreland rezultatele studiilor de
mai sus cu literatura deja disponibila referitoare la consecintele
fiziopatologice ale HIA si managementul ACS, se poate propune un algoritm
pentru managementul adecvat al pacientului cu PIA crescuta (Figura 3).
Figura 3. Algoritm
pentru resuscitarea HIA / ACS.

In primul rand,
masuratorile seriate ale PIA trebuie facute cu generozitate la
pacientii critici, din cauza incidentei crescute a HIA la acesti
pacienti si a morbiditatii si mortalitatii
sale. Din cauza ca examinarea fizica este insuficienta
pentru identificarea PIA crescute, in prezent masuratorile seriate
ale PIA sunt singura metoda disponibila prin care HIA se poate
diagnostica cu acuratete si se poate directiona tratamentul.
Monitorizarea presiunii intravezicale poate fi facuta rapid si
necostisitor fara echipament specializat de monitorizare, folosind
materiale disponibile in orice Terapie Intensiva.
In al doilea rand, decompresiunea
abdominala imediata trebuie facuta la orice pacient care
prezinta cresteri semnificative ale PIA sau semne de ACS. La
pacientii chirurgicali asta se poate face fie prin crearea sau prin
redeschiderea inciziei de laparotomie si inchiderea temporara a
abdomenului. In functie de stabilitatea hemodinamica, acest lucru se
poate face fie in sala de operatie sau la patul pacientului din Terapie
Intensiva. Nu trebuie sa ne temem de o astfel de procedura sau
sa o amanam, deoarece decomprimarea facuta rapid dupa
diagnosticarea ACS imbunatateste dramatic functia
organelor si supravietuirea. Un studiu recent al prognosticului pe
termen lung a demonstrat lipsa unor deficite reziduale fizice sau mentale
semnificative, si revenirea la o functionalitate normala la 12
luni la pacientii care au necesitat decomprimarea abdominala de
urgenta. La pacientii medicali la care HIA este secundara
acumularii lichidului de SCAita sau a fluidelor folosite la resuscitare,
paracenteza trebuie considerata drept o alternativa viabila la
decompresiunea abdominala deschisa. Lasarea cateterului de
paracenteza pe loc pana cand starea pacientului se stabilizeaza
permite drenajul continuu al lichidului peritoneal, reducerea PIA si o
incidenta redusa a ACS tertiar sau recurent. Pacientii
la care HIA este secundar hemoragiei retroperitoneale, edemului visceral, sau
ileusului vor beneficia cel mai mult de
pe urma decompresiunii abdominale, pentru ca paracenteza nu va reduce
eficient severitatea HIA si nu va restabili perfuzia organelor.
In al treilea rand, la
pacientii cu HIA care nu necesita decomprimarea imediata, PPA
trebuie mentinuta peste 50-60 mm Hg prin resuscitare volemica
si medicatie vasoactiva. Volumul intravascular trebuie
optimizat, iar vasopresoarele sunt rezervate pentru acei pacienti care
continua sa aiba o PPA inadecvata in ciuda
resuscitarii volemice corespunzatoare. Poate fi luata in
considerare masurarea statusului volumului intravascular prin Indicele volumului
ventriculului drept la sfarsitul diastolei (right ventricular
end-diastolic volume index RVEDVI) sau prin masurarea volumului sanguin
intratoracic (intrathoracic blood volume ITBU). Masuratorile
traditionale ale presiunilor de umplere intracardiace cum ar fi Presiunea
de ocluzie a arterei pulmonare (PAOP) si Presiunea venoasa
centrala (PVC) sunt inexacte in prezenta HIA si a presiunii
intratoracice crescute si a pune baza pe acesti parametri poate
conduce la o resuscitare insuficienta.
In al patrulea rand,
imposibilitatea mentinerii unei PPA de cel putin 50 mm Hg este
indicatie pentru decomprimarea abdominala deschisa si
inchiderea temporara a abdomenului pana cand starea clinica a
pacientului se imbunatateste. Odata ce abdomenul a
fost deshis, PIA trebuie monitorizata in continuare deoarece HIA si
ACS, contrar aparentelor pot sa apara si intr-un abdomen
deschis. La un pacient cu abdomenul deschis, imposibilitatea mentinerii
unei PPA adecvate este indicatie pentru o si mai mare decomprimare a
abdomenului fie printr-o laparotomie mai mare sau inchiderea temporara a
abdomenului mai laxa, mai complianta.
Cinci, tentativele de
inchidere a abdomenului dupa decompresiune trebuie ghidate de PIA si PPA. PPA se poate folosi nu numai pentru a lua
decizia dificila de a efectua laparotomia decompresiva, dar si
pentru a rezolva problema adesea si mai grea a alegerii momentului si
a modului de inchidere a abdomenului. In cazul cresterii persistente a PIA
cu valori la limita ale PPA trebuie facuta grefarea cu piele a
viscerelor expuse, si nu trebuie incercata inchiderea peretelui
abdominal sub tensiune. Inchiderea sub tensiune va duce cu siguranta
la recurenta HIA, scaderea perfuziei viscerale si cresterea
riscului dehiscentei.
In concluzie estimarea
PPA este superioara folosirii numai a PIA ca endpoint al resuscitarii
la pacientii cu HIA sau ACS, deoarece PPA evalueaza si
severitatea HIA si perfuzia organelor. PPA este superioara si
markerilor generali ai resuscitarii cum ar fi pH-ul arterial, deficitul de
baze, si acidul lactic arterial, prin capacitatea sa de a identifica rapid
perfuzia viscerala inadecvata. O PPA de 50 mm Hg sau mai mare este
endpointul resuscitarii la pacientul cu PIA crescuta.
Comentarii
Rao R Ivatury
Cheatham and
Malbrain, distinsii mei co-editori si campioni ai cauzei
hipertensiunii intraabdominale si sindromului de compartiment abdominal,
descriu in acest capitol notiunea de presiune de perfuzie abdominala,
care in viitor poate sa revolutioneze modul cum interpretam
presiunea intra-abdominala.
Autorii aduc
dovezi puternice despre motivele pentru care 'presiunea
transmurala' efectiva (presiunea de perfuzie, presiunea de
perfuzie dintr-un compartiment, presiunea transabdominala, presiunea
trans-toracica si altele asemenea), inspirate dupa modelul
presiunii de compartiment de la nivelul membrelor, este important sa nu
fie pierduta din vedere. Autorii argumenteaza convingator
ca PPA este superioara masurarii aleatorii numai a PIA. Ei
propun si o secventa de 5 pasi terapeutici pentru a corecta
o PPA anormal scazuta. Daca credem in conceptul de presiune
transmurala sau presiune de perfuzie care determina perfuzia, ca in
cazul toracelui sau rinichiului, atunci este logic sa urmarim aceste
presiuni de perfuzie (PPA), si nu doar valorile absolute ale presiunii (PIA).
Evident, valabilitatea unui concept,
oricat de solid ar fi el, consta in validarea clinica. Studiile
viitoare, pe baza unor rezultate solide, vor stabili valoarea acestui concept.
Pana atunci este logic sa consideram PPA drept cel mai potrivit
indicator.
2.2. Scopul studiului clinic
2.3. Material si metoda
2.4. Identificarea unor factori
prognostici si de gravitate si stabilirea unei
scale de risc proprie.
2.5. Impactul sistemic in
functie de cauza (ocluzie, SCAita pancreatita,
peritonita etc.)
2.6. Manifestari clinice
sistemice ale sindromului de compartiment.
2.7. Modificari umorale
specifice.
2.8. Metode diagnostice.
2.9. Evaluarea prognosticului,
factori ce influenteaza prognosticul si
valoarea predictiva a lor.
2.10. Conduita terapeutica in functie de etiologie.
Rezultatele studiului.
Discutii pe marginea
rezultatelor.
Factorii evaluati in
stabilirea scorului de gravitate si valoarea predictiva stabilita pe baza unor
calcule matematice.
Concluzii.
4
|
Nr.
Caz: _ _ _ _
|
Data
int: / /200_
|
Data
ext:
| |
|
Nume:
|
Prenume:
|
Varsta:
| |
|
Diagnostic:
_ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _
_ _ _ _
Interventia
chirurgicala: _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _
_ _ _ _ _
Data
interventiei: _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _
_ _ _ _ _ _ _ _ _
Cauza
etiologica a cresterii PIA: _ _ _ _ _ _ _ _ _
_ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _
| |
|
Ziua
de internare:
|
/04
|
/04
|
/04
|
/04
|
/04
|
/04
|
/04
|
/04
|
/04
| |
|
TAM
|
|
|
|
|
|
|
|
|
| |
|
PIA
|
|
|
|
|
|
|
|
|
| |
|
PPA
|
|
|
|
|
|
|
|
|
| |
|
Ziua
de internare:
|
/04
|
/04
|
/04
|
/04
|
/04
|
/04
|
/04
|
/04
|
/04
| |
|
TAM
|
|
|
|
|
|
|
|
|
| |
|
PIA
|
|
|
|
|
|
|
|
|
| |
|
PPA
|
|
|
|
|
|
|
|
|
| |
|
Evaluarea
factorilor predispozanti (anteriori aparitiei SCA):
| |
|
Sepsisul:
|
| |
|
Acidoza:
|
| |
|
Coagulopatii:
|
| |
|
Politransfuzionati:
|
| |
|
Disfunctie
hepatica cu SCAita:
|
| |
|
| |
|
| |
|
Forma
clinica:
|
Hiperacuta:
□
|
Acuta: □
|
Subacuta:
□
|
Cronica:
□
| |
|
Efectele
PIA asupra sistemului respirator:
| |
|
Respira
spontan: □
Ventilat
mecanic: □ (ziua: valoarea)
| |
|
Frecventa:
|
| |
|
Pres
inspir max
|
| |
|
Vol
Tidal
|
| |
|
Auto
PEEP
|
| |
|
CO2
|
| |
|
Oximetria:
|
| |
|
Modificari
radiologice:
| |
|
Aparitia
complicatiilor pulmonare (infectioase):
| |
|
Antecedente
respiratorii:
| |
|
Efectele
PIA asupra sistemului cardiovascular:
| |
|
PVC:
|
| |
|
Debit
cardiac:
|
| |
|
Frecventa
cardiaca:
|
| |
|
Tromboza
venoasa / embolie:
|
| |
|
Stop
cardiac:
|
| |
|
Efectele
PIA asupra SNC
| |
|
Semne
de crestere a presiunii intracraniene:
|
| |
|
Semne
de scadere a perfuziei cerebrale:
|
| |
|
| |
|
| |
|
Efectele
PIA asupra functiei gastro-intestinale:
| |
|
Ex
clinic al abdomenului:
|
| |
|
Circulatie
portocava:
|
| |
|
Efectele
PIA asupra functiei renale
| |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| |
|
Diureza
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| |
|
Semne
clinice:
| |
|
Medicatie
diuretica:
| |
|
Biologic:
| |
|
Sange
|
|
|
|
|
|
|
|
|
| |
|
pH
|
|
|
|
|
|
|
|
|
| |
|
PCO2
|
|
|
|
|
|
|
|
|
| |
|
pO2
|
|
|
|
|
|
|
|
|
| |
|
Bicarbonat
|
|
|
|
|
|
|
|
|
| |
|
VSH
|
|
|
|
|
|
|
|
|
| |
|
Eritrocite
|
4-5,5mil/mm3
|
|
|
|
|
|
|
|
| |
|
HT
|
|
|
|
|
|
|
|
|
| |
|
L
|
4-9000/mm3
|
|
|
|
|
|
|
|
| |
|
T
|
140-440.000/mm3
|
|
|
|
|
|
|
|
| |
|
Fibrinogen
|
200-400mg%
|
|
|
|
|
|
|
|
| |
|
Ser/plasma
|
|
|
|
|
|
|
|
|
| |
|
Amilazemie
|
<120U/l
|
|
|
|
|
|
|
|
| |
|
Fos
alc
|
22-170
U/L
|
|
|
|
|
|
|
|
| |
|
BT
|
0,2-1,1
mg%
|
|
|
|
|
|
|
|
| |
|
BD
|
<0,3
mg%
|
|
|
|
|
|
|
|
| |
|
BI
|
|
|
|
|
|
|
|
|
| |
|
Glicemie
|
70-100
mg/dl
|
|
|
|
|
|
|
|
| |
|
TGO(ASAT)
|
<15;
<19
|
|
|
|
|
|
|
|
| |
|
TGP(ALAT)
|
<19;
<23U/L
|
|
|
|
|
|
|
|
| |
|
Uree
|
10-50
mg/dl
|
|
|
|
|
|
|
|
| |
|
K
|
|
|
|
|
|
|
|
|
| |
|
Creatinina
|
|
|
|
|
|
|
|
|
| |
|
Na
|
|
|
|
|
|
|
|
|
| |
|
Colesterol
|
|
|
|
|
|
|
|
|
| |
|
|
|
|
|
|
|
|
|
| |
|
|
|
|
|
|
|
|
|
| |
|
|
|
|
|
|
|
|
|
| |
|
|
|
|
|
|
|
|
|
| |
|
|
|
|
|
|
|
|
|
| |
|
|
|
|
|
|
|
|
|
| |
|
|
|
|
|
|
|
|
|
| |
|
|
|
|
|
|
|
|
|
| |
|
|
|
|
|
|
|
|
|
| |
|
|
|
|
|
|
|
|
|
| |
|
|
|
|
|
|
|
|
|
| |
|
|
|
|
|
|
|
|
|
| |
|
|
|
|
|
|
|
|
|
| |
|
|
|
|
|
|
|
|
|
| |
|
|
|
|
|
|
|
|
|
| |
|
|
|
|
|
|
|
|
|
| |
|
|
|
|
|
|
|
|
|
| |
|
|
|
|
|
|
|
|
|
| |
|
|
|
|
|
|
|
|
|
| |
|
Tratament
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | | |




















