Imunoexpresia Receptorilor
pentru Hormonii Androgeni in Glanda Mamara Normala si
Tumorala
Lista abrevierilor
ASCO = Societatea Americana de Oncologie
Clinica
Bcl-2 = B-cell lymphoma 2,
protooncogena reglatoare a apoptozei
BRCA = gene tumoral supresoare in cancerul de san
(breast cancer associated)
DAB = diaminobenzidina
DCIS = carcinom ductal in situ
ECD HER2 = domeniul extracelular al HER2
EGF = factorul de crestere epidermal
EGFR = receptorul factorului de crestere
epidermal
ER = receptori estrogenici
ERE = elemente estrogen responsive
G = grad histologic de diferentiere
HER = human
epidermal growth factor receptor (receptorul factorului epidermal de
crestere uman)
HRP = peroxidaza din hrean
IL = interleukine
LCIS = carcinom lobular in situ
LSAB = sistem de marcaj
streptavidina-biotina
PBS = tampon fosfat salin
PR = receptori progesteronici
PSA = antigen specific prostatic
SHBG = globulina de legare a hormonilor sexuali
PARTEA GENERALA 1. Introducere
Spre deosebire de ER si PR al caror rol in patogeneza cancerului
de san este recunoscut, receptorii pentru hormonii androgeni (AR)
au fost mai putin studiati in ceea ce priveste expresia lor in
cancerul mamar si, desi este recunoscut rolul lor in patobiologia
cancerului mamar, mecanismul prin care actioneaza nu este pe deplin
inteles. In acest context, am studiat expresia imunohistochimica a AR
in glanda mamara in functie de tipul histopatologic al tumorii
si gradul histologic, iar rezultatele obtinute le-am corelat cu
parametri imunohistochimici studiati precum si clinici disponibili.
2. Epidemiologia si
Etiopatogenia Tumorilor Mamare
Dupa statisticile publicate de catre Organizatia
Mondiala a Sanatatii, in anul 2006,
mai mult de 1.2 milioane de persoane vor fi diagnosticate cu neoplasm
mamar in intreaga lume. Cancerul de san
este cel mai frecvent diagnosticat dupa cancerul de piele non-melanomic
si a doua cauza de deces dupa cancerul bronhopulmonar.Societatea
Americana de Cancer estimeaza ca in 2006 aproximativ femei din Statele Unite vor fi diagnosticate cu tumori mamare maligne
invazive (Stadiile I-IV). Alte femei vor fi diagnosticate cu neoplasme mamare in situ. Sansa de
dezvoltare a unui cancer de san pe perioada de viata a unei femei
este de 1 la 7 (13.4%). In plus, 1,910 barbati vor fi
diagnosticati cu tumori mamare maligne, iar aproximativ 400 vor deceda in
acest an. Se estimeaza ca femei si barbati vor deceda de cancer mamar in
acest an, in Statele Unite. Depistat precoce, rata de supravietuire la 5
ani depaseste 95%.
Cele
mai multe cazuri provin din tarile industrializate, de exemplu, in
Statele Unite si Europa. Incidenta cancerului de san precum si
rata mortalitatii variaza de la tara la
tara. Rate de mortalitate dintre cele mai mari (25/100.000 de femei)
au fost raportate in tari precum Marea Britanie, Noua Zeelanda,
Olanda si Uruguay, in timp ce rate mai scazute au fost gasite in
tari din Asia de Est, America Latina si Africa. In Statele
Unite, cancerul de san este cel mai frecvent diagnosticat cancer la femei
(incidenta de 32% dintre toate cancerele la femei), in timp ce
mortalitatea specifica este a 2-a dupa cancerul pulmonar.
Incidenta cancerului de san a crescut in intreaga lume in special la
grupele de varsta mai inaintate, astfel, in SUA, din 1980 pana in
2000 se observa o crestere cu circa 4% pe an. In Marea Britanie unde
mortalitatea prin cancer de san este cea mai mare, la femei in varsta de
50 de ani a fost raportata incidenta de 2/1000 de femei pe an, fiind a 5-a cauza de
deces la aceasta varsta. 14.000 de femei din grupa de varsta
50-60 ani mor anual de cancer de san (Jemal
et al. 2005, American Cancer Society, 2006).
La noi in tara, 1% dintre femei se imbolnavesc anual de
cancer mamar, iar 85% sunt depistate in faze avansate de boala. Dupa
anul 2000, mortalitatea prin cancer mamar a crescut cu 7%, iar numarul de
cazuri nou aparute depaseste anual 6500 dintre care 2500
mor.
Etiologia
majoritatii cancerelor de san ramane obscura. Este considerata
o boala cu o etiologie heterogena, iar studiile epidemiologice au
punctat subgrupe populationale particulare care prezinta risc crescut
de a dezvolta boala.(Davis et al. 1997;
Henderson et al. 1996; Henderson et al. 1997; Lipworth et al. 1996).
Factorii
de risc recunoscuti a fi
asociati cu dezvoltarea cancerului de san sunt:
istoria
familiala, respectiv factorii genetici
expunerea
crescuta sau prelungita la estrogeni
boala
fibrochistica (hiperplazia atipica)
cancerul
mamar anamnestic al sanului controlateral
radiatiile
ionizante
Alti factori asociati riscului
crescut de cancer mamar sunt:
factorii
hormonali si reproductivi, ca de
exemplu:
varsta
menarhei si menopauzei
varsta
primei sarcini la termen
avortul
spontan sau indus
alaptarea
nuliparitatea
receptorii androgenici
contraceptivele orale
terapia de substitutie hormonala
Factorii asociati stilului de
viata, cum ar
fi:
factorii
antropometrici
dieta
consumul
de alcool
fumatul
De asemenea sunt implicati:
nivelul
socioeconomic
factori
ocupationali
expunerea
la produse chimice, campuri
electromagnetice
implante
mamare
Factorii de mediu si stilul de
viata sunt predominanti fata de factorii genetici
pentru majoritatea cazurilor de cancer de san. Studiile pe gemeni (45000
perechi de gemeni in 3 tari nordice) au estimat ca factorii
genetici sunt implicati in circa o patrime din cazuri, pe cand cei de
mediu la circa trei patrimi din cazuri (Lichtenstein et al. 2000). Variatia ratei cancerului mamar in
cazul studiilor pe populatiile emigrante au indicat o importanta
chiar mai mica a factorilor genetici. Femeile descendente din
populatiile emigrante cu risc scazut, in regiuni cu risc crescut au
rata de incidenta a tumorilor mamare apropiata de cea a
tarii gazda.
Expunerea cumulativa a
tesutului mamar la estrogeni si progesteron poate fi unul din
factorii de contributie majora pentru riscul de cancer mamar (Bernstein si Ross, 1993).
Cercetarile suspecteaza ca expunerea precoce la nivele crescute
de estrogeni, chiar din timpul vietii intrauterine, poate fi unul din
riscurile de dezvoltare a cancerului mamar mai tarziu in timpul vietii
adulte. Alte studii au relevat factori asociati nivelelor crescute de
estrogeni pot contribui la cresterea riscului de cancer. Unele studii au
relevat ca femeile ale caror mame au prezentat toxemie gravidica
in perioada graviditatii (conditie asociata nivelului
scazut de estrogeni) prezinta risc scazut pentru dezvoltarea
unui cancer mamar. Expunerea cumulativa la estrogeni poate de asemenea fi
crescuta de catre anumiti factori reproductivi de-a lungul
vietii. Menarha precoce (inainte de 12 ani) are risc cu 20% mai mare
fata de cele cu menarha la 14 ani sau mai tarziu) (Broeders si Verbeek, 1997).
Menopauza la varsta mai mare de 50 de ani prezinta risc usor
crescut de dezvoltare a bolii (Toniolo et
al. 1995). Expunerea cumulativa datorata menarhei precoce si
menopauzei tardive creste de asemenea riscul (Wohlfahrt et al. 2001). De fapt femeile active menstrual pentru o
perioada de 40 sau mai multi ani, ar avea un risc dublu de a dezvolta
un cancer mamar fata de cele cu o activitate menstruala de 30
ani sau mai putin (Henderson et al.
1997). Femeile cu o prima sarcina la termen inainte de 18 ani au
risc de 1/3 fata de cele cu o prima sarcina la termen
dupa 30 ani. Rolul nivelelor crescute de progesteron in etiologia
cancerului de san este mai putin clara (Pike et al. 1993), dar date experimentale sugereaza ca
progesteronul are efect mitogenic, crescand astfel riscul de cancer mamar (Cline et al. 1996).
De asemenea, a fost lansata
ipoteza ca SHBG (steroid hormone
binding globulin) ar creste riscul de cancer de san prin biodisponibilitate
crescuta a estrogenilor, in timp ce alte studii au aratat o
relatie inversa (Thomas et al. 1997). Exista o baza
stiintifica de asociere intre nivelele plasmatice crescute de
testosteron si alti androgeni, si riscul de cancer mamar,
deoarece androgenii ar constitui un substrat de conversie la estrogeni prin
actiunea aromatazei din tesutul mamar (Westberg et al. 2001; Maggiolini et al. 1999).
Terapia de substitutie
hormonala confera risc crescut cu 35%. Utilizarea preparatelor
combinate estrogenice si progesteronice creste mai mult riscul decat
utilizarea de preparate exclusiv estrogenice (Collab. Group on Hormonal Factors in Breast Cancer, 1996). Studiile
efectuate pe mai mult de 150.000 de femei indica risc crescut cu 25% in
cazul folosirii contraceptivelor orale utilizate pentru 12 ani sau mai mult
pentru femeile in premenopauza. De asemenea riscul este mai mare pentru
femeile care au inceput sa utilizeze contraceptive orale inainte de 20 ani
(Collab. Group on Hormonal Factors in
Breast Cancer, 1997). Nu exista evidente de risc crescut la 10
ani dupa intreruperea utilizarii de contraceptive orale (Ursin et al. 1998).
Dieta
si in particular cea bogata in lipide este un alt factor ce
sugereaza risc crescut. In prezent, exista o ipoteza conform
careia este mai important tipul de lipide ingerate decat cantitatea
totala de lipide din alimentatie. Exista mai multe studii ce
sugereaza ca femeile supraponderale si obeze au risc crescut in
perioada postmenopauza, probabil datorita faptului ca
tesutul adipos este principala sursa de estrogeni in
postmenopauza (McTiernan, 1997).
In premenomauza riscul la femeile obeze este usor mai mic decat in
cazul celor cu greutate normala (Hankinson
et al. 1998). Consumul regulat de alcool a fost de asemenea asociat cu risc
crescut (Ellison et al. 2001).
Alcoolul ar putea creste riscul de cancer de san prin cresterea
nivelelor estrogenilor plasmatici si a nivelelor de factori de
crestere insulin-like. Insulin growth factor I are activitate
mitotica si efect antiapoptotic asupra celulelor mamare maligne
si interactioneaza sinergic cu estrogenii in sensul
stimularii cresterii tumorilor mamare (Yu, Rohan, 2000; Khandwala et al. 2000). Activitatea
fizica moderata determina
o scadere a riscului ce variaza cu studiile, fiind de aproximativ 30%
(Thune et al. 1997).
Dintre factorii de mediu,
radiatiile ionizante sunt singurele care au un rol bine stabilit. Rolul radiatiilor
ionizante in cazul populatiei din zone cu nivele crescute de radiatii
provenite din accidente industriale sau activitati nucleare nu a fost
suficient demonstrat in relatie cu riscul crescut de cancer mamar. In ceea
ce priveste expunerea la campurile electromagnetice, rezultatele au fost
de asemenea neconcludente (Laden, Hunter,
1998). Date experimentale sugereaza ca expunerea la anumiti
solventi organici si alte produse chimice (benzen, triclorpropan,
vinil clorid, hidrocarburi aromatice policiclice pot cauza formatiuni
tumorale la animale si astfel ar putea produce asemenea tumori si la
om (Hansen, 1999). In mod particular,
femeile tinere care lucreaza in industria solventilor ar avea risc
crescut (Holford et al. 2000). S-au
efectuat studii asupra riscului reprezentat de anumiti compusi
chimici care perturba echilibrul endocrinologic (xenoestrogeni), ca de
exemplu policlorurile bifenilice (PCBs), hidrocarburile clorurate cu rol de
pesticide. Deoarece aceste substante afecteaza productia si
metabolismul estrogenilor, ar putea contribui la dezvoltarea si
cresterea tumorilor mamare (Goldberg
si Labrech, 1996). Oricum rezultatele acestor studii au fost
inconsistente, iar cercetarile in acest sens continua sa
investigheze o posibila relatie cauzala (Safe, 2000). Investigarea posibilelor relatii dintre aceste
expuneri si dezvoltarea unei tumori mamare trebuie sa tina
seama de perioada de latenta. A fost raportata o perioada
de latenta de 8-15 ani pentru cancerul de san (Petralia et al. 1999; Segnan, 1997). In ciuda vastelor studii
efectuate, cauzele directe ale tumorilor mamare raman necunoscute.
In ceea ce priveste istoria familiala, studiile
epidemiologice au evidentiat ca femeile cu rude de gradul I care au
fost diagnosticate cu tumori mamare in premenopauza au risc de 3 ori mai
mare. Nu s-a gasit risc crescut pentru femeile cu rude de gradul I
diagnosticate in postmenopauza cu neoplazie mamara. Daca o
femeie are o ruda de gradul I diagnosticata cu neoplazie mamara
bilaterala la orice varsta, are risc de 5 ori mai mare. Mai mult,
daca o femeie are mama, sora sau fiica cu neoplazie
mamara bilaterala premenopauza atunci are risc de 9 ori crescut
(Broeders Verbeek, 1997; Li, 1996).
Gemenii au risc mai mare sa dezvolte cancer mamar (Weiss et al. 1997). Istoria personala de tumora
mamara benigna este de asemenea asociata cu dezvoltarea unei
cancer. Boala fibrochistica este cea mai frecvent diagnosticata
tumora mamara benigna. Femeile cu boala fibrochistica
au risc de 2-3 ori mai mare sa dezvolte cancer mamar.
Evidentierea
predispozitiei genetice a cancerului mamar deriva din aglomerarea cazurilor de cancer in unele
familii, precum si riscului crescut la indivizi cu anumite sindroame
determinate genetic. Potrivit studiilor recente, aproximativ 10% din cancerele
pot fi atribuite mutatiilor genetice mostenite. Majoritatea acestor
mutatii apar la nivelul genelor BRCA1
si BRCA2, BRCA3, p53, ATM (Kadouri
et al. 2001). Aproximativ 50% pana la 60% din femeile care au
mostenit mutatiile de la nivelul genelor BRCA1 si BRCA2 vor
dezvolta cancer de san in jurul varstei de 70 ani (Collins et al. 1995).
Protooncogena
HER-2/neu codeaza un factor de crestere receptor-like inserat la
nivelul membranei celulare, iar recent au fost descoperiti liganzi pentru
aceasta protooncogena. O mutatie punctiforma la nivel
membranar determina transformarea oncogena a genei. Proteina
HER-2/neu este supraexprimata (2-40 ori) intr-o proportie
semnificativa de cazuri de tumori mamare (20-30%). Supraexprimarea este de
obicei datorata amplificarii genice. O posibila explicatie
a acestui fapt ar fi reglarea la nivel inalt a transcriptiei sau
modificarilor post-translationale. In majoritatea studiilor
supraexprimarea acestei protooncogene in cancerul de san s-a asociat cu forme
agresive de boala si prognostic defavorabil. Unele studii au
evidentiat asocierea dintre supraexprimarea HER-2/neu si stadiile
precoce de boala, sugerand un rol mai important in initierea bolii
decat in progresia ei. Gena p53 codifica o proteina nucleara
care se gaseste in cantitati mici in toate celulele. Se
crede ca produsul acestei gene actioneaza in sensul
impiedicarii proliferarii celulare exagerate. Cu toate ca
mecanismul exact prin care p53 actioneaza ca inhibitor al cresterii este necunoscut,
p53 se leaga la regiuni specifice a ADN unde regleaza expresia altor
gene. Pierderea p53 prin deletie de la nivelul bratului scurt al
cromozomului 17 a fost asociata cu transformare maligna in vitro. A
fost evidentiat si faptul ca genele p53 care prezinta
mutatii pot actiona ca dominante pentru transformarea maligna,
similar protooncogenelor (Lianidou et al. 1998). Riscul scazut de
cancer mamar poate fi atribuit si unui polimorfism genetic al unor gene
comune. Sunt implicate si enzime codate din metabolismul steroizilor sau substantelor
carcinogene, precum si cele implicate in reparatiile ADN (Pietras si Pegram, 1999).
A fost lansata ipoteza ca
variatia individuala a riscului rezulta din polimorfismul unor gene cu rol crucial in controlul biosintezei si
transportului hormonal. Aceste gene ar fi: gena 17 beta-hidroxisteroid
dehidrogenazei 1 (HSD17B1), gena citocromului P459c17 (CYP17), gena aromatazei
(CYP19) si gena receptorului estrogenic alfa (ER) (Feigelson, Henderson, 1996). Genele CYP17 codeaza enzimele
citocromului p450c17 ce mediaza steroid 17-hidroxilaza si
17,20-liaza, enzime cu rol cheie in steroidogeneza. Nivelele de hormoni
steroizi variaza cu genotipul CYP17. Femeile cu genotipul A2/A2 au
prezentat nivele statistic crescute de estrona si
dehidroepiandrosteron fata de cele cu genotipul A1/A1 (Haiman et al. 1999).
3. Factori morfologici de
prognostic in cancerul mamar
Stadiul tumorii (sistemul TNM, pTNM) este un factor
prognostic esential. De exemplu, rata de supravietuire la 5 ani in functie de stadiul tumorii este:
- 84% pentru stadiul I
- 71% pentru stadiul II
- 48% pentru stadiul
III
- 18% pentru stadiul IV
Stadializare - sistemul TNM
0 : Tis-T1N0M0
I : T1N0M0
IIA : T0-1N1M0;
T2N0M0
IIB : T2N1M0; T3N0M0
IIIA
: T0-3N2M0
IIIB
: T4; orice N; M0; oriceT; N3; M0
IV : orice T; oriceN; M1
Prezenta sau absenta invaziei
tumorale
cel
mai important factor prognostic
carcinoamele
in situ sunt 100% curabile prin mastectomie
Prognosticul DCIS
DCIS Grading (dupa caracterele citologice ale celulelor
neoplazice)
Grad scazut: nuclei mici, monotoni, fara necroze,
se aseamana cu neoplazia intraepiteliala lobulara. De
obicei cribriform, papilar, micropapilar, flat, solid; 0-10% progreseaza
spre carcinom invaziv
Grad inalt: nuclei mari, pleomorfi, angulari, mitoze
frecvente, nucleoli proeminenti, necroze de tip comedo
Grad intermediar: intre cele doua tipuri
Nota: Daca mai mult de 30% dintre ducte reprezinta celule cu
grad inalt de malignitate, leziunile vor fi incluse in categoria DCIS de grad
inalt
Alti factori predictivi ai recurentei in
cazul DCIS:
Varsta
< 45 ani
6
lame pozitive cu DCIS
Cancerizare
lobulara pana la 4,2 mm de margine
Absenta
microcalcificarilor ductale
Implicarea nodulilor
limfatici
Cel
mai important factor prognostic pentru aprecierea intervalului liber de
boala, aprecierea supravietuirii si alegerea tratamentului
-
N0: 70-80% fara recurente la 10 ani
-
N1-3: 35-40% fara recurente la 10 ani
Rata
de supravietuire depinde de gradul de implicare ganglionara
axilara (scazut, mediu, inalt), de numarul de noduli
implicati(N0, N1-3, N4 sau mai multi), prezenta sau absenta
invaziei extranodale, sau a celulelor tumorale in vasele eferente
Implicarea nodulilor limfatici - sistem TNM
Nx -
nu se evidentiaza invazie ganglionara
N0 -
fara invazie ganglionara
N1 -
invazia nodulilor axilari de aceeasi parte, mobili
N2 -
invazia nodulilor axilari de aceeasi parte, fixati
N3 -
Invazia nodulilor mamari interni, de aceeasi parte
Implicarea nodulilor limfatici - sistem pTNM
Diferente
fata de TNM numai la N1, unde avem subclasificari, astfel:
pN1a
- micrometastaze mai mici de 0,2 cm
pN1b
- metastaze la nivelul nodulilor axilari > 0,2 cm
-
pN1bi : 1-3 noduli, fiecare>0,2cm sau toti < 2 cm
-
pN1bii : 4 sau mai multi noduli, fiecare > 0,2cm sau toti < 2 cm
-
pN1biii : extensie extracapsulara < 2 cm
-
pN1biv : metastaze nodale > 2 cm
Pattern-ul reactiei limfatice nodale
Aspectul
microscopic al nodulilor regionali
raspusul
limfoid
histiocitoza
sinusala
indica
raspunsul gazdei la invazia tumorala si s-ar corela cu
prognosticul (controversat)
Prezenta
micrometastazelor nodale este de asemenea un factor predictiv
pentru aprecierea intervalului liber de boala
Marimea tumorii
inclusa
in sistemul TNM de clasificare;este un parametru simplu, care pare sa fie
cel mai puternic factor de predictie pentru diseminarea tumorala
si recurenta in carcinoamele fara invazie nodala.
De exemplu:
T<1cm, N0, supravietuire la 5 ani 98%
T<2cm, N0, supravietuire la 5 ani
Carcinomul
mamar minimal - orice carcinom
in situ sau carcinom invaziv mai mic sau egal cu 1cm (supravietuire la 10
ani - 75%)
Tx -
fara evidenta tumorii
Tis -
carcinom in situ (DCIS, LCIS, Paget mamelon)
T1 -
T mai mic sau egal cu 2 cm
- T1Mic- microinvazie mai mica
sau egala cu 0,1 cm
- T1a 0,1- 0,5 cm
- T1b 0,5-1 cm
- T1c 1-2 cm
T2 - T mai mare de 2 cm dar mai mica de 5
cm
T3 - T mai mare de 5 cm
T4 - T de orice dimensiune cu extensie la
perete sau piele
- T4a - extensie la perete fara
implicarea m.pectoral
- T4b - edem sau leziuni ale pielii
- T4c - T4a+T4b
- T4d - carcinom inflamator
Pozitia tumorii
Localizarea
mediala - 50% risc de recurente
Multicentricitatea
- mai comuna in carcinomul lobular si asociata unei
supravietuiri mai reduse
Bilateralitatea
- mai frecventa in carcinomul lobular si istorie familiala de
cancer mamar
Tumorile
la < 2,5 cm de mamelon se
asociaza mai frecvent cu invazie mamelonara
Marginile tumorii
Tip
"pushing" - prognostic mai bun decat cele infiltrative
Invazia
pielii, respectiv a mamelonului - prognostic infaust
Boala
Paget- prognosticul depinde de varianta de carcinom intraductal invaziv asociat
si de invazia ganglionara axilara
Grading-ul microscopic (a se vedea tabel 2, 3, pag.36) se
realizeaza in functie de:
Arhitectura
tumorala - formarea de lumene
Citologie
- pleomorfismul nuclear, nuclei mari, nucleoli mari, asimetrici
(diferentele de marime avand importanta mai mare decat
diferentele de forma)
Analiza
computerizata a caracteristicilor nucleare
Proliferarea
celulara ilustrata morfologic prin numarul de mitoze
Prezenta necrozelor
tumorale
Se
asociaza cu incidenta crescuta a metastazelor limfatice
si rata scazuta de supravietuire, mai ales daca
sunt extensive, si la marginea tumorii
Se
asociaza cu tumori ce prezinta grad inalt de malignitate
Tipul citoarhitectural
Nu
exista diferente semnificative prognostic intre carcinomul ductal
si cel lobular
Variante de carcinom cu prognostic
favorabil
- carcinom tubular
- carcinom cribriform
- carcinom medular-strict definit
- carcinom mucinos pur
- carcinom papilar
- carcinom adenoid chistic
- carcinom juvenil secretor
Variante de prognostic defavorabil
- varianta cu celule in "inel cu
pecete"a
carcinomului lobular
- carcinomul inflamator
- carcinom cu zona de necroza
centrala-
varianta agresiva in ciuda
dimensiunilor
mici si implicarii nodale
minime
- carcinom micropapilar invaziv
- carcinomul scuamos acantholitic
- carcinomul neuroendocrin cu celule mici
- angiosarcomul
Diferentierea neuroendocrina (NSE, chromogranin, synaptophysin) in
cazul NOS - nu are o semnificatie prognostica
Desi
au fost considerate mai agresive, exista o diferenta mica a
ratei de supravietuire in cazul carcinoamelor scuamoase (varianta
achantolitica mai agresiva) respectiv metaplastice
Reactia stromala
Stroma cu caracter mixoid
- Acidul hyaluronic (polizaharid
extracelular) implicat in invazia celulara este raspunzator de
transformarile mixoide ale stromei
- Prezenta
reactiei inflamatorii (limfocite si histiocite) la periferia tumorii
se asociaza cu prognostic redus, grad mai mare de metastazare
limfatica, stimularea angiogenezei
- Dupa unele studii prezenta de eozinofile si mastocite
s-ar corela cu un pronostic bun, datorita secretiei de IL-4 (apoptoza
celulelor tumorale), histamina.
Elastoza - absenta ei se asociaza cu un
raspuns scazut la terapia endocrina
Fibroza - cu prezenta unei mixturi de fibroblaste
si fibre de colagen ce inlocuieste zona de necroza. Se
datoreste hipoxiei intratumorale, prognostic redus
Invazia tesutului adipos se asociaza de asemenea cu un
prognostic redus
Densitatea
microvasculara si angiogeneza
fenomen
independent fata de proliferarea celulara endoteliala
intratumorala
carcinoamele
invazive cu o componenta vasculara proeminenta in stroma
inconjuratoare au un comportament mai agresiv
in
mod particular, tipul comedo al DCIS are o densitate microvasculara
crescuta
Limfangiogeneza, spre deosebire de angiogeneza are
un rol controversat in metastazarea tumorala
Invazia angiolimfatica
Prezenta
embolilor tumorali limfatici se asociaza cu risc crescut de
recurenta tumorala. Caracteristicile histologice ale celulelor
tumorale din vasele limfatice joaca un rol important in progresia
carcinoamelor invazive
dimensiunile
embolilor tumorali limfatici, aspectul papilar, atipia nucleara
numarul
de mitoze si apoptoze celulare, astfel:
>6 apoptoze si > 4 mitoze in
embolii tumorali limfatici se asociaza cu o rata crescuta de
recurenta in cazul carcinoamelor invazive ductale, fara
metastaze nodale
Prezenta
embolilor tumorali vasculari sangvini se coreleaza cu marimea
tumorii, gradul histologic, tipul tumorii, invazia nodulilor limfatici,
metastaze la distanta, prognostic infaust.
4. Markeri tumorali cu rol diagnostic si prognostic in cancerul mamar
4.1. Valoarea diagnostica si terapeutica a receptorilor
hormonali estrogenici si progesteronici
Cu toate ca mamografia si examinarea proprie a sanului sunt larg
utilizate de clinicieni pentru depistarea tumorilor mamare sau a unor eventuale
recurente ale acestora, tumorile mici, in stadii precoce scapa adesea
acestor examinari. De aceea, se impune gasirea unor markeri tumorali care sa identifice femeile cu
risc de a dezvolta un cancer mamar si care sa informeze asupra
raspunsului la tratament si prognostic.
Cei mai comuni markeri tumorali in cazul cancerului mamar sunt receptorii
estrogenici (ER) si progesteronici (PR). Hormonii controleaza cresterea carcinoamelor mamare,
iar utilizarea terapiei hormonale ramane tratamentul preferat pentru
majoritatea cancerelor de san metastatice ER-pozitive. Sir George Beatson a
demonstrat in urma cu 100 de ani legatura dintre hormoni si
cancerul de san in stadiu avansat. El a remarcat ca ovarectomia a fost
asociata cu regresia cancerului de san la femei in premenopauza (cit.
de Allen si Doisy, 1923).
Mecanismul de actiune nu a fost inteles pana in 1960, cand
supraexpresia ER a fost demonstrata in unele cancere mamare. ER
actioneaza ca factor de transcriptie nuclear hormono-dependent.
Dupa patrunderea in celula prin difuziune pasiva,
estrogenii se leaga de receptori care formeaza dimeri, iar apoi
complexul este translocat in nucleu. ER se leaga la structuri specifice
din genom, denumite elemente estrogen responsive (EREs) care recruteaza un
numar de cofactori care faciliteaza transcriptia. Majoritatea
cancerelor mamare ER pozitive sunt dependente de acest proces si de aceea
aceste tumori sunt tratate cu antiestrogeni care induc modificari conformationale
la nivelul receptorilor, blocand recrutarea cofactorilor esentiali pentru
transcriptia genica. Rezistenta la acesti agenti
terapeutici constituie o problema majora in clinica. In prezent
se cunosc doua forme de ER, alfa si beta cu gene situate pe cromozomi
diferiti, dar cu mare similitudine structurala si a domeniilor
de legare. ER beta se exprima atat in celulele epiteliale ductale si
acinare, cat si la nivelul stromei si celulelor mioepiteliale. In
tesutul mamar normal nivelele ER beta sunt superioare celor alfa; acest
aspect se intalneste si in leziunile benigne, non-proliferative
si premaligne ale glandei mamare. Desi in prezent exista
anticorpi monoclonali pentru evaluarea imunohistochimica a ER beta si
s-au facut o serie de studii, semnificatia clinica nu este
foarte bine documentata. Expresia receptorilor alfa este
restrictionata la nivelul epiteliului mamar normal si tumoral,
motiv pentru care ER alfa este folosit ca marker imunohistochimic pentru
evaluarea statusului hormonal in carcinoamele mamare. Evidentierea
implicarii estrogenilor in
initierea si progresia tumorilor mamare s-a bazat in special pe
efectele mitogenice mediate de ER. Oricum, prezumtia ca estrogenii au
rol in initierea bolii este sustinuta si de efectele
genotoxice ale acestora, care au condus la variate lezari ale ADN, atat in
vitro, cat si in vivo (Colditz et al. 2004). Grupul de colaborare
asupra trialurilor precoce de supraveghere a raspunsului terapeutic la
tamoxifen a demonstrat ca supravietuirea pacientilor ce
raspund la tratamentul primar cu tamoxifen este superioara celor
non-responsivi. S-a demonstrat ca supravietuirea la 10 ani a
pacientelor cu ER pozitivi este mai buna decat in cazul celor cu ER
negativi. Masurarea concentratiilor ER, traditional cu ajutorul
unei metode radioimune, iar mai recent cu ajutorul tehnicilor
imunohistochimice, este o metoda bine stabilita de predictie a
raspunsului la terapia endocrina, corelabila cu pozitivitatea
receptorilor. In general, cu cat tumora este mai bogata in ER, cu atat
prognosticul va fi mai bun. Aproximativ 70% dintre pacientii tratati
pentru cancer de san, prezinta tumori ER pozitive, iar dintre acestea
circa 60% vor raspunde la terapia endocrina. In cazul tumorilor ER
negative, se vor obtine doar raspunsuri slabe la terapia
endocrina. Nu exista corelatie semnificativa statistic
intre diferitele tipuri citoarhitecturale ale carcinomului mamar si
prezenta receptorilor hormonali, dar o serie de studii au evidentiat
ca majoritatea carcinoamelor medulare si comedocarcinoamelor sunt
negative, in timp ce carcinoamele mucinoase au cea mai mare rata de
pozitivitate. In DCIS, predominanta celulelor mari este cel mai bun
predictor morfologic al negativitatii ER. Prezenta ER se
asociaza semnificativ cu gradul inalt de diferentiere, absenta
necrozelor tumorale, paciente mai in varsta (Allred et al. 1998). De asemenea, prezenta ER se
coreleaza pozitiv cu imunoreactivitatea pentru bcl-2, absenta
mutatiilor p53, iar corelatie inversa prezinta cu
pozitivitatea receptorilor factorului epidermal de crestere (Pharoah et al. 1999).
Progesteronul are un important rol in tumorigeneza mamara.
PR, care se gasesc sub doua izoforme, A si B, sunt
exprimati in celulele progestin-responsive, au un rol distinct in expresia
genica si dezvoltarea glandei mamare. Se pare ca PR-B au rol reglarea
expresiei factorului de crestere endotelial vascular, un potent factor
angiogenic. Formele A ale PR contribuie la reprimarea activarii ER si
a activitatii transcriptionale ale formelor B. Tumorile care
contin izoformele B ale PR ar putea raspunde mai bine la terapia
antitumorala care include inhibitori ai angiogenezei (Jianbo et al. 2004). PR, care reflecta stimulul
functional estrogenic, au fost investigati in acest sens si se
considera ca sunt factori de prognostic cu semnificatie
similara ER. Trialuri recente au demonstrat ca pacientii ale
caror tumori exprima ER si PR prezinta o mai mare
probabilitate de remisie (77%), decat pacientii ale caror tumori
exprima numai un tip de receptori (aproximativ 27% pentru ER+/PR- si
46% pentru cele ER-/PR+) sau nivele scazute ale ambilor (aproximativ 10%)
(MacGrogan,1996). In majoritatea
studiilor imunohistochimice, tumorile ER pozitive (56,7-66,4%) au fost de
asemenea pozitive si pentru PR (59-72,6%), cu concordanta de 65%
(Romain, 1995). Tumorile ce
exprima atat ER, cat si PR tind sa fie mai bine
diferentiate.
4.2. Supraexpresia HER-2/neu
Familia proteinkinazelor include multe oncoproteine si receptori ai
factorilor de crestere, inclusiv receptorul
EGF. Proteinkinazele fosforileaza reziduurile tirozinice sau
serina/treonina din cadrul anumitor substraturi. O astfel de
oncoproteina este HER-2, in stransa corelatie cu receptorul
factorului de crestere epidermal (EGFR). Familia HER (erb) cuprinde patru
membri: EGFR sau HER-1 (erb-B1), HER-2 (erb-B2), HER-3 (erb-B3), HER-4 (erb-B4)
(Ross si Fletcher, 1998).
Protooncogena HER-2/neu este localizata pe cromozomul 17q si
codeaza un factor de crestere receptor-like inserat la nivelul
membranei celulare, iar recent au fost descoperiti liganzi pentru
aceasta protooncogena. Numele deriva de la "Human Epidermal
growth factor Receptor" si prezinta o substantiala
omologie structurala cu receptorul factorului de crestere epidermal
(EGFR). O mutatie punctiforma la nivel membranar determina
transformarea oncogena a genei. Proteina HER-2/neu este
supraexprimata (2-40 ori) intr-o proportie semnificativa de
cazuri de tumori mamare (20-30%). Supraexprimarea este de obicei datorata
amplificarii genice, dar uneori apare si la un mic procent de copii sanatosi.
O posibila explicatie a acestui fapt ar fi reglarea la nivel inalt a
transcriptiei sau modificarilor post-translationale. In
majoritatea studiilor supraexprimarea acestei protooncogene in cancerul de san
s-a asociat cu forme agresive de boala si prognostic defavorabil. Unele studii au evidentiat
asocierea dintre supraexprimarea HER-2/neu si stadiile precoce de
boala, sugerand un rol mai important in initierea bolii decat in
progresia ei (Ruliang et al. 2002).
Supraexpresia HER-2 apare in orice
stadiu al bolii, de la hiperplazia ductala atipica la leziuni
metastatice, dar cel mai frecvent apare in cazul hiperplaziei ductale atipice
si carcinomului ductal in situ. Gradul supraexpresiei creste cu
progresia la carcinomul invaziv, fara crestere sincrona in
cazul metastazelor. Pare sa fie implicata in initierea
oncogenezei, rolul sau in progresia cancerului de san nefiind clarificat (Somerville et al. 1992). Tumorile HER-2
pozitive sunt in general ER si PR negative si se asociaza cu
activitate mitotica intensa si numar mare de cazuri cu metastazare
limfatica. De asemenea, se asociaza cu gradul tumoral, in special G3,
varsta tanara, aneuploidia DNA, supraexpresia proteinei p53,
invazivitatea tumorala (Taucher et
al. 2003). Amplificarea genei HER-2 a fost observata mai frecvent in
randul pacientelor cu istorie familiala de cancer de san (Espinosa et al. 2003). S-a
evidentiat corelatie semnificativa cu tipurile histologice ale
cancerului de san. Astfel, carcinomul medular se asociaza rar cu
supraexpresia HER-2/neu (10%), cel mai frecvent, fiind asociat carcinomul
ductal (49%) si mai putin in carcinomul lobular (43%) (Rosen, 1995). In cazul carcinomului
ductal in situ, anomaliile HER-2 par sa se identifice in formele
virulente, de grad nuclear inalt si necroze tip comedo. Sunt necesare
multiple evaluari pentru a aprecia daca acest marker poate fi
utilizat clinic pentru stratificarea pacientilor in grupe de risc mic, ce
ar putea fi tratati conservator si grupe de risc inalt, care ar
necesita proceduri chirurgicale extinse post-biopsie, pentru a preveni
recurentele si a impiedica evolutia spre forme invazive, in
cazul fenotipurilor agresive (Moreno et
al. 1997). ASCO recomanda utilizarea c-erbB-2 pentru diagnosticul
si prognosticul cancerului de san. Fiecare pacient suspect ar trebui
sa beneficieze de un test HER-2/neu, fie pentru precizarea diagnosticului,
fie a recurentelor. In plus, fata de considerabilul interes al
proteinei HER-2 ca factor prognostic, a fost studiata potentiala
aplicabilitate a HER-2/neu in predictia raspunsului la tratament. A
fost raportata rezistenta acestor tumori la tratamentul exclusiv
hormonal si in special rezistenta la tamoxifen (Elledge, 1998). De asemenea, a fost evidentiata rata
crescuta de raspuns la chimioterapia cu agenti ce contin
adriamicina. Imunocoloratiile HER-2/neu au prevazut cu succes
recurentele locale in cazul pacientilor tratati exclusiv
chirurgical sau prin radioterapie. Recent, utilizarea statusului HER-2, singur
sau in asociatie cu alti markeri prognostici, au prevazut cu
succes raspunsul la chimioterapia si radioterapia adjuvanta. Au
fost raportate studii in care Herceptin sau trastuzumab (anticorpi monoclonali
anti proteina HER-2/neu) in combinatie cu alte chimioterapice a determinat
raspuns obiectiv si stabilizarea bolii in cancere mamare metastazate, rezistente la
multiple terapii anterioare (Slamon, 1998).
In plus fata de terapia anti-HER-2/neu, se afla in
investigatii preliminare utilizarea terapiei genice (Brown, 2002) si vaccinarea anti-HER-2/neu. Testarea HER-2/neu
a pacientelor va avea o mare valoare in managementul cancerului de san ca
standard de practica, similar cu testarea statusului receptorilor
hormonali.
Utilitatea analizei domeniului extracelular
(ECD) circulant al HER2. In comparatie cu expresia tisulara,
se pare ca majoritatea pacientilor care exprima ECD sunt
pozitivi si pentru HER2 la nivelul tumorii primare. Astfel, ECD HER2 ar
putea servi ca si marker surogat pentru statusul HER2/neu, fiind util in
toate situatiile discutate mai sus, in special pentru aprecierea
initierii terapiei, precum si raspunsului terapeutic la
trastuzumab si antracicline. De
asemenea o posibila indicatie pentru HER2 ar fi evaluarea
raspunsului la terapia endocrina. La pacientii ER-pozitivi
si HER2-pozitivi, raspunsul la tamoxifen ar fi mai redus, unele studii
sugerand ca la acesti pacienti inhibitorii aromatazei ar fi de
preferat. Mai mult, nivelele ECD HER2 determinate in serie ar putea fi utile
pentru monitorizarea sau depistarea recurentelor la pacientii
asimptomatici. ECD HER2, care se pare ca reflecta statusul tisular al
HER2 are avantaje certe prin posibilitatea monitorizarii seriate a
biologiei tumorale fara a
necesita rebiopsierea leziunii metastatice (Harris
et al, 2007).
O multitudine de factori moleculari au fost investigati in scopul de a
identifica un factor de prognostic cel putin la fel de semnificativ ca
si statusul ER. Unul dintre cei mai studiati factori in acest context
este HER2 (human epidermal receptor growth factor). Oncoproteina HER2/neu, un
analog mutant al receptorului celular pentru EGF (epithelium growth factor)
este unul dintre cei patru membri ai familiei de tirozinkinaze tip 1,
implicati in reglarea cresterii si dezvoltarii glandei
normale, prin interactiunea dintre celulele epiteliale sau dintre celule
si stroma. (Schroeder et al,
1997). Cei patru receptori transmembranari contin un domeniu de legare
extracelular, un segment transmembranar si o proteina
intracelulara cu domeniu tirozinkinazic, cu exceptia HER3,
caruia ii lipseste domeniul tirozinkinazic. Receptorii HER formeaza
homo- si heterodimeri stabilizati si activati prin
intermediul unor liganzi, cu exceptia HER2, pentru care nu a fost
identificat un asemenea ligand, HER2 fiind preferat ca partener pentru
heterodimerizare in interiorul familiei. Dupa ce studiile initiale au
relevat rolul pe care il are amplificarea genei HER2 sau supraexpresia
proteinei HER2 in cancerogeneza, alte studii au fost orientate pe rolul de
factor prognostic/predictiv al HER2 (Slamon,
1987). Desi supraexpresia
HER2/neu a fost utilizata initial ca factor prognostic infaust in
cancerul mamar, valoarea actuala a expresiei imunohistochimice a HER2 este
utila pentru selectarea pacientelor care vor primi tratament cu Herceptin
(trastuzumab), un anticorp monoclonal umanizat care blocheaza aceasta
proteina. De asemenea, multe studii, dar nu toate au relevat ca
supraexpresia HER2 se coreleaza cu o rezistenta crescuta la
terapia hormonala pentru cazurile in care ER/PR si HER2 se
coexprima. In functie de expresia ER/PR si HER2/neu s-au descris
mai multe imunofenotipuri cu importanta terapeutica dupa
cum urmeaza (tabel---):
Tabel . . Relatia imunofenotip - terapie
|
Imunofenotip
|
Terapie posibila
|
|
ER-PR-HER-
|
Chimioterapie
|
|
ER-PR-HER+
|
Herceptin
|
|
ER+PR+HER-
|
Terapie
hormonala
|
|
ER+PR-HER-
|
Terapie
hormonala
|
|
ER-PR+HER-
|
Terapie
hormonala + chimioterapie
|
|
ER-PR+HER+
|
Herceptin +
terapie hormonala?
|
|
ER+PR+HER+
|
Herceptin +
terapie hormonala +/-chimioterapie
|
4.3. Rolul androgenilor in glanda
mamara normala si tumorala
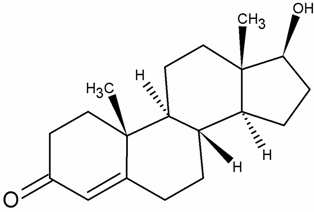
Testostosteron
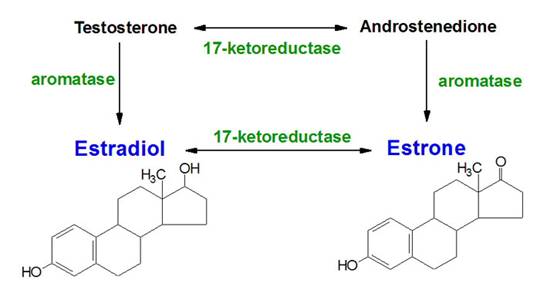
Fig. 2
Androgenii, ca si estrogenii, pot fi
sintetizati in glanda mamara. Intrucat atat androgenii activi cat si
receptorii lor corespunzatori sunt prezenti in tesutul mamar, deducem
ca ei joaca un rol in fiziologia glandei mamare. Acest fapt este
sustinut de faptul ca secretia insuficienta sau
insensibilitatea la androgen poate conduce la dezvoltarea ginecomastiei.
Insensibilitatea androgenica completa (CAIS) data de defecte ale
receptorilor conduce la o dezvoltare normala a sanului la femei cu fenotip
XY. In timp ce dezvoltarea glandei mamare este complet inhibata de
nivelurile de testosteron masculin, diminuarea partiala cu tratament
androgenic a unui san dezvoltat pare a fi posibila.
Cancerul de san, in stagiile incipiente pare
sa indeplineasca prerogativele lipsei de sensibilitate la
androgen.Tratamentul androgenic in stadiile avansate de cancer mamar a
aratat eficacitate similara cu terapia antiestrogenica sau
ablatie estrogenica, dar si efecte adverse considerabile. S-a
speculat ca folosirea modulatorilor androgenici selectivi (SARMs) fie in
terapie unica sau, preferabil, in plus terapiei antiestrogenice sau
inhibitorilor de aromataza, poate fi o alternativa
promitatoare la modalitatile actuale de terapie in cancerul de
san hormono dependent. Pe langa
aceasta, studii viitoare in folosirea profilactica a SARMs par a fi
justificate
Consideratii generale
Androgenii sunt hormoni steroizi cu 19 atomi de
carbon care sunt produsi in ovare, glanda suprarenala si
tesuturi periferice. Termenul "androgen" este folosit doar pentru
testosteron (T ) si pentru
dihidrotestosteron( DHT). T poate fi convertit de asemenea in estradiol si
este astfel precusor atat pentru androgenul "pur" DHT, cat si pentru
estrogenul " pur "- estradiol. Dehidroepiandrosteron (DHEA), DHEA sulfat
(DHEAS) si androstendion nu sunt
capabili sa se fixeze si sa activeze receptorul androgenic, dar
ei servesc ca si precursori atat pentru sinteza androgenica cat
si pentru cea estrogenica. Astfel, aceste substante sunt
considerate prehormoni.
Doar o cantitate
mica de testosteron (1-3%) circula libera, nelegata in
sange. Majoritatea este fie legata de albumina (25-35%) sau de
globulina transportoare de hormoni sexuali (SHBG) (65-75%) [1]. S-a descoperit
ca patrunderea steroidului legat de SHBG in celule este mediata de un
receptor numit megalin [2]. Expresia megalin m-RNA a fost detectata in
celulele epiteliale mamare [3].
Majoritatea
steroizilor circula ca si precursori (DHEA, DHEA-S sau
androstendiona) in organism. Tesuturile steroidodependente sunt capabile
sa sintetizeze hormoni activi din acesti precursori. Labrie
numeste acest fenomen "intracrinologie" [4]. Totusi, aceast fenomen
ar insemna ca una si aceeasi celula sa produca si
hormoni si receptori corespunzatori. O asemena constructie ar implica
independenta unei celule fata de cealalta, ceea ce ar fi dificil
de inclus intr-un model cuprinzator al reglarii dezvoltarii glandei
mamare si functionalitatii ei. Termenul "paracrinologie" ar
parea astfel mai adecvat intrucat celule diferite comunica intre ele.
Sinteza androgenilor in tesutul mamar
Pentru a forma DHT din DHEA-S, sulfataza steroida (STS), 3β-hidroxisteroid dehidrogenaza
(3β-HSD), 17β-HSD si 5α-reductaza sunt necesare. Sinteza androgenilor cat
si a estrogenilor este posibila din DHEA-S si DHEA; aceasta se
realizeaza cu ajutorul aromatazei
si a enzimelor mai sus mentionate.
Sulfataza steroida (STS) hidrolizeaza steroizii sulfati la
formele lor, neconjugate, mai active. Este responsabila de conversia
DHEA-S la DHEA si E1-S la E1. Precursorii sulfatati inactivi
poseda un timp de injumatatire mai mare in sange decat DHEA
sau E1, si astfel sunt forma ideala de transport pentru hormonii
steroizi. In ceea ce priveste localizarea STS in glanda mamara
umana normala, Tobacman et al. a detectat expresii ale STS m-RNA si activitate
enzimatica in celulele mioepiteliale [5]. Ei concluzioneaza astfel
ca celulele mioepiteliale ar putea juca un rol important in furnizarea
hormonilor steroizi nesulfatati epiteliului secretor mamar. In contrast cu
aceste descoperiri, Suzuki et al. raporteaza doar nivele foarte
scazute ale expresiei STS m-RNA si fara imunoreactivitate
STS in tesutul mamar normal [6] [7]. Cateva grupuri au raportat expresii
si activitate STS ridicate in tesut canceros mamar in comparatie
cu tesut mamar non malign [8] [Suzuki et al.,2003]. In plus, Zaichuk et
al. demonstreaza ca expresia STS este ridicata doar in cancerul
de san ERα pozitiv, in
timp ce este chiar mai scazut in tesutul canceros ERα negativ [9].
Atat in tesutul normal al glandei
mamare cat si in cel canceros activitatea masurata a STS a fost
demonstrata a fi semnificativ mai ridicata decat activitatea
aromatazei [11].
β-HSD e necesara pentru conversia DHEA in
androstendiona. Exista doua izoforme ale 3β-HSD. In timp ce
tipul 2 a fost descoperit numai in suprarenale, testicule si ovare, tipul
1 a fost izolat din placenta si cateva tesuturi periferice incluzand
tesutul mamar normal si canceros [12] [13]. 3β-HSD a fost prezenta in glanda
mamara normala in fibroblasti si celule epiteliale, dar nu
si in cele mioepiteliale.
In mod curent,
sunt cunoscute 15 izoforme ale 17β-HSD [15]. Tipurile 2, 4 , 6, 8, 9, 11 si
14 catalizeaza oxidarea androgenilor si estrogenilor, in timp ce
tipurile 1, 3, 5, 7, si 12 catalizeaza reducerea acestor hormoni
steroizi. Enzimele oxidative folosesc NAD(P)+ ca si cofactor si cauzeaza
inactivarea substratelor proprii.
In tesutul
mamar normal predomina oxidarea estrogenilor, in timp ce reducerea este
favorizata puternic in tumorile de san hormono dependente [17] [18].
Conversia E2 in E1 este dominanta in cancerul de san hormono independent
[19].
β-HSD tipul 1 converteste in principal
E1 in E2 si a fost descoperit atat in celule epiteliale mamare normale cat
si in cele canceroase [18]. Day et al. au demonstrat recent ca 17β-HSD tipul 1 este principala izoforma
in conversia E1 in E2 in tesutul mamar canceros [20]. In contrast, Song et
al. postuleaza ca in celulele canceroase mamare 17β-HSD tipul 7 si cel mai notabil tipul
12 sunt cele mai raspandite izoenzime reducatoare [21].
Mai mult,
Gangloff et al. descrie inactivarea DHT de catre 17-β HSD tipul 1 fie in 3β-androstanediol fie in androstandion [22].
Aceasta enzima e capabila sa furnizeze cel mai potent
estrogen, E2 precum si sa inactiveze cel mai puternic oponent al E2;
aceasta ar implica un suport in plus al actiunii estrogenice iin cancerul
mamar.
β-HSD tipurile 3 si 5 sintetizeaza T din androstendiona. Tipul 3 este in principal localizat in
testicule, in timp ce tipul 5 se gaseste in tesuturile periferice
cum ar fi prostata si sanul. 17β-HSD tipul 5 este singurul membru al 17β-HSD care apartine familiei
aldoketoreductazelor si nu superfamiliei alcool dehidrogenazei cu
lant scurt. A fost localizata imunocitochimic in epiteliul
acinilor si ductelor glandelor mamare [14]; de asemenea a fost
detectata in tesutul canceros mamar [23].
β-HSD tipul 2 converteste T in
androstendiona si E2 in E1 [18]. Se gaseste in celulele
epiteliale mamare normale si se crede ca joaca un rol important
in inactivarea E2 [18]. Legat de aparitia ei in celulele canceroase
mamare, Suzuki et al. raporteaza aproape nici o imunoreactivitate in 111
tesuturi examinate [24], pe cand Gunnarsson et al. descopera expresia
17β-HSD tipul 2 in 69%
din 230 de tesuturi examinate [25].
α-reductaza catalizeaza conversia T in DHT.
Una din cele doua izoforme
identificate, tipul 1, se crede a fi de o importanta mai mare in glanda
mamara decat tipul 2 [23]. Expresia si activititatea celor doua
izoenzime a fost detectata atat in tesutul mamar normal cat si
in cel canceros, dar intr-o cantitate semnificativ mai mare in tesuturile
tumorale [23] [26].
Expresia si activitatea aromatazei s-a raportat in celule stromale ale tesutului mamar
normal si canceros [27] [28]. Este inca o controversa daca e localizata
de asemenea si in celule epiteliale normale si canceroase [29].
Aromataza
converteste androstendiona in E1 sau E2 dar s-a sugerat de asemenea ca T poate fi substratul preferat in
celulele canceroase mamare [30] fig2. Suzuki et al. propune influenta
aromatazei asupra concentratiilor intratumorale ale DHT. In
consecinta, convertind T in E2, enzimele scad concentratiile de T; cu
cat este mai putin T disponibil, cu atat poate fi produs mai putin DHT [23].
Concentratia androgenilor in glanda mamara
Masurarea androgenilor din glanda mamara
a relevat prezenta T si a DHT atat in tesutul normal cat si
in cel tumoral. Suzuku et al. raporteaza concentratii DHT inferiorare
in tesuturile non-tumorale (97 ± 9 pg/g) [41]. Concentratiile
masurate ale DHT in carcinomul ductal invaziv si carcinomul ductal in
situ au fost semnificativ mai mari [23] [41] [42] [43] [44] [45]. De altfel,
scaderi ale nivelelor DHT intratumorale au fost asociate cu malignitatea
sau gradul redus de diferentiere [42] [45]. Nivelele de estradiol in
cancerul de san au fost descoperite a fi independente de nivelele serice
datorita productiei locale [ van Landeghen et al., 1985] [46].
Studiile pe tesut versus concentratii serice au indicat acelasi aspect si pentru
DHT [Secreto et al., 1996] [Recchione et
al.,1995].
Functii posibile ale
androgenilor in glanda mamara
Asa cum toate enzimele cruciale
pentru producerea T si DHT, concentratii masurabile de androgen
si receptori de androgen sunt
prezente in glanda mamara, se poate concluziona faptul ca androgenii
joaca un rol in reglarea glandei mamare, nu numai in cancer dar si in
conditii normale.
Inhibarea dezvoltarii
sanului
Androgenii sunt considerati a fi inhibitori
ai dezvoltarii glandei mamare. Aceasta are la baza faptul ca barbatii
de obicei nu dezvolta sani. La pacientii cu hipogonadism si
deficienta
androgenica, totusi, ex. in sindromul Klinefelter sau insensibilitate partiala la
androgeni (PAIS), ginecomastia este
intalnita adesea [57]. Indivizi masculi genotipic suferinzi de
insensibilitate completa la
androgeni (CAIS) dezvolta sani de femeie morfologic normali in timpul
pubertatii [57].
Fetele cu
hiperplazie suprarenaliana congenitala (CAH) si exces de
androgeni nu ajung la menarha pubertala [58]. In general, acesta ar putea
fi un indicator al inhibitiei complete a dezvoltarii sanilor de catre
androgeni
Inhibarea proliferarii in glanda
mamara normala
Date recent publicate stipuleaza teoria larg
raspandita a opozitiei dintre androgeni si estrogeni in glanda
mamara. Studii pe maimutele rhesus demonstreaza influenta
inhibitoare a androgenilor in proliferarea epiteliala mamara prin
reducerea proliferarii induse a E2 [47] [48
]. Aceleasi
rezultate au fost demostrate in glanda mamara a rozatoarelor [49].
Observatiile
indica efecte similare ale androgenilor la oameni. Impactul T adaugat
la terapia de substitutie combinata a hormonilor estrogeni si
progesteroni in glanda mamara postmenstruala, a fost studiat de
Hofling et al. In timp ce
combinatia de estrogeni si progesteroni a produs o crestere
considerabila a proliferarii celulare mamare, nu a fost
observata nici o schimbare semnificativa atunci cand a fost adaugat T [50]. Acest aspect este un alt
indiciu al influentei androgenilor in blocarea stimularii glandei mamare.
Observatii privind steroizii androgeni
anabolici (AAS) aduc alte informatii. Folosirea si abuzul de AAS duce
la nivele crescute de T la femei dar situate in limita normala la barbati [51]. Unul din
efectele secundare ale AAS este reducerea dimensiunii sanului. Atat
transexualii femeie-barbat cat si atletii care iau AAS au
raportat o reducere a marimii sanilor [52].Dar nu toti
participantii la aceste studii au observat acest efect. Atrofierea glandei
mamare a fost verificata histologic de mai multe grupuri [53][54][55]. In
contradictie, Burgess si Shousha n-au descoperit nici o modificare
atrofica in tesutul mamar printre transexualii femeie barbat la
o luna dupa intreruperea tratamenului AAS [56]. De altfel, ar trebui
mentionat ca mastectomia este o parte inerenta a restabilirii sexului
pentru transexualii femeie-barbat. Aceasta indica faptul ca
si chiar cu un tratament prelungit nu e posibil sa se anuleze complet
dezvoltarea anterioara a sanului.
Inhibarea proliferarii in
cancerul de san
Studii numeroase descriu efectele androgenilor
asupra celulelor canceroase mamare cum este cel al inhibarii
proliferarilor [59]. In liniile celulare ZR-75-1, T47-D, HCC 1500, CAMA-1
si MFM-223, DHT inhiba proliferarile [60] [61]. Rezultate
contradictorii au fost raportate pentru celulele MCF-7. in timp ce unele
grupuri observa stimularea, altii gasesc inhibarea
proliferarii de catre DHT [60]. Efectele androgenilor asupra liniilor
de celule mamare canceroase par sa depinda de prezenta AR, de
concentratia si tipul androgenilor folositi precum si de
prezenta proteinelor co-reglatoare [59]. Mai mult, au demonstrate efecte
apoptotice ale androgenilor pe celulele canceroase mamare [62]. Observatii
similare au fost facute pentru celulele canceroase din prostata [63].
Localizarea receptorilor
androgenici in glanda mamara normala
Nu numai preluarea androgenilor si/sau a
precursorilor lor si conversia in forme active biologic, dar si
prezenta receptorilor corespunzatori este o conditie prealabila
a actiunii androgenice pe un
tesut.
S-au efectuat un
numar redus de studii legate de localizarea receptorilor androgenici (AR)
in glanda mamara umana normala. AR au fost localizati
imunohistochimic la nivelul nucleilor celulelor epiteliale dar mai ales ductale
si alveolare [31] [32] [33] [34]
[35]. In plus, Birrel et al. raporteaza urme citoplasmatice ocazionale.
Kimura et al. si Birrell et al. detecteaza imunoreactivitate AR
si in celulele mioepiteliale, spre deosebire de Jansen et al. si
Ruizefeld de Winter et al. prezenta AR in stroma este inca
neclara. Kimura et al. observa prezenta AR in celulele stromale, in
timp ce Jansen et al. descopera doar prezenta sporadica in
celule stromale.
In contrast cu numarul limitat de studii
legate de expresia AR in tesutul mamar normal, se gasesc numeroase
publicatii despre localizarea AR in tumorile de san. Majoritatea
releva expresia AR in circa 70% pana la 90% din cazurile examinate
[23] [36] [37] [38] [39] [40]. Unele grupuri raporteaza asocieri intre statusul
AR si tipul, gradul si stadiul tumorii [36] [37], in timp ce
altii infirma aceasta asociere [40]. Descoperiri contrastante sunt
gasite si cu privire la corelatiile intre statusul AR si
prognostic in cancerul mamar.
Mutatiile receptorilor
androgenici si cancerul de san
Presupunerea ca androgenii protejeaza
glanda mamara de dezvoltarea cancerului este bazata mai departe pe
studii al polimorfismului AR. Genele AR contin CAG si GGN intr-un polimorfism de secvente repetitive. Secventa
repetitiva CAG a fost demonstrata a fi invers asociata cu
activitatea transcriptionala a AR. O secventa lunga si repetitiva inseamna activitate mai slaba, in
timp ce o secventa repetitiva mai scurta CAG duce la o
activitate transcriptionala mai inalta [64]. Unele grupuri au sugerat
ca secvente scurte CAG repetitive ar putea sa reduca, respectiv
cele lungi sa creasca riscul de cancer la femei [65]. Alte studiii
raporteaza ca lanturi lungi repetitive de CAG sunt asociate cu
risc crescut de cancer la femei cu antecedente familiale de gradul intai de
cancer de san [66]. Altii nu gasesc vreo asociere intre lungimea
lanturilor repetitive ale seventei CAG si riscul de cancer de san
[67]. Cu toate ca riscul de cancer este corelat cu activitatea mai
scazuta a AR prin intermediul lanturilor lungi repetitive de CAG
s-ar potrivi perfect cu presupunerea de mai sus, rezultatele inconsistente nu
ne permit sa tragem vreo concluzie finala.
O alta abordare a rolului receptorilor
androgenilui in cancerul de san se face prin cercetarea mutatiilor genelor
AR. Astfel, pana acum au fost
publicate doar trei communicate legate de asemenea alterari [68] [69]
[70]. Toate mutatiile descrise sunt localizate in regiunea
codificanta a domeniului de legare al ADN-ului (DBD) gasita la
pacientii barbati PAIS cu cancer de san. S-a speculat ca
modificarile din DBD ale AR pot sa duca, fie la o scadere a
activitatii sau la legarea AR de elemente responsive estrogenice.
Poujol et al. observa slaba legatura a AR mutante cu elemente
androgenice responsive, dar fara legare de elemente responsive
estrogenice [71]. Totusi , analiza tesuturilor canceroase mamare ale
barbatilor non-PAIS pentru mutatii ale AR nu releva
alterari ale genelor AR [72]. Mai mult, nu exista rapoarte care
sa indice risc de cancer crescut
sau cazuri de cancer de san la pacienti CAIS. Astfel se poate concluziona
ca mutatiile AR nu duc neaparat la dezvoltarea cancerului de
san. Daca androgenii reprezinta fundatia elementelor inhibitoare
de proliferari celulare mamare, pierderea completa a functiilor AR in
CAIS ar duce la proliferari necontrolate. Aceasta ar conduce fie la
macromastie sau la risc crescut de cancer. Cum nu exista rapoarte de
cancer de san la pacientii CAIS, se poate concluziona ca exista
o cale alternativa care inhiba proliferarea celulara mamara
excesiva.
Nu se cunosc
mutatii genice ale AR cu impact in dezvoltarea cancerului de san [73].
Actualmente, toate mutatiile AR identificate se gasesc la adresa www.mcgill.ca/androgendb
Toate incercarile de a detecta mutatiile
genice ale AR in celulele mamare canceroase au fost nereusite [74] [75].
Totusi , Shan et al. postuleaza ca pierdera expresiei AR in
cancerul de san AR-negativ la femei poate fi cauzata de inactivarea
cromozomului X activ [75]. De asemena, o deletie imbinata variat a
exonului 3 a fost detectata in tesutul canceros, dar absenta in
tesutul mamar normal [74].
Nivelurile serice de androgeni si cancerul de san
Evaluand asocierile intre nivele serice
steroidiene si riscul de cancer mamar, majoritatea studiilor
raporteaza risc crescut de cancer mamar la femeile in postmenopauza
cu niveluri serice crescute ale androgenilor[76] [77]. Desi glanda mamara e capabila sa
converteasca precursorii suprarenalieni in estradiol si DHT, aceste rezultate nu arata neaparat
stimulari proliferative crescute ca si o consecinta a
nivelurilor hormonale serice ridicate. Pare mai probabil ca sanul se
comporta ca o glanda endocrina care contribuie semnificativ la
nivelurile de hormoni sexuali steroidieni din sange la postmenopauza. Niveluri
ridicate ar putea sa reflecte turnover mamar marit, incluzand
proliferari accelerate si astfel un risc crescut de a dezvolta
cancer. Nu a fost demonstrat ca niveluri fiziologice sangvine de steroizi sexuali au influenta directa in
homeostazia sanului. Nivelurile de testosteron si estradiol si
progesteron in sarcina sunt cel putin cu un grad de magnitudine mai
mari decat concentratiile active fiziologic, ceea ce poate permite
proliferarea mamara prin intensificarea diferentierii celulare. La
barbati, nivelurile de testosteron inadecvat de joase la barbati par a fi asociate cu riscul
crescut de cancer de san.
Terapia androgenica in
cancerul de san
Considerand ca androgenii sunt capabili
sa inhibe proliferarea atat a tesutului mamar normal cat si
canceros, terapia androgenica ar parea o concluzie logica.
Inca din anii 1930 au fost incercari de tratare a cancerului de san
cu androgeni, mai ales a cancerului avansat. Eficacitatea raportata in jur
de 20%-30% este similara cu cea a altor abordari hormonale sau
anti-hormonale [78]. Karidas et al. a analizat supravietuirea
generala fara
recaderi la pacienti tratati androgenic (testosteron propionat
200 mg sc). Nu a fost observat avantaj de supravietuire la grupul tratat
[79]. Totusi nu a fost evidentiata nici o informatie legata
de nivelurile serice, care sa ne permita sa stabilim daca
dozele administrate au fost adecvate. Datorita efectelor secundare si
aparitiei strategiilor de depletie anti-estrogenice si
estrogenice, terapia androgenica in cancerul de san a fost abandonata.
Garreau et al. au
demonstrat recent eficacitatea
tratamentului combinat cu DHEA si un inhibitor de aromataza, AR
trasncriptati HC 1806, in celule canceroase mamare. Rata de mortalitate
celulara a fost notabil marita prin acest tratament [80].
Autorii concluzioneaza ca terapia androgenica in cancerul de san
AR-pozitiv si ER/PR-negativ in combinatie cu chimioterapia ar putea
creste rata de supravietuire.
Folosirea in clinica a androgenilor in
tratarea cancerului de san a fost limitata datorita efectelor
adverse. Pentru a elimina efecte secundare precum virilizarea, dezvoltarea
modulatorilor de receptori androgenici selectivi (SARM) ar putea fi o abordare
promitatoare. Trebuie sa reasigure, totusi, ca
nicicare din androgenii folositi nu
e aromatizabil sau ca activitatea aromatazei este blocata, pentru a
preveni efectele adverse de proliferare
a celulelor canceroase. SARMs si tratamentul antiestrogenic ar trebui,
teoretic, sa actioneze sinergic pentru inhibarea cresterii
celulelor canceroase.
Partea Speciala
Obiectivele studiului
Spre deosebire de ER si PR al caror rol
in patogeneza cancerului de san este recunoscut, receptorii pentru hormonii
androgeni (AR) au fost mai putin studiati in ceea ce priveste
expresia lor in cancerul mamar si, desi este recunoscut rolul lor in
patobiologia cancerului mamar, mecanismul prin care actioneaza nu
este pe deplin inteles.
In acest context, am studiat expresia
imunohistochimica a AR in glanda mamara in functie de tipul
histopatologic al tumorii si grad, iar rezultatele obtinute le-am
corelat cu imunoexpresia ER/PR, statusul HER2/neu, precum si cu statusul
nodal si metastatic, care reprezinta factori de prognostic
recunoscuti in cancerul mamar.
Material si metode
Am efectuat acest studiu pe un numar total de 156 carcinoame, 38
leziuni benigne si 5 cazuri de glanda mamara normala.
specimenele de
diagnostic au provenit de la Clinicile de Chirurgie I si II ale Spitalului
Judetean Timisoara, de unde au fost trimise in formalina
tamponata la Laboratorul de Tehnici Citologice, Histologice si
Imunohistochimice al UMF "Victor Babes" Timisoara, unde au fost
prelucrate prin includere in parafina. Sectiuni de 6 µm de la fiecare
caz au fost colorate cu hematoxilina-eozina pentru stabilirea
diagnosticului histopatologic si a gradului de diferentiere. De
asemenea, sectiunile au fost prelucrate imunohistochimic, in duplicat
pentru fiecare antigen studiat. Informatiile clinice necesare le-am
preluat de la Clinicile de Chirurgie I si II ale Spitalului Judetean
Timisoara.
Diagnosticul
histopatologic in cazul tumorilor maligne a fost apreciat pe sectiuni
colorate cu hematoxilina-eozina, conform criteriilor OMS 2004.
Marimea tumorii a fost definita ca reprezentand diametrul maxim al
tumorii masurat preoperator sau, in cazul tumorilor nepalpabile, in timpul
examinarii histologice. Gradul de diferentiere l-am apreciat
tinand cont de formarea de tubuli, pleomorfismul nuclear, numarul de
mitoze, dupa sistemul de grading microscopic al carcinoamelor mamare
Scarff-Bloom-Richardson (Elston si Ellis, 1991). De asemenea am tinut cont de
prezenta necrozelor tumorale (tabel
1).
Tabel 1. Sistemul de grading microscopic al
carcinoamelor mamare
Scarff-Bloom-Richardson
|
Formare de tubuli
|
Scor
|
|
> 75%
|
|
|
|
|
<10%
|
|
|
Pleomorfism nuclear
|
Scor
|
|
Nuclei cu
variatii minime de marime si forma
|
|
|
Nuclei cu
variatii moderate de marime si forma
|
|
|
Nuclei cu
variatii marcate de marime si forma
|
|
|
Numarul de mitoze
|
Scor
|
|
< 7
|
|
|
|
|
15 sau >15
|
|
Note:
q
pentru apecierea pleomorfismului
nuclear am evaluat ariile tumorale in care la examinarea cu obiectiv mic am
identificat atipii marcate.
q
numarul
de mitoze s-a apreciat la periferia tumorii, in zonele mitotice cele mai active,
pe 10 campuri din aceeasi arie tumorala, cu obiectivul 40x; celulele
in profaza au fost ignorate.
q
Aprecierea
formarii de tubuli s-a efectuat prin examinare uzuala, implicand
subiectivismul examinatorului
q
Evaluarea
in aceasta maniera ni s-a parut cea mai potrivita, avand in
vedere corelatia cunoscuta din literatura referitoare la
relatia dintre G si supravietuire (asa cum se observa
din tabelul nr 2 )
Tabel nr 2. Relatia grad de
diferentiere (G) - supravietuirea la 5 si 7 ani
|
Grad
|
Descriere
|
Scor
|
Supravietuire la 5 ani
|
Supravietuire la 7 ani
|
|
Grad 1
|
Celule bine
diferentiate, fara crestere rapida si aranjate
sub forma de mici tubuli
|
|
|
|
|
Grad 2
|
Celule moderat
diferentiate, avand caracteristici intermediare intre gradele 1 si
3
|
|
|
|
|
Grad 3
|
Celule slab
diferentiate, crestere rapida, agresivitate
|
|
|
|
Sectiuni
aditionale de la fiecare caz au fost colorate imunohistochimic, receptori
estrogenici, receptori progesteronici, androgenici.
Prelucrarea specimenelor
Biopsiile prelevate chirurgical prin
mastectomie au fost spalate cu ser fiziologic si fixate in
formalina 10% tamponata (pH 7,2). Blocuri mici de tesuturi de
10x10x3 mm au fost mentinute 24 ore in 15-25 ml de formalina 10%,
tamponata.
Procesarea tesuturilor s-a efectuat prin
deshidratare cu ajutorul solutiilor de alcool, clarifiere in benzen
si incluzionare in parafina. Pentru a minimaliza denaturarea
antigenelor, tesuturile nu s-au expus la temperaturi mai mari de 60sC in
cursul incluzionarii in parafina. S-a efectuat apoi sectionare
seriata la microtom (Microm, Zeiss) (15 sectiuni/bloc, cu grosimea de
6-8 microni) pentru diagnosticul primar si evaluare intraexperiment.
Sectiunile au fost montate pe lame si apoi au fost plasate la
termostat la 60sC timp de 60 de minute, apoi la 37oC timp de 24 de
ore, pentru a asigura adeziunea sectiunilor la lame.
Colorarea cu hematoxilina- eozina s-a
efectuat astfel: in vederea colorarii, lamele cu sectiuni tisulare au
fost deparafinate si rehidratate.
Deparafinarea
si rehidratarea sectiunilor: deparafinare la termostat, la 58sC, 60 minute;
lamele s-au plasat apoi in doua bai succesive de benzen a cate 5
minute; au urmat apoi bai succesive de etanol in concentratii
descrescatoare 100%, 95%, 80%, 75%, a cate 5 minute; spalare cu apa distilata sau
deionizata.
Colorarea
cu hematoxilina-eozina: lamele au fost imersionate in hematoxilina
Mayer pentru 3 minute; s-au spalat cu apa curenta 5 minute
pentru a obtine diferentierea; spalare cu apa
distilata 5 minute; imersionare in eozina 30 secunde; spalare cu
apa distilata 5 minute; pentru deshidratare s-au introdus lamele in
doua bai succesive de etanol 100%; uscare la aer; s-au introdus apoi
in benzen 10 minute pentru clarifiere; montare cu balsam de Canada.
Tehnicile de colorare
imunohistochimica permit
vizualizarea antigenelor tisulare sau celulare. Ele se bazeaza pe
imunoreactivitatea anticorpilor si proprietatile chimice ale
enzimelor sau complexelor enzimatice care reactioneaza cu substrate
cromogenice necolorate, pentru a produce compusi finali colorati.
Sistemul DAKO LSAB2/HRP este o tehnica in care un anticorp secundar
biotinilat formeaza un complex cu molecule de streptavidina conjugate
cu peroxidaze si este de patru pana la opt ori mai sensibila
decat tehnica ce foloseste doar complexul avidina-biotina ,
datorita dimensiunii reduse a complexului streptavidina-enzima
marcata. Peroxidaza endogena si activitatea pseudoperoxidazica
se intalneste in hemoproteine, ca si in eozinofile. In
tesuturile fixate in formalina, aceasta activitate poate fi
inhibata prin incubarea specimenelor cu peroxid de hidrogen 3% pentru 5
minute inainte de aplicarea anticorpului primar.
Principiul
procedurii. Tehnica DAKO LSAB2 permite procesarea simultana a mai
multor specimene cu anticorpi primari proveniti de la soarece sau
iepure in mai putin de o ora. Activitatea peroxidazica
endogena este inhibata prin incubare cu peroxid de hidrogen 3%, 5
minute. Specimenul este incubat cu un anticorp primar diluat, apoi pentru 10
minute cu un anticorp secundar biotinilat, ce contine imunoglobuline
anti-soarece sau anti-iepure si streptavidina marcata
enzimatic cu peroxidaza. Colorarea este completata prin incubare cu
un substrat cromogenic, DAB (3, 3´diaminobenzidina dihidroclorid), pentru
5-10 minute. La nivelul situsurilor de legare a antigenului apar precipitate
colorate in brun, care reprezinta produsul final de reactie.
Procedurile
de colorare imunohistochimica in cazul sistemului LSAB2 (Labelled Streptavidin-Biotin
2 System, Horseradish Peroxidase) are urmatoarele etape:
Deparafinare si rehidratare: - deparafinare in benzen la termostat, la
58sC - 60 minute; imersare in doua bai succesive de benzen a cate 10
minute; alcool 100% -10 minute; alcool 96% -10 minute; alcool 80% -10 minute;
alcool 70%-10 minute; apa distilata-10 minute; apa
distilata -10 minute.
Deoarece se stie ca formaldehida induce modificari
conformationale ale moleculelor de antigen prin legaturi
incrucisate intramoleculare ce pot masca situsurile antigenului si
diminua colorarea specifica, pentru tehnicile de imunohistochimie
este necesara demascarea antigenului
prin incalzire la cuptorul cu microunde in tampon citrat pH 6,0, un anumit
timp, in functie de anticorpii folositi, prin utilizarea de
solutii de revelare (target retrieval) sau digestie proteolitica.
Demascare antigenului prin incalzire
la microunde: prepararea
solutiei tampon citrat pH 6; introducerea lamelor in solutia tampon
citrat pH6, 5 minute; incalzire la 90-99sC la cuptorul cu microunde, 10-30
minute (in functie de antigen); racire in solutia de tampon
citrat - 20 minute; spalare cu apa distilata - 5 minute.
Blocarea peroxidazei endogene: apa oxigenata 3% - 5 minute; spalare cu apa
distilata -5 minute;
Aplicarea sistemului LSAB2: spalare
cu tampon fosfat (PBS) - 5 minute; stergerea lamei in jurul
sectiunii; delimitarea sectiunii cu marker-ul DAKO; aplicarea
anticorpului primar (1-2 picaturi) sau reactivului pentru control negativ
- 30 minute; in acest moment se
pregateste solutia DAB: in 10 ml tampon fosfat (PBS) se
dizolva 1 tableta (10 mg) de DAB; spalare cu PBS 5
minute; aplicarea anticorpului biotinilat (link) -10 minute; spalare cu
solutie tampon (PBS) - 5 minute; streptavidina-HRP (streptavidina conjugata cu
peroxidaza -10 minute; Se
activeaza solutia DAB preparata anterior prin adaugarea cu
pipeta a 15 picaturi de apa oxigenata 3%; spalare cu solutie tampon
(PBS) - 5 minute; vizualizare cu substratul cromogenic DAB
(3,3´-diaminobenzidina) activat -10 minute; spalare cu apa
distilata -5 minute.
Contracolorarea: hematoxilina Lillie modificata -3
minute; spalare cu apa curenta - 5 minute; spalare cu
apa distilata - 5 minute. Nucleii celulelor vor fi colorati in
albastru palid.
Deshidratare - clarifiere, montare: alcool 100% - 5 minute; alcool 100%- 5
minute; uscare la aer - 5 minute; benzen -10 minute; montare cu Balsam de
Canada
Controlul
de calitate s-a
realizat prin utilizarea tesuturilor pentru control pozitiv, control
negativ, precum si a reactivilor pentru control negativ extern
furnizati de firma DAKO. Tesuturile pentru control pozitiv au fost
specimene prelevate chirurgical si prelucrate similar probelor provenite
de la paciente fiind utilizate pentru a monitoriza corectitudinea
procesarii tesuturilor, procedeelor de colorare si
eficacitatii reactivilor. Tesuturile pentru control negativ
fixate, procesate si incluzionate in parafina in aceeasi
maniera ca si tesuturile provenite de la paciente au fost
colorate pentru fiecare anticorp primar pentru verificarea
specificitatii acestora. Varietatea de celule diferite prezente pe
toate sectiunile tisulare au servit drept control negativ intern.
Reactivii pentru control negativ furnizati de producator s-au
utilizat de asemenea pentru a evalua coloratia nespecifica. In
interpretarea rezultatelor, tesuturile pentru control pozitiv s-au
examinat primele, apoi sectiunile de control negativ, pentru a verifica
colorarea nespecifica (celulele degenerate si necrotice se
coloreaza frecvent nespecific, precum si tesuturile excesiv fixate in formalina), urmate
apoi de examinarea probelor.
Pentru receptorii
hormonali am folosit tehnica LSAB2 urmand timpii mentionati
anterior, cu precizarea ca timpul de incalzire la microunde la 90-99sC
pentru demascarea antigenului a fost de 20 minute. Anticorpii primari
utilizati pentru receptorii estrogenici, progesteronici si
androgenici au fost: anticorpii monoclonali proveniti de la soarece
anti-Human Estrogen Receptor clona 1D5, anticorpii monoclonali proveniti
de la soarece anti-PR clona PgR 636, anticorpii monoclonali anti-androgen
receptor clona AR441, produsi de firma Dako Cytomation - Danemarca; ca
si control negativ am utilizat DAKO Universal Negative Control +, Mouse.
Cu exceptia anticorpilor anti-androgen receptor, pe care i-am diluat in
raport 1:30, restul anticorpilor folositi au fost furnizati gata
preparati.
Control
negativ extern (ER, PR, AR): sectiuni de la aceleasi cazuri, tratate
cu solutie de control in locul anticorpului. Controlul pozitiv extern (ER,
PR): tesut mamar normal. Controlul pozitiv extern pentru AR: tesut
prostatic normal.
In
cazul receptorilor hormonali, pattern-ul celular de colorare a fost nuclear. Am
utilizat sistemul semicantitativ de evaluare Allred tinand cont de
numarul de nuclei pozitivi si intensitatea coloratiei (Rainer et al. 1990), cu notare de la 0
la 3 (negativ, slab, moderat si intens) (tabel 3). Acest sistem de evaluare l-am aplicat
si pentru receptorii androgenici. Coloratia citoplasmatica
aparuta uneori a fost considerata nespecifica.
Tabel 3. Scorul Allred de
evaluare a receptorilor hormonali
|
Scorul numeric (PS)
|
Scor
intensitate (IS)
|
|
|
|
1 = <1% nuclei pozitivi
|
1 = slab pozitiv
|
|
2 = 1-10% nuclei
pozitivi
|
2 = moderat pozitiv
|
|
3 = 11-33% nuclei pozitivi
|
3 = intens pozitiv
|
|
4 = 34-66% nuclei pozitivi
|
|
|
5 = 67-100% nuclei pozitivi
|
|
|
TS (Scor Total) = PS+IS
|
|
Detectia HER-2/neu prin
metoda imunohistochimica s-a realizat parcurgand aceleasi etape ca si in cazul
receptorilor hormonali, folosind Rabbit Anti-Human HER2 Protein (trusa
HercepTest), cod K 5205 furnizat de Dako Cytomation - Danemarca. Timpii
tehnicii au fost urmatorii: deparafinare si rehidratare ;
demascarea antigenului la microunde, astfel : prepararea solutiei de
demascare prin dilutia solutiei retrieval din trusa HercepTest, cu
apa distilata 1 :10; s-au folosit doua recipiente cu
solutie retrieval preparata ca la punctul anterior; s-a incalzit
solutia dintr-un recipient la 90-99sC, iar in solutia astfel
incalzita s-au introdus lamele si s-au acoperit pentru a
impiedica evaporarea; s-a incalzit solutia din cel de-al doilea
recipient la microunde, la fel ca si prima; s-au mutat lamele din primul
recipient in cel de-al doilea, iar primul s-a reincalzit; succesiunea de incalzire a
solutiilor-mutare a lamelor s-a repetat cat mai des pentru mentinerea unei temperaturi constante de
demascare; durata procedurii de demascare este de 40 minute; racire la
temperatura camerei pentru 20 minute in solutia de demascare;
inlaturarea solutiei de demascare si spalare cu apa
distilata -10 minute; am aplicat procedura de autocolorare cu ajutorul
DakoCytomation Autostainer, cu urmatorii timpi: spalare cu PBS
(preparat din solutia de tampon concentrat din trusa HER2/neu prin
dilutie 1 :10 cu apa distilata) - 5 minute, blocarea
peroxidazei 5 minute cu 200µl apa oxigenata 3%, spalare cu PBS -
5 minute, incubare cu 200µl anticorpi primari anti-HER2 (sau control negativ) -
30 minute, spalare, incubare cu 200µl reactiv de vizualizare (anticorp secundar
cuplat cu dextran polimer conjugat cu peroxidaza) - 30 minute, spalare de
doua ori cu solutie tampon, comutare, incubare 10 minute cu 200µl
solutie DAB (preparata anterior prin adaugarea unei
picaturi de solutie concentrata de cromogen la 1 ml solutie
substrat tamponat DAB din trusa HercepTest), spalare cu apa
deionizata ; colorare nucleara cu hematoxilina Lillie
modificata; deshidratare-clarifiere, montare.
Sectiuni control pozitiv extern pentru HER-2/neu: lame test furnizate
de catre producator pentru HER-2/neu (fig.1 a, b, c). Pentru evaluarea rezultatelor metodei
pentru HER-2/neu am adoptat sistemul Newcastle de apreciere (0, +1, +2, +3), in
care doar +2 si +3 sunt considerate pozitive (Ellis et al.2000) (tabel 5).
Tabel 5. Interpretarea coloratiei imunohistochimice pentru
supraexpresia HER2/neu
|
Model de
colorare
|
Scor
|
Rezultat
|
|
Nu se
observa colorare sau coloratia membranei este observata in mai
putin de 10% dintre celulele tumorale
|
|
Negativ
|
|
Coloratia
membranei este observata in mai mult de 10% dintre celulele tumorale.
Membrana este colorata doar partial si nu pe toata
circumferinta.
|
|
Negativ
|
|
Este
observata o coloratie membranara completa,
slaba
pana la moderata in mai mult de 10% dintre celulele tumoral
|
|
Slab pozitiv
|
|
O
coloratie membranara intensa, completa prezenta in
mai mult de 10% dintre celulele tumorale.
|
|
Intens pozitiv
|
 a
a
 b
b
c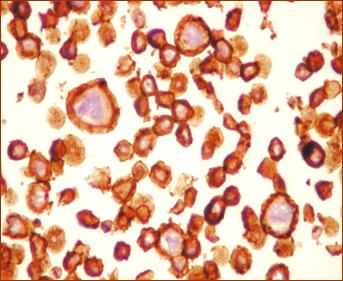
Fig. 1 Lama control pozitiv HER2/neu a) +1; b) +2; c) +3
Analiza statistica
Frecventa distributiei in functie
de varsta, statusul menopauzal, statusul nodulilor axilari, marimea
tumorii, tipul histopatologic, gradul histologic de diferentiere,
receptorii hormonali (estrogenici, progesteronici, androgenici), statusul
HER2/neu a fost comparata utilizand testul chi-patrat cu precizarea
ratei de incidenta (odds ratio) si 95% interval de
confidenta. Am utilizat sistemul de calcul statistic EpiInfo 2005,
varianta 3.3.2. O valoare p<0.05 a
fost considerata semnificativa.
Raportarea finala s-a efectuat in termeni descriptivi pentru toate
cazurile si statistici pentru subloturile definite mai sus.
Examinarea
s-a efectuat cu ajutorul microscopului optic Eclipse600 Nikon, imaginile fiind
preluate cu ajutorul camerei digitale Coolpix950.
Rezultate
Valoarea
diagnostica si terapeutica a receptorilor androgenici
Cu toate ca sanul nu s-a considerat a fi un organ reglat androgenic,
exista dovezi ca androgenii joaca un rol in dezvoltarea
si progresia cancerului mamar. Un numar de studii au aratat
ca productia crescuta de androgeni se coreleaza cu
predispozitie crescuta de a contracta boala, receptorii androgenici
(AR) fiind implicati in reglarea genelor hormonal responsive (Ruliang et al. 2002).
Hipertestosteronemia se observa la aproximativ 40% dintre femeile cu
neoplasm mamar. Productie crescuta de testosteron a fost observata
si la femei cu hiperplazie ductala atipica, care este dupa
cum se stie precursoare a cancerului mamar. Rolul direct al androgenilor
este sustinut si de evidentierea AR in 90% dintre cancerele
mamare, acumularea de androgeni in fluidele ductale, in tesutul mamar
normal si neoplazic si in chistele mamare apocrine. O enzima
exprimata in tesuturile androgen dependente, 5-alfa-reductaza,
joaca un rol important in cancerul de san datorita conversiei
testosteronului la forma sa activa si potenta, dihidrotestosteron
(Dunning et al. 1999).
Dihidrotestosteronul se leaga la AR, iar complexul format,
transactiveaza un numar de gene prin legarea la elementele lor
androgen responsive). Una dintre aceste gene codeaza antigenul specific
prostatic (PSA) (Diamandis, 1998). De
asemenea, androgenii ar putea influenta cancerul mamar si indirect,
prin conversia lor in estradiol, legarea la receptorii alfa-estrogenici si
stimularea proliferarii celulelor tumorale (Haiman et al. 1999). Asocieri cu tumori mamare s-au raportat pentru androgenii adrenali, dihidroepiandrosteron, dihidroepiandrosteron sulfat, androsten-3
beta, 17 beta-diol, prin efect direct si indirect, prin conversia lor la
testosteron. A fost evidentiata activarea receptorilor alfa
estrogenici si stimularea proliferarii liniilor celulare maligne
mamare, in cazul concentratiilor fiziologice ale androgenilor precum
si conversia androgenilor la estrogeni de catre aromataza
intratumorala (Yue et al. 1999).
AR au fost decelati in 49% dintre tumorile estrogen negative si 89%
dintre cele estrogen pozitive (Agoff et
al. 2003). In cazul tumorilor estrogen negative prezenta AR a fost
asociata cu varsta inaintata, postmenopauza, gradul tumorii,
marimea, supra expresia HER-2/neu; in cazul tumorilor estrogen-receptor
pozitive, AR au fost asociati cu prezenta PR. Prezenta AR a fost
asociata si in cazul tumorilor ER negative cu perioada mai
lunga de supravietuire si interval de remisiune mai lung (Suter et al. 2003; Yu et al. 2000). AR
sunt exprimati mai frecvent in cancerul de san decat ER si PR, ceea
ce demonstreaza ca unele tumori exprima numai AR (Yu et al.1999). Dupa o noua
teorie, stimularea cu dehidroepiandrosteron sulfat induce proliferare prin ER,
dar inhiba proliferarea celulara prin AR. Aceasta co-mediere
terapeutica a receptorilor ar putea constitui un nou mijloc de tratament,
eficient in cazul tumorilor ER negative, dar AR pozitive, in asociere cu
inhibitori ai aromatazei pentru a impiedica conversia dihidroepiandrosteronului
la estrogeni. (Toth-Fejel et al. 2004).
Terapia endocrina a devenit o modalitate majora de tratament a
cancerului mamar in toate stadiile sale. Majoritatea cancerelor mamare sunt
stimulate hormonal, iar principiile acestei terapii sunt bazate pe privarea
tumorala de stimulul de crestere indus hormonal (Hayes si Robertson, 2002). Primul pas in stabilirea schemei
terapeutice in cazul pacientilor cu neoplasm mamar il constituie
stabilirea sensibilitatii hormonale a tumorii sau statusul
receptorilor sai hormonali. Terapia endocrina actioneaza in
cazul tumorilor ER pozitive la mai multe nivele si anume: in sensul
scaderii nivelului estrogenic, blocarea ER, scaderea nivelului ER.
Principalele modalitati de tratament sunt: blocarea ER cu
antiestrogen, de exemplu tamoxifen (EBCTCG,
1998); ablatia hormonala, prin metode chirurgicale (ovarectomie),
radioterapie sau medical prin administrarea de analogi ai LH-RH (goserelin);
supresia sintezei de estrogeni cu inhibitori ai aromatazei (citocrom P450), de
exemplu anastrozole; scaderea nivelului ER, prin administrarea de
fulvestrant; administrarea de progestageni (megestrol acetate) (Howell si Johnston, 2002; Diamandis et
al. 1999).
Expresia imunohistochimica a
receptorilor pentru hormonii androgeni
Pentru stabilirea relatiei dintre expresia AR si statusul
hormonal pentru ER, PR si supraexpresia HER2, am constituit un lot omogen
de 156 de cazuri cu carcinom mamar. Constituirea lotului s-a realizat in
maniera ne-randomizata, deoarece toate cazurile cu date insuficiente
sau neclare referitoare la stadiul N si prezenta/absenta
metastazelor au fost excluse.
q
de cazuri investigate
q
sistem
de lucru LSAB2, DAB
q
demascare
de antigen: microunde, citrat pH9, 20 minute
q
incubare
cu anticorp primar (clona AR441, Dako, diluat 1:30) 60 minute la temperatura
camerei
q
cuantificare
semicantitativa in functie de intensitatea imunocoloratiei
si procentul de celule pozitive, respectiv cantitativa prin analiza
microscopica a imaginii cu ajutorului sofware-ului Lucia G, pe imagini
achizitionate JPEG, la calibrare x400. Analiza imaginii s-a efectuat
dupa metoda hot-spot, alegandu-se campurile microscopice cu densitate
maxima a semnalelor pozitive. S-au calculat numarul de semnale
pozitive, aria, volumul echisfera si perimetrul.
q
produs
final de reactie localizat strict nuclear
q
control
pozitiv extern: hiperplazie benigna de prostata 5 cazuri
q
intensitate
moderata si slaba, distributie heterogena
q
la
toate aceste cazuri s-au efectuat: ER, PR, HER2
q
raportare
in functie de forma histopatologica si gradul de
diferentiere
Determinarea prin metode imunohistochimice a AR (receptorilor androgenici)
are valoare prognostica si predictiva a raspunsului la
terapia endocrina, motiv pentru care ne-am propus sa analizam
si acest aspect in studiul nostru.
Spre deosebire de ER si PR al caror rol in patogeneza cancerului
de san este recunoscut, receptorii pentru hormonii androgeni (AR) au fost mai
putin studiati in ceea ce priveste expresia lor in cancerul
mamar si, desi este recunoscut rolul lor in patobiologia cancerului
mamar, mecanismul prin care actioneaza nu este pe deplin
inteles. Steroizii prin receptorii lor nucleari joaca rol important
in dezvoltarea si mentinerea functiei normale a glandei mamare
normale. Alaturi de ER-α, ER-β si PR, receptorii
androgenici sunt prezenti atat in tesutul mamar normal, cat si tumoral,
iar stimularea hormonala a proliferarii epiteliale mamare precum
si apoptoza, sunt importante in mentinerea homeostaziei tisulare (Zhou et al. 2000).
Androgenii exercita o varietate de efecte la nivelul sanului, printre
care: legarea preferentiala la proteinele circulante, ceea ce duce la
cresterea nivelului estradiolului liber, conversia androgenilor prin
intermediul aromatazei in estrogeni, stimularea directa a celulelor
epiteliale mamare prin intermediul AR, fiind demonstrat ca androgenii
regleaza proliferarea celulelor epiteliale mamare AR-pozitive in
cultura (Hackenberg si Schulz,
1996). In studiile experimentale, androgenii determina efecte
inhibitorii si apoptotice in unele linii celulare tumorale mamare.
Efectele diferite exercitate asupra liniilor celulare tumorale mamare sunt
datorate concentratiilor proteinelor co-reglatoare, stimulatoare sau
inhibitoare, de la acest nivel (Somboonporn
si Davis, 2004). Studiile efectuate pe modele animale, indeosebi la
primate sugereaza ca testosteronul poate exercita efect endogen protector si antimitotic
asupra epiteliului mamar stimulat estrogenic, efect mediat via AR (Birrell et al. 1998). Expresia AR este
necesara pentru exercitarea efectelor androgenilor, dar concentratia
absoluta a AR nu este definitorie pentru exercitarea acestor efecte.
Efectele diferite asupra liniilor celulare tumorale mamare sunt datorate
probabil, atat variatiilor in concentratia proteinelor specifice
coreglatoare, cat si polimorfismelor din structura genei AR (Suter et al. 2003), efectele fiind de
asemenea doza-specifice si dependente de tipul de androgen (Ortmann et al. 2002). De asemenea,
androgenii determina stimularea sau inhibarea altor factori de
crestere, ca de exemplu factorul de crestere al fibroblastelor, in
functie de statusul receptorilor. In ceea ce priveste studiile
efectuate pe paciente cu neoplasme mamare, rezultatele au fost mai putin
elocvente. Androgenii au fost asociati cu risc crescut de dezvoltare a
cancerului de san in special la femeile in postmenopauza (Zeleniuch-Jaquotte et al.2004), in timp
ce riscul pentru femeile in premenopauza este controversat (Thomas et al. 1997).
Androgenii determina reducerea expresiei genei ER alfa, iar
tamoxifenul reduce expresia mARN AR, ceea ce vine in sprijinul teoriei ca efectele
tamoxifenului ar fi AR mediate (Zhou et
al. 2000). Progesteronul sintetic, de exemplu medroxiprogesteron acetatul
este utilizat in terapia cancerelor de san, ca linie terapeutica
secundara, in cazurile rezistente la tamoxifen. A fost sugerat ca efectul
antiproliferativ al medroxiprogesteron acetatului este mediat de catre AR
(Birrell et al.1995). Aceste
constatari sugereaza ca determinarea AR ofera
informatii suplimentare in ceea ce priveste raspunsul la terapia
endocrina a cancerelor mamare.
In acest context, am studiat expresia imunohistochimica a AR in glanda
mamara in functie de tipul histopatologic al tumorii si grad,
iar rezultatele obtinute le-am corelat cu imunoexpresia ER/PR, statusul
HER2/neu, precum si cu statusul nodal si metastatic, care
reprezinta factori de prognostic recunoscuti in cancerul mamar.
Rezultate. Majoritatea carcinoamelor (46%) au fost
reprezentate de carcinoame ductal invazive (n=72). Am avut de asemenea
carcinoame lobulare (n=34; 21.8%), DCIS (n=11; 7%), LCIS (n=14; 9%),
nediferentiate (n=11; 7%), medulare (n=8; 5%), mucinoase (n=4; 2.5%),
neuroendocrine (n=3; 1.9%).
Invazia nodala a fost prezenta in 46% cazuri, iar metastazele in
8.33% cazuri.
Imunocoloratia nucleara pentru AR a prezentat variatii largi
intre celulele tumorale, dar in general a fost de intensitate moderata
si slaba, heterogen distribuita. In cazurile cu tesut mamar
normal prezent, coloratia nucleilor de la nivelul ductelor si
lobulilor a fost folosita ca si control intern pozitiv. De remarcat
ca receptorii androgenici au fost pozitivi numai la nivelul celulelor
secretorii (fig.12). In aceste
cazuri, prin analiza cantitativa a imaginii am observat semnale de
intensitate joasa in celule izolate din stroma, celule care au fost
si CD34-pozitive si care nu au fost observate la examinarea
microscopica uzuala.
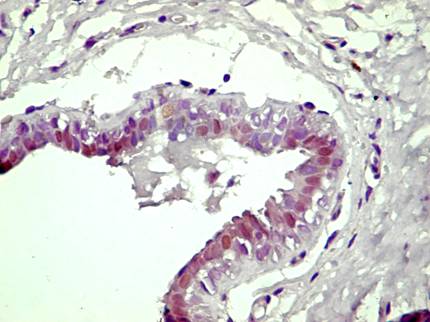
Fig.12. Duct mamar normal. Se observa pozitivitatea AR la nivelul
nucleilor celulelor secretorii, precum si rare fibrocite izolate din
stroma AR-pozitive (AR, x200).
De asemenea, hiperplazia ductala simpla (fig.13) prezenta pe unele sectiuni a prezentat un
numar mare de semnale intens pozitive.
Dupa cum se poate observa in tabelul
15, cel mai mare numar de semnale
pozitive in cadrul leziunilor benigne a fost intalnit in metaplazia
apocrina (fig.14 a,b).
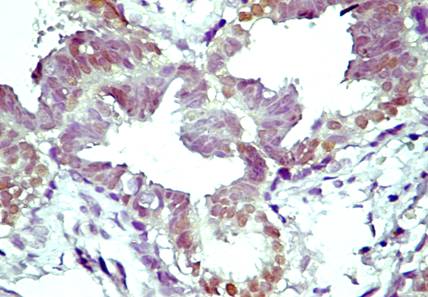
Fig.13. Hiperplazie ductala simpla. Nucleii celulelor glandulare
sunt moderat si intens AR-pozitive (AR, x200).
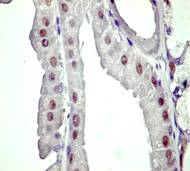 a
a
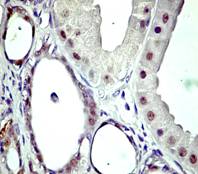 b
b
Fig.14.a) Metaplazie apocrina cu nuclei intens AR-pozitivi; b) Leziuni
de metaplazie apocrina situate in vecinatatea unui carcinom ductal
invaziv, care exprima intens AR.
Din totalul de 156 carcinoame, 112 au exprimat AR (72%). In functie de
tipul de carcinom (tabel 16, grafic 1),
cele mai multe cazuri AR pozitive le-am intalnit in carcinomul ductal invaziv
(95.8%) (fig.16), (DCIS (90.0%)
si medular (87.5%) (fig.17). In
cazul carcinomului lobular (fig.18),
18/34 (53%) au prezentat reactie pozitiva pentru AR. Am avut relativ
putine cazuri de carcinoame cu diferentiere apocrina, dar toate
au fost intens AR-pozitive.
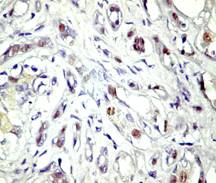
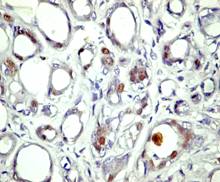
Fig.16. Carcinom ductal invaziv. Se
observa expresia AR numai la nivelul nucleilor celulelor tumorale (AR,
x400).
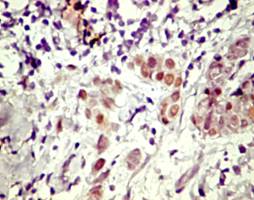
Fig.17. Carcinom medular cu o imunoexpresie
intensa pentru AR la nivelul celulelor tumorale si absenta
reactiei la nivelul celulelor stromale si limfocitelor (AR, x400)
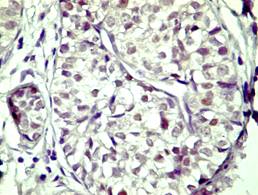
Fig.18. Carcinom lobular invaziv. Nucleii
celulelor tumorale exprima moderat AR (AR, x400).
Tabel 16.
Raportare in functie de forma histopatologica
|
Forma
histopatologica
|
Expresie
IHC a AR
|
|
|
Carcinom ductal
invaziv (n=72)
|
|
|
|
Carcinom
lobular invaziv (n=34)
|
|
|
|
Carcinom ductal
in situ (n=11)
|
|
|
|
Carcinom
lobular in situ (n=14)
|
|
|
|
Carcinom
medular (n=8)
|
|
|
|
Carcinom
mucinos (n=4)
|
|
|
|
Carcinom
nediferentiat (n=10)
|
|
|
|
Carcinom
neuroendocrin (n=3)
|
|
|
|
Total (n=156)
|
|
|
Grafic 1
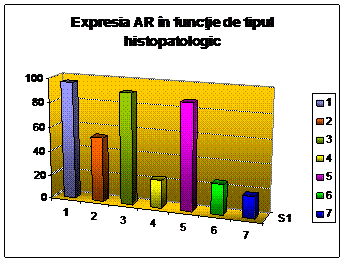
Legenda
1 = carcinom ductal
invaziv (95.8%)
2 = carcinom lobular
invaziv (53%)
3= DCIS (90.9%)
4 = LCIS (23%)
5 = carcinom medular
(87.5%)
6 = carcinom mucinos
(25%)
7 = carcinom
nediferentiat (18%)
In ceea ce priveste gradul histologic, din graficul
5 si tabelul 27 se poate observa ca AR sunt exprimati mai
frecvent in cazul carcinoamelor bine (78.8%) si moderat diferentiate
(75.5%).
Tabel 17.
Reactia pozitiva pentru AR in functie de gradul de
diferentiere
|
G
|
AR pozitiv
|
|
|
G1 (n=33)
|
|
|
|
G2 (n=94)
|
|
|
|
G3 (n=29)
|
|
|
Grafic 2
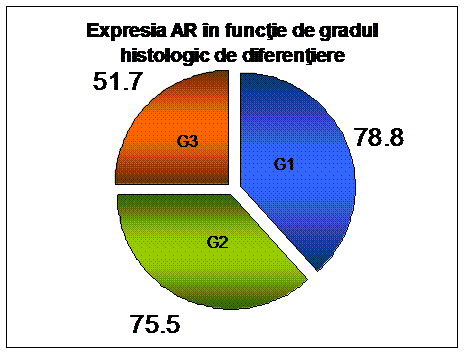
ER
au fost exprimati in 54.5% cazuri, iar PR in 60.25% cazuri. HER2 a fost
supraexprimat (+2, +3) in 37.18% cazuri.
Atunci cand cazurile
au fost grupate in carcinoame AR-pozitive respectiv AR-negative, am observat o
puternica corelatie statistica intre expresia AR si gradul
histologic (p<0.05), tipul histopatologic (p≤0.001) si statusul
nodal (p=0.02). Majoritatea carcinoamelor AR-pozitive au fost fara
invazie nodala, bine diferentiate si de tip ductal. Nu am
observat o corelatie semnificativa cu expresia HER2/neu, ER, PR
si prezenta metastazelor.
Dintre cazurile AR
pozitive, 59/112 (52.6%) au fost concomitent pozitive si pentru ER, iar
67/112 (60%) au fost concomitent AR+/PR+. In ceea ce priveste invazia
nodala, 58/112 cazuri AR pozitive au prezentat invazie limfatica
nodala, iar metastazele au fost prezente doar in 7% dintre cazurile AR
pozitive (tabel 18).
Tabel 18. Carcinoame AR pozitive. Relatia
cu expresia ER/PR,
statusul nodal si metastatic.
|
Parametru
|
Cazuri AR pozitive
|
|
ER+
ER-
|
|
|
PR+
PR-
|
|
|
N+
N-
|
|
|
M+
M-
|
|
Discutii
Studiile biochimice si imunohistochimice au relevat o pozitivitate a
AR in cancerul de san intre 70-90% (Isola,
1993; Ellis et al. 1989), iar procentele raportate de cazuri AR pozitive
sunt mai mari decat in cazul ER alfa (60-80%) sau PR (50-70%) (Kimura et al.1993). S-a observat o
relatie intre expresia AR si varsta, status menopauzal, grad
histologic, status nodal, fara insa sa fie observata o
relatie cu intervalul liber de boala sau recurentele tumorale;
nu s-a observat o relatie cu HER2/neu (Bieche
et al. 2001). Desi in mod
frecvent ER, PR si AR sunt coexprimati la nivelul celulelor tumorale
mamare, sunt raportate cazuri de tumori maligne (10%) si metastaze mamare
(25%) pozitive doar pentru AR si a fost sugerat ca AR ar putea fi
utili in identificarea tumorii primare. (Bayer-Garner
si Smoller, 2000; Kuenen-Boumeester et al. 1996). Agoff si
colab., au determinat prevalenta AR pe subseturi de tumori ER
negative, respectiv pozitive si au observat expresie a AR in 49% dintre
tumorile ER negative si 89% dintre cele ER pozitive, iar pacientele cu tumori
AR pozitive au prezentat un interval liber de boala crescut, fiind sugerat
ca AR poate fi utilizat in subdivizarea tumorilor ER negative in grupuri
cu prognostic bun sau defavorabil (Agoff
et al. 2003). Moinfar et al. au identificat expresia AR in 60% dintre
carcinoamele invazive si 82% dintre DCIS. In functie de gradul de
diferentiere, carcinoamele bine diferentiate (G1) au fost 90% AR
pozitive, fata de 46% dintre cele slab diferentiate (G3) (Moinfar et al. 2003).
In studiul nostru, AR au fost exprimati in 112/156 cazuri (71.8%),
rezultat in concordanta cu studiile mentionate anterior. Dintre
carcinoamele AR-pozitive, 59/112 (52.6%) au fost ER-pozitive si 53/112
(47.3%) au fost ER-negative; 67/112 (59.8%) au fost PR pozitive si 45/112
(40.17%) au fost PR-negative. In acord cu alte studii (Agoff et al.2003; Bieche et al.2001; Isola et al.1993) am observat
o puternica corelatie cu gradul histologic tumoral, dar nu si cu
supraexpresia HER2/neu.
Caracterul apocrin a fost asociat cu prezenta imunoexpresiei AR
si pierderea expresiei ER/PR (Selim
et al. 2002; Leal et al. 2001). Am avut relativ putine cazuri de
carcinoame invazive sau DCIS cu diferentiere apocrina, dar toate
aceste cazuri au prezentat un pattern similar, fiind pozitive pentru AR si
negative pentru receptorii estrogenici si progesteronici.
Concluzii
In concluzie, in cadrul carcinoamelor mamare studiate, AR au fost
exprimati cu prevalenta
de 72%. Am observat o corelatie statistica puternic
semnificativa intre expresia AR si tipul histopatologic al tumorii
(p≤0.001), cele mai multe carcinoame AR-pozitive fiind de tip ductal
invaziv si ductal in situ, medular si lobular; de asemenea
corelatie puternic semnificativa statistic am observat intre expresia
AR si gradul histologic tumoral (p=0.007) (78.8% dintre tumorile bine
diferentiate fiind AR pozitive, fata de 51% dintre cele slab
diferentiate, precum si cu statusul nodal (p=0.02). Dintre tumorile
AR pozitive, 52% au fost ER pozitive si 60% au fost PR pozitive. Nu am
observat corelatie semnificativa statistic intre expresia AR si
expresia HER2/neu si nici intre expresia AR si prezenta
metastazelor la distanta. Studierea acestor fenotipuri in asociere cu
alti markeri poate fi utila in stabilirea prognosticului si
evolutiei bolii, precum si in elaborarea unor noi strategii
terapeutice.
Bibliografie
Agoff SN, Swanson PE, Linden H. Androgen receptor
expression in estrogen receptor-negative breast cancer. Immunohistochemical,
clinical and prognostic associations. Am J Clin Pathol 2003; 120:725-731.
Allred DC, Harvey JM, Berardo M.
Prognostic and predictive factors in breast cancer by immunohistochemical
analysis. Mod Pathol 1998; 11:155-168.
American Cancer Society: Cancer Facts and Figures 2004.
Atlanta, GA:
American Cancer Society 2004
Bayer-Garner IB, Smoller B. Androgen receptors: a
marker of increase sensitivity for identifying breast cancer in skin metastasis
of unknown primary site. Mod Pathol 2000; 13:119-122.
Bernstein L, Ross RK. Endogenous hormones and breast
cancer risk. Epidemiol Rev 1993; 15: 48-65.
Bieche I, Parfait B, Tozlu S, Lidereau R, Vidaud M.
Quantitation of androgen receptor gene expression in sporadic breast tumors by
real-time RT-PCR: evidence that MYC is an AR-regulated gene.Carcinogenesis
2001;22:1521-1526.
Birrell SN,
Bemtel JM, Hickey TE, Ricciardelli C, Weger MA, Horsfall DJ, Tilley WD. Androgens
induce divergent proliferative responses in human breast cancer cell lines, J
Steroid Biochem Mol Biol 1995; 52:459-467.
Birrell SN, Hall RE, Tilley WD. Role of androgen receptor
in human brest
cancer. J Mammary Gland Neoplasia 1998; 3:95-103.
Broeders MJ, Verbeek AL. Breast cancer epidemiology and
risk factors. Quarterly J Nuclear Med 1997; 41:179-188.
Brown
RE. HER-2/neu-Positive Breast Carcinoma: Molecular Concomitants by Proteomic
Analysis and their Therapeutic Implications. Ann Clin Lab Sci. 2002;
32:12-21
Cline
JM, Soderqvist G, von Schoultz E, Skoog L and von Schoultz B. Effects of
hormone replacement therapy on the mammary gland of surgically postmenopausal
macaques. Am J Obstet Gynecol 1996;174:93-103.
Colditz
GA, Rosner BA, Chen WY, Holmes MD, Hankinson SE. Risk Factors for Breast Cancer
According to Estrogen and Progesterone Receptor Status. J Natl Cancer Inst
2004; 3:218-228.
Collaborative
Group on Hormonal Factors in Breast Cancer Breast cancer and hormonal
contraceptives: collaborative reanalysis of individual data on 53.297 women
with breast cancer and 100.239 women without breast cancer from 54
epidemiological studies. Lancet 1996; 347:1713-1727.
Collaborative
Group on Hormonal Factors in Breast Cancer Breast cancer and hormone
replacement therapy: collaborative reanalysis of data from 51 epidemiological
studies of 52.705 women with breast cancer and 108.411 women without breast
cancer. Lancet 1997; 350:1047-1059.
Collins
N, Gregory S, Gumbs C and Micklem G. Identification of the breast cancer
susceptibility gene BRCA2. Nature 1995: 378: 789-792.
Davis
DL, Axelrod D, Osborne M, Telang N, Bradlow HL, Sittner E. Avoidable causes of
Breast Cancer: The Known, Unknown, and the Suspected. Ann Acad Sci 1997;
89:71-76.
Diamandis
EP, Helle SJ, Yu H, Melegos DN, Lundgren S, Lonning PE. Prognostic value of
plasma prostate specific antigen after megestrol acetate treatment in patients
with metastatic breast carcinoma.Cancer 1999; 85:891-898.
Diamandis
EP. Prostate-specific antigen-its usefulness in clinical medicine. Trends
Endocrinol Metab 1998; 9:310-316.
Dunning
AM, McBride S, Gregory J, Durocher F, Foster NA, Healey CS, Smith N, Pharoah
PDP, Luben RN, Easton DF, Ponder BAJ. No association between androgen receptor
or vitamin D receptor gene polymorphism and risk of breast cancer.
Carcinogenesis 1999; 20: 2131-2135.
Early
Breast Cancer Trialists Collab Group. Tamoxifen for early breast cancer: an
overview of the randomised trials. Lancet 1998; 351:1451-1467.
Elledge
RM, Green S, Ciocca D. HER-2 expression and response to tamoxifen in estrogen
receptor-positive breast cancer: a Southwest Oncology Group study. Clin Cancer
Res 1998; 4:7-12.
Ellis
IO, Dowsett M, Bartlett J, Walker R, Cooke T. Recommendations for HER2 testing
in the UK.
J Clin Pathol 2000; 53: 890-892.
Ellis
LM, Wittliff L, Bryant MS. Correlation of estrogen, progesterone and androgen
receptors in breast cancer. Am J Surg 1989;157:577-581.
Ellison RC, Zhang Y, McLennan CE, Rothman
KJ. Exploring the relation of alcohol consumption to the risk of breast
cancer. Am J Epi 2001; 154: 740-747.
Espinosa AB,
Tabernero MD. Her2/neu gene amplification in familial vs sporadic breast cancer
impact on the behavior of the disease. Am J Clin Pathol 2003; 120:917-927.
Feigelson
HS and Henderson BE. Estrogens and Breast cancer. Carcinogenesis 1996;
17:2279-2284.
Goldberg
MS, Labreche F. Occupational risk factors for female breast cancer: a review.
Occupat Environ Med 1996; 53:145-156.
Hackenberg R
and Schultz KD. Androgen receptor mediated growth control of breast
cancer and endometrial cancer modulated by antiandrogen- and androgen-like
steroids. J Steroid Biochem Mol Biol 1996; 56:113-117.
Haiman
CA, Hankinson SE, Spiegelman D, Colditz GA, Willett CW, Speizer FE, Kelsey KT
and Hunter DJ. The relationship between a polymorphism in CYP17 with plasma
hormone levels and breast cancer. Cancer Res 1999; 59:1015-1020.
Hankinson SE, Willett CW, Manson JAE,
Colditz GA, Hunter DJ, Spiegelman D, Barbieri RL, Speizer FE. Plasma sex
steroid hormone levels and risk of breast cancer in postmenopausal women. J
Natl. Cancer Inst 1998; 90:1292-1299.
Hansen
J. Breast cancer risk among relatively young women employed in solvent-using
industries. Am J Industr Med 1999; 36:43-47.
Harris
L, Fritsche H, Mennel R, Norton L, Ravdin P, Taube S, Sommerfield MR, Hayes DF,
Bast RC Jr. American Society of Clinical Oncology 2007 Update of
Recommendations for the use of Tumor Markers in Breast Cancer. J Clin Oncol
oct. 2007, 33
Hayes DF, Robertson JFR. Overview
and concepts of endocrine therapy. In: Robertson JFR, Nicholson RI, Hayes DF.
Endocrine therapy of breast cancer. London:
Martin Dunitz, 2002: 3-10.
Henderson BE, Bernstein L
and Ross R. Etiology of cancer: hormonal factors. In DeVita, VT, Hellman S and Rosenberg SA. Cancer: Principles
and Practice of Oncology. 5th edn. Lippincott-Raven, 1997, pp. 219-229.
Henderson BE. Genetic
susceptibility to cancer from exogenous and endogenous exposures. J Cell
Biochem 1996; 25S:15-22.
Holford TR, Zheng T, Mayne ST, Zham SH, Tessari JD, Boyle P.
Joint effects of nine polychlorinated biphenyl (PCB) congeners on breast cancer
risk. Int J Epidemiol 2000; 6:975-982.
Howell
A, Johnston
SRD. Selective estrogen receptor modulators (SERMs). In: Robertson JFR,
Nicholson RI, Hayes DF. Endocrine therapy of breast cancer. London: Martin Dunitz, 2002: 45-62.
Isola
JJ. Immunohistochemical demonstration of androgen receptor in breast cancer and
its relationship to other prognostic factors. J Pathol 1993;170:31-35.
Jemal
A, Murray T, Ward E, Samuels A, and Thun MJ. Cancer Statistics, 2005. CA Cancer
J Clin 2005; 55:10-30.
Jianbo Wu, J Richer, Kathryn B. Horwitz,
SM. Hyder; Progestin-Dependent Induction of Vascular Endothelial Growth
Factor in Human Breast Cancer Cells Preferential Regulation by Progesterone
Receptor B Cancer Res 2004;64:2238-2244
Kadouri
L, Easton DF, Edwards S, Hubert A, Kote-Jarai Z, Glaser B, Durocher F,
Abeliovich D, Peretz T, Eeles RA. CAG and GGC repeat polymorphisms in the
androgen receptor gene and breast cancer susceptibility in BRCA1/2 carriers and
non-carriers. Br J Cancer 2001; 85:36-40.
Khandwala
HM,McCutcheon IE,Flyvbjerg A, Friend KE. The effects of insulin-like growth
factors on tumorigenesis and neoplastic growth. Endocr Rev 2000; 21: 215-244.
Kimura N, Mizokami A, Oonuma T, Sasano H, and Nagura H.
Immunocytochemical localization of androgen receptor with polyclonal antibody
in paraffin-embedded human tissues. J Histochem Cytochem. 1993; 41:671-678.
Kuenen-Boumeester V, Van Der Kwast TH,
Claassen CC, Look MP, Liem GS, Klijn JGM, and Henzen-Logmans SC. The
clinical significance of androgen receptors in breast cancer and their relation
to histological and cell biological parameters. Eur J Cancer 1996; 32A:
1560-1565.
Laden
F, Hunter DJ. Environmental Risk Factors and Female Cancer. Ann Rev of Public
Health 1998; 19:101-123.
Leal
C, Henrique R, Monteiro P, Lopes C, Bento MJ, De Sousa CP, Lopes P, Olson S,
Silva MD, Page DL. Apocrine ductal carcinoma in situ of the breast: histologic
classification and expression of biologic markers. Hum Pathol 2001; 32:487-493.
Li
FP. Familial aggregation. In Schottenfeld D, Fraumeni JF.Cancer Epidemiology
and Prevention. 2nd edn. Oxford University Press 1996, New York, pp. 546-558.
Lianidou ES,Angelopoulou K,Katsaros
D,Durando A,Massobrio M,Diamandis EP. Fragment analysis of the p53 gene
in ovarian tumors. Clin Biochem 1998; 31:551-553
Lichtenstein
P, Holm NV, Verkasalo PK, Iliadou A, Kaprio J, Koskenvuo M, Pukkala E, Skytthe
A, Hemminki K. Environmental and Heritable Factors in the Causation of
Cancer-Analyses of Cohorts of Twins from Sweden, Denmark, and Finland. N engl J
Med 2000; 343:78-85.
Lipworth
L, Adami HO, Trichopoulos D, Carlstrom K and Mantzoros C. Serum steroid hormone
levels, sex hormone-binding globulin and body mass index in the etiology of
postmenopausal breast cancer. Epidemiology 1996; 7: 96-100.
MacGrogan G, Soubeyran G, de Mascarel I. Immunohistochemical detection of
progesterone receptors in breast invasive ductal carcinomas: a correlative
study of 942 cases. Appl Immunohistochem 1996; 4:219-227.
Maggiolini
M., Donzé O, Jeannin E, Andň S, Picard D. Adrenal androgens stimulate the
proliferation of breast cancer cells as direct activators of estrogen receptor
alfa. Cancer Res 1999; 59: 4864-4869.
McTiernan
A. Exercise and Breast Cancer-Time To Get Moving? The N Engl J Med 1997;
336:1311-1312
Moinfar
F, Okcu M, Tsybrovskyy O, Regitnig P, Lax SF, Weybora Ratschek M, Tavassoli FA,
Denk H. Androgen receptors frequently are expressed in breast carcinomas:
potential relevance to new therapeutic strategie. Cancer 2003; 98:703-711.
Moreno A, Lloveras B,
Figueras A. Ductal carcinoma in-situ of the breast: Correlation between
histologic classification and biologic markers. Mod Pathol 1997;10:1088-1092.
Oesterling
JE. Prostate specific antigen: a critical assessment of the most useful tumor
marker for adenocarcinoma of the prostate.J Urol 1994;145:902-923
Ortmann J, Prifti S, Bohlmann MK,
Rehberger-Schneider S, Strowitzki T, Rabe T. Testosterone and 5α-dihydrotestosterone inhibit in vitro
growth of human breast cancer cell lines. Gynecol Endocrinol 2002;
16:113-120.
Petralia SA, Vena JE, Freudenheim JL, Dosemeci M,
Michalek A, Goldberg MA, Brasure J, Graham S. Risk of premenopausal breast
cancer in association with occupational exposure to polycyclic aromatic
hydrocarbons and benzene. Scandin J Work Envir Health 1999; 25:215-221.
Pharoah
PD, Day NE, Caldas C. Somatic mutations in the p53 gene and prognosis in breast
cancer: a meta-analysis. Br J Cancer 1999;1968-1973.
Pietras
R.J. and Pegram M.D. Oncogene activation and breast cancer progression.In Manni
A. Endocrinology of Breast Cancer. Humana Press 1999, 133-154
Pike
MC, Spicer DV, Dahmoush L and Press MF. Estrogens, progesterons, normal breast
cell proliferation and breast cancer risk. Epidemiol Rev 1993; 15:17-35.
Reiner
A, Neumeister B, Spona J. Immunocytochemical localization of estrogen and
progesterone receptor and prognosis in human primary breast cancer. Cancer Res
1990; 50:1057-1061.
Romain
S, Laine Bidron C, Martin PM. Steroid receptor distribution in 47 892 breast
cancers. A collaborative study of 7 European laboratories. Eur J Cancer
1995;31A:411-417.
Rosen
PP, Lesser ML, Arroyo CD. Immunohistochemical detection of Her-2/neu expression
in patients with axillary lymph node-negative breast carcinoma. A study of epidemiologic
risk factors, histologic features and prognosis. Cancer 1995;75:1320-1326.
Ross
Jeffrey S, Fletcher Jonathan A.; HER-2/neu Oncogene in Breast
Cancer: Prognostic Factor, Predictive Factor, and Target for Therapy.Stem Cells
1998;6:413-428
Ruliang
Xu, Perle MA, Inghirami G, Chan W, Delgado Y, Feiner H. Amplification of
Her-2/neu gene in Her-2/neu-overexpressing and-nonexpressing breast carcinomas
and their synchronous benign, premalignant, and metastatic lesions detected by
FISH in archival material. Mod Pathol 2002; 15:116-124.
Safe
SH. Endocrine Disruptors and Human Health-Is There a Problem? An Update.
Environ Health Perspec 2000; 108:487-493.
Segnan
N. Socioeconomic status and cancer screening. International agency for Research
on Cancer 1997; 138:360-376.
Selim
A, El-Ayat G and Wells CA. Androgen receptor expression in ductal carcinoma in
situ of the breast: relation to oestrogen and progesterone receptors. J Clin Pathol 2002; 55:14-16.
Slamon
D, Leyland-Jones B, Shak S. Addition of Herceptin (humanized anti HER2
antibody) to first line chemotherapy for HER2 overexpressing metastatic breast
cancer markedly increases anticancer activity: a randomized, multinational
controlled phase III trial. Proc Am Soc Clin Oncol 1998;17:98a
Slamon
DJ, Clark GM, Wong SG. Human breast cancer: correlation of relapse and survival
with amplification of the Her-2/neu oncogene. Science 1987; 235:177-182.
Somboonporn
W and Davis S. Testosterone effects on the breast: implications for
testosterone therapy for women. Endocrine Reviews 2004; 25:374-388.
Somerville JE, Clarke LA,
Biggart JD. C-erbB-2 expression and histological type of in situ
and invasive breast carcinoma. J Clin Pathol 1992; 45:16-20.
Suter
NM, Malone KE, Daling JR, Doody DR and Ostrander EA. Androgen
Receptor (CAG)n and (GGC)n Polymorphisms and Breast Cancer Risk in a
Population-Based Case-Control Study of Young Women. Cancer Epidemiol Biomarkers
Prev 2003; 12:127-135.
Taucher
S, Rudas M, Mader RM, Gnant M, Dubsky P, Bachleitner T, Roka S, Fitzal F, Kandioler
D, Sporn E, Friedl J, Mittlbock M, Jakesz R. Do we need HER-2/neu testing for
all patients with primary breast carcinoma? Cancer 2003; 98:2547-2553.
Thomas
HV, Key TJ, Allen DS, Moor JW, Dowsett M., Fentiman IS, Wang DY. A prospective
study of endogenous serum hormone concentrations and breast cancer risk in
postmenopausal women on the island
of Guernsey. Br J Cancer
1997; 76:401-405.
Thune
I, Brenn T, Lund E, Gaard M. Physical activity and the risk of breast cancer. N
Engl J Med 1997; 336:1269-1275.
Toniolo
PG, Levitz M, Zeleniuch-Jacquotte A, Banerjee S, Koenig KL, Shore R E, Strax P,
Pasternack BS. A prospective study of endogenous estrogens and breast cancer in
postmenopausal women. J. Natl Cancer Inst 1995; 87:190-197.
Toth-Fejel
S, Cheek J, Calhoun K, Muller P, Pommier RF. Estrogen and androgen receptors as
co-mediators of breast cancer cell proliferation: providing a new therapeutic
tool. Arch Surg 2004; 139:50-54.
Ursin
G, Ross RK, Sullivan-Haley J, Hanisch R, Henderson B, and Bernstein L. Use of
oral contraceptives and risk of breast cancer in young women. Breast Cancer Res
1998; 50:175-184.
Weiss
HA, Potischman NA, Brinton L, Brogan D, Coates RJ, Gammon MD, Malone KE,
Schoenberg JB. Prenatal and Perinatal Factors for Breast Cancer in Young Women.
Epidemiology 1997; 8:181-187.
Westberg
L, Baghaei F, Rosmand R, Hellstrand M, Landén M, Jansson M, Holm G, Björntorp
P, Eriksson E. Polymorphisms of the androgen receptor gene and the estrogen
receptor ß gene are associated with androgen levels in women. J Clin
Endocrinol. Metab 2001; 86: 2562-2568.
Wohlfahrt
J, Andersen PK,
Mouridsen HT, Melbye M. Risk of late stage breast cancer after childbirth. Am J
Epidemiol 2001; 153:1079-1084.
Yu
H, Bharaj B, Vassilikos EJK, Giai M, Diamandis EP. Shorter CAG repeat length in
the androgen receptor gene is associated with more aggressive forms of breast
cancer. Breast Cancer Res Treat 2000; 59:153-161.
Yu H, Levesque M, Clark GM, Diamandis EP. Enhanced
prediction of breast cancer prognosis by evaluating expression of p53 and
prostate-specific antigen in combination. Br J Cancer 1999; 81:490-495.
Yue
W, Wang JP, Hamilton CJ, Demers LM, Santen RJ. In situ aromatization enhances
breast tumor estradiol levels and cellular proliferation. Cancer Res 1999;
58:927-932.
Zeleniuch-Jacquotte
A, Shore RE, Koenig KL, Akhmedkhanov A, Afanasyeva Y, Kato I, Kim My, Rinaldi
S, Kaaks R, Toniolo P. Postmenopausal levels of oestrogen, androgen, and SHBG
and breast cancer: long-term results of a prospective study. Br J Cancer 2004;
90:153-159.
Zhou J, Ng S, Adesanya-Famuiya O, Anderson K,
Bondy CA. Testosterone inhibits estrogen-induced mammary epithelial
proliferation and suppresses estrogen receptor expression. FASEB J 2000;
14:1725-1730.




 a
a 



 a
a
 b
b




