CARF - o proteina reglatoare a caii p53 de senescenta
si supresie tumorala
Articol publicat
in: Mechanisms of Ageing and Development 130 (2009) 18-23.
Autori: Caroline T.Y. Cheung, Md. Kamrul Hasan, Nashi Widodo, Sunil
C. Kaul, Renu Wadhwa.
Abstract
Senescenta
replicativa, finalitate normala pentru celulele cu o lungime finita de viata,
este un model in vitro acceptat pe larg pentru studiile ce privesc
imbatranirea. Mecanismele limitate de refacere si aparare ale celulelor
normale, in plus fata de modificarile ADN si inducerea de oncogene in conditii
de stres au ca rezultat senescenta ca mecanism de protectie contra proliferarii
nedorite a celulelor. Calea ARF/p53/p21 de supresie tumorala actioneaza ca si senzor
molecular si reglator al stresului celular, senescentei si imortalizarii.
Intelegerea reglarii moleculare a acestei cai prin semnale intrinseci si
extrinseci este extrem de importanta pentru a intelege aspecte inca nerezolvate
din imbatranire si cancer. CARF a fost descoperita pentru prima oara ca si
partener de legare pentru ARF si de atunci i s-au gasit functii atat ARF
dependenta cat si independente, care converg toate spre calea p53. CARF seleaga
direct la p53 si HDM2, si functioneaza intr-o cale de reglare prin feed-back
negativ. In timp ce CARF represeaza transcriptional HDM2 pentru a creste
activitatea lui p53, HDM2 in schimb degradeaza CARF. Astfel, CARF poate actiona
ca un nou reglator cheie a caii p53 la multiple punte de legatura. Tinta acestui
articol este sa discute cunostintele actuale despre functiile CARF si impactul
sau asura caii p53 in reglarea senescentei si carcinogenezei.
Introducere
Senescenta: un rezultat al supresiei tumorale si al mecanismelor de
regenerare si aparare ineficiente.
Potentialul
de repicare limitat si durata vietii celulelor normale, numit si senescenta
replicativa sau limita Hayflick se bazeaza pe numerosi factori, precum apararea
si repararea limitata a celulelor normale, care converg in mecanisme active de
supresie tumorala. In ultimele decenii, studii genetice si moleculare au
revelat numeroase efecte ale senescentei celulare si rolul lor in controlul
imortalizarii celulare si tumorigenezei. Oricum, legatura puternica intre
imbatranire si cancer a fost scoasa la lumina de un numar de descoperiri cheie
care includ:
(i)
disreglarea mecanismelor de
supresare tumorala este o caracteristica a ambelor fenomene
(ii)
pierderea telomerelor ( o
caracteristica bina stabilita a celulelor imbatranite) care poate servi ea
insasi ca un mutagen robust si determina fuziuni cromosomale capat la capat si
aneuploidie, formand o legatura puternica intre senescenta si aneuploidie;
(iii)
Leziunile cauzate in ADN de
radicalii liberi determina celulele fie sa moara fie sa supravietuiasca cu
degenerari functionale, care pot duce la cancere;
(iv)
Senescenta e acompaniata de
reglarea pozitiva a genelor ce codifica pentru o varietate de factori de
crestere solubili, enzime remodelatoare de matrice, si citokine proinflamatorii
care contribuie la patologiile legate de varsta care includ cancerele.
S-a demonstrat ca inactivarea unuia
sau mai multor mecanisme de suprimare tumorala se petrece deseori in timpul
imortalizarii celulare si/sau tumorigenezei, ducand la intelegerea faptului ca
senescenta celulara este un mecanism de supresie tumorala. Alte caracteristici
ale cancerului implica alterari ale ADN, precum mentinerea lungimii telomerelor
si instabilitate genomica. Datorita problemei implicite de terminare a
replicarii in celulele eucariote, sfarsitul cromozomilor (telomerele) se
scurteaza de fiecare data cand celula se divide. Astfel, lungimea telomerelor
ne poate oferi o masura a timpului celular, numindu-se si "pastratorii timpului
celular". O sustinere fenomenala privind rolul scurtarii telomerelor in senescenta
a fost oferit de studiile ce folosesc celule tumorale aratand o mentinere a
telomerelor, cauzata fie de o supraexpresie a telomerazei, sau de mecanisme
independente de aceasta, numite alungiri alternative ale telomerelor. Celulele
tumorale sunt marcate mereu de anomalii cromosomale si instabilitati variind de
la mutatii, deletii, amplificari, translocari si anuploidii. Desi mecanismele
moleculare ale instabilitatii genetice in cancer nu sunt bine intelese, dovezi
experimentale considerabile sustin implicarea ruperilor bicatenare ale ADN si a
unor mecanisme de reparare ineficiente care necesita activarea de multiple gene
inclusiv: BRCA1, ATM, ATR, Chk 1, Chk 2, BLM, RAD50, MRE11, NBS1, p53, H2AX si
altele. S-a demonstrat ca fosforilarea histonei H2AX faciliteaza formarea de
loci de distrugere aADN in jurul telomerelor fara cap, fpt care activeaza
kinazele in aval Chk1 si Chk2 si, in final, p53. Activarea persistenta a
acestei cai de semnalizare este necesara pentru a mentine celulele intr- stare
de senescenta. Astfel, senescenta celulare poate fi privita ca o stare
permanenta de alerta la lezarea ADN.
Senescenta este caracterizata de mai
multe trasaturi fenotipice: celula se largeste si capata o forma plata si
neregulata.; creste expresia de beta galactozidaza; apar alterari in expresia
genica, inclusiv pentru p53 pRB, p21 si p16, care par a fi relevante functional
pentru stabilirea si mentinerea starii senescente. Ele sunt insotite de o
scadere a (i) capacitatii defensive a celulei, inclusiv chaperonele si
degradarea proteasomala care recicleaza deseurile moleculare; (ii)
activitatilor antioxidante care protejeaza celulele si organitele impotriva
moleculelor inalt reactive, cum sunt radicalii liberi, produsi inevitabili ai consumului
de oxigen.
Mecanismele mentionate au fost
deseori mentionate ca factori care alimenteaza imbatranirea. Celulele tumorale
dezvolta frecvent mecanisme pentru a inactiva supresorii tumorali si a depasi
capacitatile limitate de aparare ale celulelor normale.
2.
Reglarea supresiei tumorale si caile metabolice ale senescentei
2.1. p53 si pRB
Datorita rolului critic al p53 si
proteinei retinoblastoma in progresia ciclului celular si frecventa lor
inactivare in cancerele umane, ambele gene sunt reglatori cheie ai
tumorigenezei. In special, rolul p53 in imbatranire si cancer este nedisputat,
desi mecanismele exacte raman inca neelucidate. Modele murine cu nivel crescut
al activitatii p53 au aratat rezultate contrastante datorita diferentelor in
alelele transgenice p53. In timp ce studiile utilizand animale cu alele p5
mutate sau truncate au demonstrat imbatranire accelerata si durata de viata
scurta, soriceii cu multiple copii ale locusului p53 au prezentat o incidenta
scazuta de cancer dar fenomene de imbatranire si durata de viata normale. In
plus, animalele transgenice avand copii suplimentare de p53 si factorul sau
reglator p19ARF demonstreaza un nivel inalt de rezistenta la tumori
si intarziere a imbatranirii. Aceste studii au subliniat importanta reglarii
activitatii p53 si nu doar expresia sa.
2.2. Ink4a/locusul ARF
Proteinele locusului INK4a (MTS1,
CDKN2) regleaza functional si leaga aceste doua cai metabolice de supresie
tumorala si control al ciclului celular. Locusul INK4a, de pe cromosomul uman
9p21, codifica p16 si o alta proteina nelegata p14 (p19 la soarece; de aici
inainte, ARF este utilizat pentru a denumi p14), o peptida alternativa care
actioneaza in amonte de p53. Alterari ale locusului INK4a sunt caracteristici
care ies in evidenta intr-o multitudine de forme de cancer, inclusiv melanom,
cancer de san, linfom si carcinom oral. Ambele proteine joaca un rol in
imortalizalizarea celulelor umane, ca si in senescnta replicativa prematura si
cea indusa de ras in celulele primare. Avansarea in varsta la soricei corespunde
reglarii pozitive a proteinelor corespunzatoare INK4a in anumite tesuturi, care la randul lor ar
putea limita proliferarea celulelor stem si hematopoietice in vivo. pRB
hipofosforilata se leaga de si inactiveaza familia E2F de factori
transcriptionali si inhiba progresia ciclului celular. Activitatea complexelor
cicline- CDK este inhibata de doua clase de inhibitori, p21 ( un efector in
aval de p53) si p16. In timp ce p16 se comporta ca un inhibitor al complexelor
cicline - CDK si previne fosforilarea lui pRB, ARF regleaza ambele cai ale lui
p53 si pRB. Inducerea expresiei ARF stabilizeaza si creste activitatea p53,
ducand la reglarea pozitiva a p21, care la randul ei inhiba CDK si fosforilarea
pRB.
ARF
este un jucator cheie al supresiei tumorale si inducerea senescentei datorate
functiilor sale reglatorii in controalele ciclului celular mediate de p53 si
pRB. Expresia ectopica a ARFcauzeaza oprirea cresterii cu urme ale senescentei
premature. Un model presupune functionarea ARF prin legarea ubicuitin ligazei
MDM2 sau HDM2 la oameni, sechestrarea lui in nucleol, promovarea degradarii lor
activand astfel p53 si pRB. Desi co-localizarea ARF-HDM2 in nucleol a fost
identificata initial ca si factor cheie in regarea activitatilor pRB si p53,
studiile au aratat ca aceasta nu e esentiala pentru functionarea sa si nu se
coreleaza complet cu importul HDM2 spre nucleol. Aceste informatii sugereaza ca
ARF functioneaza independent de HDM2, implicand posibil alte evenimente legate
de homo-oligomerizarea sa. Sau interactia cu diversi parteneri: membrii
familiei E2F, spinophilin, topoisomerase I, MDMX, Pex19p/HK33/HsPXF, ciclina
G1, helicaza WRN, c-myc, HIF-1a, HIV Tat-binding protein 1, and CARF. Relevanta
acestor proteine in senescenta ramane inca de demonstrat. S-a demonstrat in
trecut casechestrarea citoplasmica si inactivarea lui p19 se petrece in
celulele de soarece dar nu si la om, fapt care explica puternica activare a p53
in celulele umane. Aceasta diferentiere e responsabila de un control ferm al senescentei celulare, briera pentru
imortalizare, si o supraveghere mai buna a tumorilor in celulele umane.
ARF
si p16 sunt propuse ca bio-markeri pentru imbatranire. Pe cand efectele lui p16
in cancer si senescenta sunt bine definite, dovezile pentru ARF sunt inca neclare. Tesuturile imbatranite de soarece
si om arata o crestere a p16, dar dovada
pentru prezenta ARF nu e suficienta. In animale restrictionate caloric, un
model bine cunoscut de longevitate, atat p19 cat si p16 erau scazute in
corelatie cu o rata redusa a nefritelor, hiperplaziei celulelor Leydig, si o
scadere a ratei tumorilor. Sharplss a aratat ca animalele deficiente in p16
si/sau p53sunt normale din punct de vedere al dezvoltarii, dar cad prada
cancerului mult mai frecvent. Soarecii cu mutatie dubla au durata de viata
redusa drastic. In contrast, soarecii super Ink4a/ARF, care poarta un locus
suplimentar Ink4a/ARF, in plus fata de genele alele endogene, sunt mai rezistenti
la tumorigeneza indusa chimic, si au o incidenta a tumorilor spontane scazuta,
fara ca acest lucru sa afecteze durata normala de viata sau imbatranirea.
Proteinele
p16 si ARF impart acelasi lous si desi exista dovezi in privinta co-reglarii,
in special in celulele rozatoarele, ele apar reglate disparat in celulele
umane. Expresia p16 e stimulata de factori de stress precum: lumina UV,
activarea oncogenelor, radicalii oxigenului, radiatia ionizanta, agentii
chemoterapeutici si disfunctia telomerelor. In contrast, o idee sustinuta este
ca in celulele umane, ARF nu este indusa direct de distrugeri ADN ci de
activareaoncogenelor. Totusi, oncogenele care induc ARF induc si caile de
raspuns fata de leziuni ADN.
ARF poate media raspunsul la leziuni ADN
prin efecul pe care il are asupra HDM2 si p53 si, in plus, poate regla
reglatorii punctelor de verificare ale ciclului celular care simt lezarea
ADN-ului, protein kinazele ATM ( ataxia telangietacsia mutanta) si ATR ( ATM-
si Rad3-inrudite). Studii anterioare au aratat ca activarea ATM si ATR indusa
de ARF este posibila, ducand la fosforilare a efectorilor lor in ava. In plus,
ARF poate forma complexe cu ATR si BRCA1, legarea ducand la relocalizare in
nucleol si activarea p53. Prin urmare, ARF ar putea fi activat printr-o
interactie fizica directa in absenta altor semnake oncogenice. Este inca neclar
daca ARF activeaza semnalizarea ATM si/sau ATR printro interactie directa cu
aceste kinaze sau prin alte enzime reglatoare, cum ar fi TIP60, care le poate
modifica. Din moment ce gena ARF este dereglata intr-o varietate de boli
maligne si se gaseste in cantitati crescute la imbatranire, cautarea de
reglatori ai acestei proteine este de cel mai mare interes.
CARF
a fost descoperit pentru prima oara ca un nou partener de legare si colaborator
al ARF. Studii recente folosind celule umane au aratat ca CARF aremecanisme de
reglare a lui p53 dependente si independente de ARF.
2.3.
CARF: un jucator cheie in calea metabolica de senescenta a lui p53
CARF ( colaborator al lui ARF) a fost
descoperit initial intr-un experiment de explorare folosind un sistem de
scanare di-hibrid de levuri cu p19 de soarece ca momeala, si s-au identificat
doua proteine ce interactioneaza cu CARF. Pex19p interactioneaza doar cu p19 de
soarece si scade functia supresoare tumorala a p53 in celulele de soarece. CARF
interactioneaza puternic cu ambele proeteine. Gena CARF umana se gaseste pe
cromosomul 4, bratul 4q35 intre markerii D4S415 si D4S408 si pe cromosomul 8,
C3-C4 la soarece. Pare a fi o proteina ubicuitara; transcriptul sau a fost
gasit in toate tesuturile studiate. CARF uman este o proteina bogata in serina
(21%), formata din 580 aminoacizi cu o masa moleculara de 61kDa (Fig.1.).
Proteina prevazuta are un situs N de glicozilare, un situs de fosforilare
pentru protein kinaza C, un situs de fosforilare pentru tirozin kinaza, un
domeniu de legare al ARN dublu catenar si un profil de semnalizare al
localizarii nucleare bipartit. Profilul de semnalizare al localizarii nucleare
bipartit, 537-551 din CARF, specifica acumularea selectiva in nucleu. Nu are
similaritate cu nici o alta proteina din baza de date. Bazandu-ne pe
prezicerile programului, CARF are caracteristicile structurale ale unei
proteine reglatoare.
Studiile initiale au aratat ca in timp
ce ARF se gaseste in principal in nucleol cu o distributie difuza in
nucleoplasma si citoplasma, , CARF este localizata in cucleoplasma si pare sa
fie exclusa din centrul nucleolului. Aceste doua proteine colocalizeaza la
periferie (zona granulara) nucleolului. In plus , CARF da reactie incrucisata
cu p14 si p19, sugerand o importanta a conservarii la oameni si soareci. ARF si
CARF sunt co-reglate si implicate in stabilizare reciproca.
CARF nu se leaga numai de ARF ci si de
p53 in nucleoplasma si o activeaza in mod direct. Supraexpresia CARF in
celulele tumorale ( cu sau fara ARF) duce la reglarea pozitia a p53.
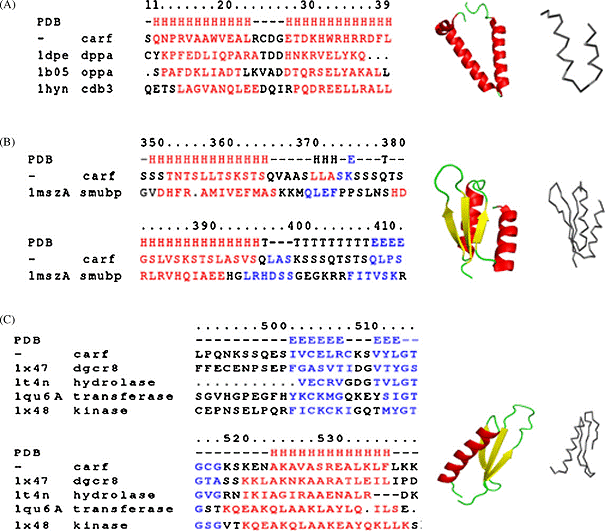
Fig. 1. Model ipotetic al structurii CARF.
S-a mai demonstrat si ca proteina CARF
functioneaza intr-o bucla de reglare negativa implicand p53 si HDM2. p53 se
stie ca sufera degradare de catre HDM2, care regleaza in mod negativ proteinele
( inclusiv pe sine insasi), prin ubicuitinizare si degradare proteosomala. Desi
CARF si 53 sunt ubicuitinizate si sunt tinte degradative pentru HDM2, am
descoperit recent ca pentru a se proteja de la degradare, CARF actioneaza ca
represor transcriptional al HDM2, anuland efectul antagonist pe care il are
asupra p53 si activand calea ARF-p53-HDM2-p21. Nivelul de expresie al lui CARF
depinde de tipul celular, si in special de starea lui p53. Celulele cu p53 tip
wild type exprima CARF mult mai putin decat cele mutante pentru p53. Datele
sugereaza ca CARF functioneaza ca si reglator cheie al p53 ca stabilizator si
activator pe de o parte, si supresor si antagonist pe de alta parte. In
celulele deficiente in ARF, organismele fara expresie CARF nu au suferit
modificari ale expresiei p53, desi celulele cu CARF inhibat au nivel crescut de
HDM2 si scazut de proteine din aval fata de p53: BAX, PUMA si p21. Prin urmare,
CARF nu regleaza pozitiv proteina p53 la nivel transcriptional; in schimb,
poate functiona prin stabilizarea si cresterea activitatii lui p53, iar in
absenta ARF, nivele reduse de expresie CARF pot fi suficiente pentru
stabilitatea p53. [aici am sarit o bucata, nu
mai pot] De retinut, in timp ce supraexprimarea CARF in celulele
tumorale cu funtie p53 wild type duce la o reducere semnificativa a numarului
de colonii, celuelele cu funstie p53 deficienta arata de asemenea reducerea
numarului de colonii, sugerand ca desi functia CARF este activarea p53, ea
poate functiona si in cai metabolice alternative ce duc la oprirea cresterii
celulare.
Perspective
viitoare
Exista multe intrebari la care nu se
cunoaste inca raspunsul legat de rolul CARF ca si de reglarea in vivo si
relevanta caii ARF-p53-HDM2-p21.
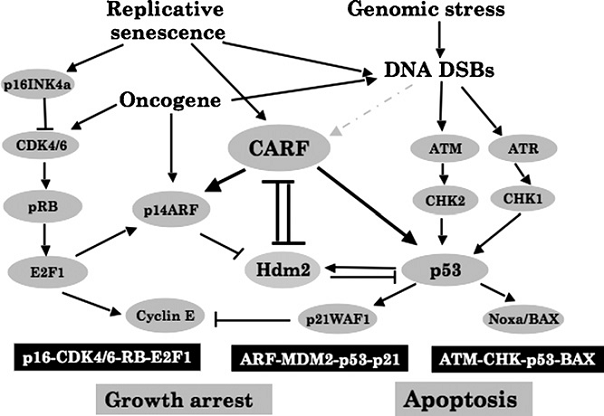
Fig.2. Trei cai principale de proliferare
celulara.
In prezent, nu s-a facut o
caracterizare sistematica si evaluare a exprimarii CARF sau ARF la nivel
tisular la indivizi in varsta si tineri pentru investigarea contributiei
acestei proteine la senescenta si imbatranire. In plus, rolul CARF in celule
stresate si nestresate si impotranta interactiilor ARF dependente si
independenta trebuie inca studiata. Din moment ce ARF regleaza si ATM si ATR, e
posibil sa fie implicat si in raspunsul la lezarea ADN. Inca nu s-a investigat
legarea CARF la ARF-BP1. Mecanismele represiei transcriptionale indusa pentru
HDM2 de CARF si a altor proteine potentiale necesita maimulte investigatii.
Fig. 2 arata un model al interactiilor si al functiilor cunoscute si ipotetice
al CARF.
In ciuda intrebarilor care raman pentru
situatia in vivo, infomatiile pe care le avem pana in prezent garanteaza pe
deplin entuziasmul in privinta rolului potential al acestei proteine in cancer
si imbatranire. Asteptam cu nerabdare urmatoarele analize privitoare la CARF.



