DETERMINAREA
REACTIEI SOLULUI
Activitatea
plantelor si microorganismelor din sol este influentata de
reactia ionica sau pH-ul solutiei solului.
Pornind
de la notiunea de acid si baza , acidul este o
substanta care in solutie apoasa se disociaza si
pune in libertate ionii de hidrogen iar baza este o substanta care in
solutie apoasa se disociaza si pune in libertate ioni de
hidroxil [4].
Apa, prin structura
sa chimica, joaca rolul si de acid si de baza. Astfel,
apa in echilibrul:


 HOH HO- + H+
HOH HO- + H+
 acid baza
acid baza
joaca rolul de acid, in timp ce in
echilibrul:

 HOH + H+ H3O+
HOH + H+ H3O+
baza acid
moleculele de apa joaca rolul de
baza.
Reunind
cele doua echilibre se obtine:

 HOH HO - + H+
HOH HO - + H+
 HOH +
H+ H3O+
HOH +
H+ H3O+
_____ _______ ______ ________

 HOH + HOH H3O+
+ HO-
HOH + HOH H3O+
+ HO-
Constanta
de echilibru a acestei ecuatii se calculeaza cu expresia:
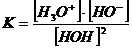
Constanta
de echilibru are o valoare bine definita pentru o anumita
temperatura.
K·[HOH]
2 = [H3O+] · [HO-]
Produsul
[H3O+] · [HO-] se numeste produsul ionic
al apei sau constanta de autoprotoliza si se noteaza cu Kw.
Valoarea numerica a acestei constante, la temperatura de 25 sC este 10-13,996. In calcule obisnuite acesta valoare
se considera 10-14.
Dar,
[H3O+] = [HO-] si atunci:
[H3O+] = [HO-]
= 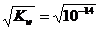 = 10-7 mol / l
= 10-7 mol / l
Produsul [H3O+]
· [HO-] are valoare constanta ceea ce inseamna ca
valoarea concentratiei unuia dintre ioni este invers
proportionala cu cu a celuilalt. Deci, prin marirea
concentratiei unuia dintre ioni, concentratia celuilalt scade
proportional, cu posibilitatea de a atinge valori foarte mici,
fara sa devina egala cu zero.
Utilizarea concentratiilor de H3O+
si HO- in exprimarea caracterului acid sau bazic al unei
solutii este o modalitate relativ greoaie. De aceea, Sorensen a introdus
notiunea de pH sau exponent de hidrogen care este logaritm cu semn
schimbat al concentratiei ionilor de hidrogen.
pH = - lg [H3O+]
Pentru exprimarea concentratiei
ionilor de hidroxil, in locul [HO-] se foloseste notiunea
de exponent de hidroxil (pOH) care
are ca expresie:
pOH = - lg [HO-]
Deoarece in solutiile apoase :
[H3O+]
· [HO-] = Kw
rezulta ca:
pH + pOH = pKw
= - lg Kw
Dar, Kw ( la 25 sC) = 10-14,
pH + pOH = 14
Clasificarea solutiior apoase
in functie de pH este urmatoarea:
pH < 7 , pOH > 7 ,
solutia este acida;
pH > 7, pOH < 7 , solutia
este bazica;
pH = pOH = 7, solutia este
neutra
Solutia solului poate fi
acida, bazica sau neutra. In functie de pH exista
soluri extrem de acide, cu pH sub 3,5; foarte puternic acide, pH 3,5 - 4,3;
soluri puternic acide, pH 4,3 - 5,0; moderat acide, pH 5,0 - 5,8; slab acide,
pH 5,8 - 6,8; neutre, pH 6,8 - 7,2; slab alcaline, pH 7,2 -8,4; alcaline, pH
8,4 - 9; puternic alcaline cu pH-ul solutiei solului mai mare de 9,0.
pH-ul solului actioneaza
in biotop ca factor ecologic limitant; schimbarea pH - ului elimina unele
populatii de plante si accepta altele cu adaptari
corespunzatoare.
1.
Metode electrometrice de determinare a pH -ului
Aparatura si materiale
- pH- metru cu scala 0 - 14 unitati
pH si cu precizie de citire de 0,05 unitati pH;
- electrod de sticla adecvat tipului de
pH - metru;
- electrod de referinta, de calomel
saturat sau de argint - clorura
de argint.
Se prefera
electrodul de sticla combinat cu electrod de referinta, fiind
mai usor de manipulat si tot atat de precis ca si sistemul
constituit din electrozi separati.
- agitator;
- balanta de precizie de ± 0,002 g;
- balanta cu precizie de ± 0,01 g;
- pahare Berzelius de 50 ml sau 100 - 150 ml;
- baloane cotate de 100, 500, 1000 ml;
- hartie de filtru calitativa;
- biureta de 50 ml.
1.1.
Masurarea pH - lui in suspensii de sol
Se spala
electrozii si celula de masurat de 3 - 4 ori cu apa
distilata si se tamponeaza usor electrozii cu hartie de
filtru.
Suspensiile de sol ( in
prealabil agitate si lasate timpul necesar pentru echilibrare) se
agita timp de de 3-5 minute si apoi se introduce cuplul de electrozi.
Electrozii se aseaza in suport astfel incat bula electrodului de
sticla sa fie introdusa pana la jumatatea
inferioara a stratului de suspensie, in timp ce electrodul de
referinta sa ramana in jumatatea superioara
a ei. Se citeste valoarea pH - lui indicata pe scara pH - metrului,
in decurs de 1 minut dupa imersarea electrozilor.
Se repeta
masurarea pana ce, la interval de un minut , valorile pH - lui se
reproduc cu o cu o abatere de ± 0,05 unitati pH.
Electrozii se
spala cu apa distilata, dupa fiecare proba sau
solutie de masurat, si se tamponeaza usor cu hartie de
filtru.
1.2.
Masurarea pH - lui in pasta din solutie
Se spala electrozii cu apa
distilata si se usuca prin tamponare usoara cu hartie
de filtru.
Se introduc electrozii
de sticla si de referinta, in pasta de sol, rotind incet
electrodul de sticla pentru indepartarea filmului de apa format
in jurul lui. Se citeste valoarea pH - lui la aparat. Se scot electrozii
din pasta, mentinandu-se insa deasupra paharului si se
introduc din nou, cu aceleasi precautii; se efectueaza din nou
citirea pH - lui la aparat. Se repeta citirile la aparat in aceleasi
conditii pana se obtine o valoare pH care nu difera de
citirea anterioara cu mai mult de ± 0,05 unitati pH [17].

Fig.11 pH -
metru
1.3.
Determinarea
pH- ului in susupensii de sol in apa sau solutii apoase saline
(Lucrarea nr.6)
Aceasta
este o metoda mai expeditiva de masurare a ph -ului in suspensii
de sol in apa sau solutii apoase saline (clorura de potasiu,
clorura de calciu) pregatite in raport de 1: 5 (volum / volum), cu
ajutorul unui cuplu de electrozi (electrod de sticla si electrod de
referinta) [10].
1.3.1.
Principiul metodei
Masurarea
pH - ului se executa cu ajutorul unui electrod de sticla intr-o
suspensie diluata 1 : 5 (V / V) de sol in apa (pH - H2O)
sau in clorura de potasiu de concentratie 1 mol / l (pH - KCl) sau in
solutie de clorura d calciu de 0,01 mol / l (pH - CaCl2)
Se prepara o suspensie de sol intr-un volum de
cinci ori mai mare decat volumul sau, la alegere :
-
de apa;
- de solutie apoasa de clorura de
calciu (CaCl2) 0,01
mol / l;
- de solutie apoasa de clorura de
potasiu (KCl) 1mol / l.
1.3.2. Reactivi
1.3.2.1. Solutie de clorura de potasiu
de concentratie
1 mol / l
Se
dizolva 74,5 clorura de potasiu in apa si se completeaza
pana la 1000 ml la temperatura de 20 sC.
1.3.2.2. Solutie de clorura de calciu de
concentratie 0,01 mol / l
Se
dizolva 1,47 g clorura de calciu dihidratata (CaCl2·2H2O)
in apa si se dilueaza la 1000 ml la temperatura de 20 sC.
1.3.2.3. Solutii pentru etalonarea pH -
metrului.
a)
Solutie tampon, pH = 4 la 20 sC.
Se
dizolva 10,21g de ftalat acid de potasiu (K8H5O4
) in apa si se dilueaza la 1000 ml la 20 sC. Solutia este
stabila o luna daca este conservata in flacoane de
polietilena.
b) Solutie tampon, pH = 7,00 la 20 sC
Se
dizolva 3,800 g dihidrogenfosfat de potasiu (KH2PO4)
si 3,415 g hidrogenfosfat disodic (Na2HPO4) in
apa si se dilueaza la 1000 ml la 20 sC.
Inainte
de utilizare, dihidrogenfosfatul de potasiu trebuie uscat timp de 2 ore intre
110 si 120 sC. Solutia este stabila o luna daca este
conservata in flacoane de polietilena.
c) Solutie tampon, pH = 9,22 la 20 sC.
Se
dizolva 3,80 g de tetraborat de sodiu de sodiu decahidrat (Na2B4O7
·10 H2O) in apa si se dilueaza la 1000 ml la 20 sC. Solutia
este stabila o luna daca este conservata in flacoane de
polietilena. Tetraboratul de sodiu poate pierde apa de cristalizare
daca este pastrat timp indelungat.
1.3.3. Aparatura
Aparatura
folosita este urmatoarea:
-
agitator sau omogenizator;
-
pH - metru, echipat cu sistem de control si de ajustare a temperaturii;
- electrod de sticla si electrod
de referinta sau electrod combinat;
- termometru, cu exactitate de 1sC;
- flacon pentru recoltare de
esantioane, de sticla borosicatica sau polietilena,
prevazut cu buson sau capac de inchidere ermetic, cu o capacitate de
cel putin 50 ml;
- lingura de tarat, cu o capacitate
cunoscuta, de cel putin 5 ml.
1.3.4. Esantionul de laborator
Se utilizeaza fractiunea de
particule din esantioanele de sol uscate la aer sau la o temperatura
inferioara sau egala cu 40 sC, care se trec prin sita cu diametrul
ochiurilor de 2 mm.
Uscarea poate avea o incidenta nepermisa asupra
pH - ului; de exemplu, in cazul esantioanelor de sol ce contin
sulfuri, uscarea poate reduce pH-ul de o maniera considerabila.
1.4. Mod de lucru
1.4.1. Pregatirea suspensiei
Se
preleveaza din esantionul de laborator, cu ajutorul unei linguri, o
proba de analiza reprezentativa de cel putin 5 ml.
Se
transfera acest volum de analizat intr-un flacon de recoltare
esantioane si se adauga de cinci ori volumul sau de
apa su solutie de clorura de potasiu sau solutie de
clorura de calciu.
Se
agita sau se omogenizeaza energic suspensia timp de 5 min; cu
ajutorul unui agitator sau a unui omogenizator, apoi se lasa in repaus cel
putin 2 ore dar nu mai mult de 24 de ore. In majoritatea solurilor,
echilibrul este atins dupa doua ore.In acest caz
masuratoarea poate fi efectuata dupa doua ore. Dar la
unele soluri, cum ar fi solurile contaminate, solurile recent amendate sau solurile cu carbonati,
pH-ul de echilibru poate sa nu fie atins in intervalul de mai sus. In
consecinta se obtin valori prea scazute sau prea ridicate
comparativ cu situatia in care echilibrul este in mod natural atins,
datorita modificarilor incetinite in sistemul tampon. Pentru a
verifica daca este sau nu un
asemenea caz, masurarile de pH trebuie efectuate la diferite momente
(cel putin doua) in interval de la 2 ore pana la 24 ore de la
agitare. In acest caz este indicat sa se noteze cel putin doua
valori ale pH- lui pentru a stabili pH-ul aproximativ al solului.
1.4.2.
Etalonarea pH-metrului
Pentru
etalonarea pH-metrului se utilizeaza solutiile tampon. Cu electrozi
care sunt in stare buna, echilibrul este atins in mod normal in circa 30
secunde.
1.4.3.
Masurarea pH-ului
Reglarea
pH- metrului se face dupa instructiunile din manualul de utilizare.
Se masoara temperatura suspensiei avand grija ca temperatura
solutiilor tampon si cea a suspensiilor de sol sa nu difere cu
mai mult de 1sC. Se agita energic suspensia chiar inainte de
masurarea pH-ului. Se masoara pH-ul suspensiei. Se
inregistreaza pH-ul dupa ce se atinge echilibrul. Se noteaza
valorile cu doua zecimale.
Citirea
este considerata stabila daca intr-un interval de 5 secunde nu
variaza cu mai mult de 0,02 unitati de pH. Viteza
obisnuita de atingere a echilibrului este de 1 minut dar poate
depinde de:
-
de valoarea pH-ului (la valori ale pH-ului mai ridicate, echilibrul se atinge
mai greu);
-
de calitatea sticlei din electrodul de sticla (diferente de
fabricatie intre electrozi) si de vechimea lui;
-
de mediul in care se efectueaza masurarea (echilibrul este atins mai
rapid in mediu de KCl sau de CaCl2 decat in apa);
-
de modul in care este executata agitarea mecanica inainte de
masurare, care poate ajuta sa se obtina citiri stabile
intr-un timp redus.
2. Metode colorimetrice de determinare a pH -ului
2.1. Procedeul cu pehametrul
Hellige
Pehametrul Hellige este
alcatuit dintr-o placuta de portelan
prevazuta cu o scobitura de forma unei calote sferice, care se
continua cu un canal in forma de T. Pe ambele parti ale
canalului se afla o scara de culori corespunzatoare cu valorile
pH - ului cuprinse intre 1 si 9. Din trusa mai face parte si o
sticla bruna, picuratoare, in care se pastreaza
amestecul de indicatori ( rosu de metil si albastru de timol in mediu
slab alcalin in raportul 1 / 2) [17].
Fig. Fig.
12
Pehametru Hellige
Pentru masurarea
pH-ului, se pune in scobitura placii de portelan putin
pamant maruntit, peste care se toarna prin picurare
solutia indicator, apoi cu o bagheta se agita solul cu
solutia, dupa care se apleaca placa de portelan pentru ca
solutia sa treaca in canal. Comparand culoarea solutiei cu
culorile - etalon se poate determina valoarea pH - ului, cu precizia de 0,5
unitati.
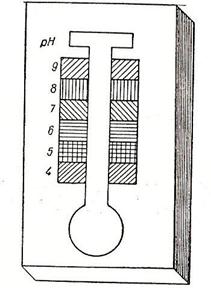
2.2. Procedeul foliilor
indicatoare de pH (Lucrarea nr.7)
Aceasta
metoda ofera o precizie mai mare decat cea precedenta, ajungand
pana la 0,1 unitati pH.
Foliile indicatoare
sunt fasii de celuloza translucida impregnate cu amestec de
indicatori. Foliile se introduc in suspensia sol - apa si acestea
isi modifica culoarea corespunzator cu concentratia ionilor
de hidrogen din solutie. Comparand
culoarea foliilor introduse in solutia sol - apa cu scarile -
etalon (din hartie colorata, care sunt atasate la pachetelele cu
folii) se determina valoarea pH - lui.
Fig.
13
Folii
indicatoare
de pH


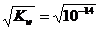 = 10-7 mol / l
= 10-7 mol / l