Tensiunea superficiala. Adsorbtia la interfata
lichid - gaz. Izoterma Gibbs. Ecuatia lui Siscovski
Tensiunea superficiala
a) Definitie: Forta exercitata pe unitatea de lungime,
tangential la suprafata, care tinde sa micsoreze suprafata libera a lichidului.
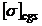 = dyn/cm ;
= dyn/cm ; 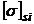 = N/m
= N/m
b) Factorii care influenteaza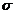 :
:
- natura lichidului 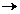
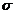 variaza in limite largi in functie de natura lichidului
variaza in limite largi in functie de natura lichidului
- temperatura 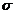 scade cind temperatura creste
scade cind temperatura creste
- relatia lui EOTVOS
stabilita pe baza teoremei starilor corespondente:
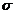
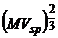 = k
(Tc-6-T) (1)
= k
(Tc-6-T) (1)
- ne arata ca la o temperatura mai
mica cu 60 decit Tc suprafata de separare dintre cele doua faze se
acumuleaza si 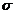 = 0
= 0
 T
T
Tc-6 Tc
In ecuatia (1) avem :
M = masa moleculara
Vsp = volumul
specific
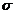 = tensiunea superficiala
= tensiunea superficiala
k = constanta care depinde de natura
lichidului
k = 2,12 pt. lichide neasociate
k < 2 pt. lichide asociate si creste cu T
k > 6 pt. tristearina datorita asimetriei
mari a moleculelor.
c) Fenamene legate de 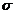
presiunea capilara
- fenomene de
umectare
- fenomene capilare
-presiunea de vapori
a suprafetelor curbe.
d) Parachorul
Este un parametru
care leaga tensiunea superficiala de structura moleculara. Parachorul este
caracteristic fiecarei substante si nu depinde de temperatura :
P = 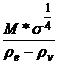 (2) unde:
(2) unde:
M = masa molara
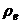 ,
,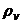 = densitatea lichidului si vaporilor in echilibru la temperatura
la care se refera
= densitatea lichidului si vaporilor in echilibru la temperatura
la care se refera 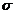
Dar 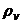 <<
<<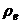 si P =
si P = 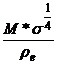 = V*
= V*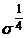 (3)
(3)
unde V = volumul
molar al lichidului
Parachorul unei
substante se poate obtine aditiv din valorile caracteristice atomilor si
tipurilor de legatura din molecula (insumarea contributiilor atomice si
incrementelor de structura).
Manualul inginerului chimist pg. 1842
2) Adsorbtia la interfata
lichid - gaz
a) Definitie: Adsorbtia este procesul de modificare a
concentratiei unei substante la suprafata de separare dintre doua faze.
Substanta care
adsoarbe = adsorbant (faza lichida sau solida)
Clasificarea adsorbtiei
- dupa felul
suprafetei de adsorbtie :
10 -
Suprafata de separare in faza lichida:
 adsorbtie G - solutie
adsorbtie G - solutie
adsorbtie L - solutie
adsorbtie L1 - L2
(lichide complet nemiscibile, emulsii)
20 -
Suprafata de separare in faza solida :
 adsorbtie G - solid
adsorbtie G - solid
adsorbtie L - solid
Daca in urma
interactiunii, particulele mobile ale unei faze patrund in interiorul
celeilalte faze se vorbeste despre ABSORTIE.
Nu se poate face o
distinctie neta intre adsorbtie si absortie si se numesc de multe ori fenomene
de sorbtie.
2) Adsorbtia la interfata
lichid - gaz Izoterma Gibbs
- se aplica pentru solutii
diluate.
a = - 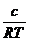
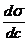 (4)
(4)
a = coeficient de
adsorbtie = modificarea numarului de moli din unitatea de suprafata a stratului
superficial fata de interiorul lichidului 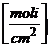
c = concentratia 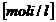
R = ct. gazelor =
8,31*107 erg/mol*grd
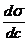 = variatia tensiunii superficiale cu concentratia
= variatia tensiunii superficiale cu concentratia 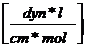
In functie de semnul
derivatei 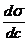 avem :
avem :
a) substante tensioactive :
- produc o scadere a
tensiunii superficiale cu cresterea concentratiei.
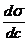 < 0 a > 0 (acizi, alcooli,
apa)
< 0 a > 0 (acizi, alcooli,
apa)
b) substante tensioinactive :
- produc o crestere a
tensiunii superficiale cu cresterea concentratiei.
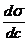 > 0 a < 0 .
> 0 a < 0 .
Pentru substante
tensioactive
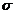

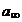 -------- ----- ------ -----
-------- ----- ------ -----
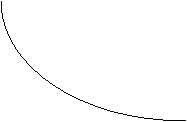 a = f(c)
a = f(c)
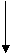
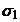
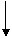
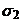

c1 c2
La concentratii mari
adsorbtia atinge o valoare limita, suprafata fiind saturata cu adsorbant.
4) Ecuatia Siskovski. Izoterma
de adsorbtie
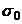 -
-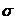 = A*ln(B*c +1) (5) unde:
= A*ln(B*c +1) (5) unde:
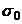 = tensiunea superficiala a solventului pur
= tensiunea superficiala a solventului pur
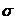 = tensiunea superficiala a solutiei de concentratie c
= tensiunea superficiala a solutiei de concentratie c
A = constanta care
se modifica putin functie de natura substantei tensioactive fiind constanta pentru o serie omoloaga
B =
constanta care se modifica mult si regulat in seria omoloaga 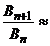 3,2
3,2
Daca derivam ec.
Siskovski in raport cu c obtinem :
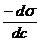 =
= 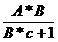
Inlocuind (6) in ec.
Gibbs rezulta :
a
= - 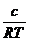
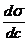 =
= 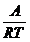
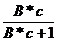 (7)
(7)
- la concentratii
foarte mici G*c << 1 se neglijeaza fata de 1 si
a = 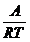 *B*c (8) in
care adsorbtia e functie liniara de concentratie.
*B*c (8) in
care adsorbtia e functie liniara de concentratie.
- la concentratii
mari B*c >> 1 si se neglijeaza 1 fata de B*c. si avem:
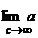 =
= 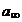 =
= 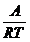 = ct. (9)
in care adsorbtia este constanta.
= ct. (9)
in care adsorbtia este constanta.
Inlocuind
(9) in (7) rezulta :
a = 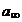
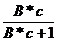
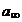 = are aceeasi valoare
pentru toti termenii unei serii omoloage.Ecuatia (10) a fost propusa de
LANGMUIR si scrisa sub forma :
= are aceeasi valoare
pentru toti termenii unei serii omoloage.Ecuatia (10) a fost propusa de
LANGMUIR si scrisa sub forma :
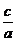 =
= 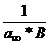 +
+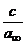 (11)
(11)
Permite liniarizarea
si determinarea din grafic a constantelor B si 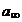 .
.
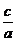
 tg
tg 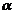 =
= 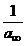

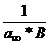
 c
c
Se poate calcula
suprafata ocupata de o molecula adsorbita in stratul superficial.
(12) N0 = 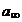 *NA = nr. de molecule adsorbite pe 1 cm3
*NA = nr. de molecule adsorbite pe 1 cm3
(13) S0 = 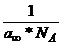 = suprafata ocupata de
o molecula adsorbita in stratul superficial
= suprafata ocupata de
o molecula adsorbita in stratul superficial
S0 = 21*10-16 cm2
pt. compusi cu grupe polare
Se poate calcula
grosimea stratului adsorbit :
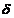 =
= 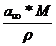 , unde :
, unde :
M = masa moleculara a
substantei dizolvate
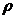 = densitatea substantei dizolvate.
= densitatea substantei dizolvate.







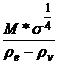 (2) unde:
(2) unde: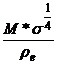 = V*
= V*