Procese simple ale gazului ideal

Ecuatia
termica de stare a gazului ideal,ce descrie relatia dintre paramtrii de stare ai unui gaz ideal, in
oricare stare de echilibru a acestuia, are expresia
pV = RT
|
p : presiunea gazului (N/m2)
: cantitatea de substanta din sistem (kmol)
R : constanta
universala a gazelor (8310 J kmol-1 k-1)
|
V : volumul gazului (m3)
T : temperatura absoluta
(K)
|
Transformarea
generala reprezinta tranformarea in care cantitatea de gaz se mentine constanta,
( = const), parametrii de
stare modificandu-si valoarea dupa legea:
pV/T = const.
Transformare
politropa este acea transformare pentru
care caldura molara a unui gaz de masa data se mentine
constanta ( = const , C
= const ), legea procesului fiind:
pV n = const.
n : exponent politropic ( constanta caracteristica fiecarui proces
politrop)
C : caldura molara (coeficient caloric avand valoarea egala
cu cadura schimbata de 1kmol de substanta pentru a varia
temperatura sistemului cu un grad - [C]SI = J/mol Kde sistem )
|
Tipul procesului
|
Definitie
|
Legea procesului
|
Izoterm
( politropa cu n = 1)
|
const
T =
const
|
pV = constant
|
Izobar
( politropa cu n = 0)
|
= const
p = const
|
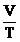 = const , V = V0 (1+ t) = const , V = V0 (1+ t)
V0 : volumul gazului la temperatura t0
= 00C
: coeficient de dilatare izobara (1/273,15 grad-1)
t : temperatura masurata in grade Celsius
|
Izocor
( politropa cu n -> ∞)
|
const
V = const
|
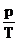 = const , p = p0 (1+t) = const , p = p0 (1+t)
p0 : presiunea gazului la pemperatura t0
= 00C
: coeficientul termic al presiunii
(1/273,15 grad-1)
|
adiabatic
( politropa cu n = )
|
proces in
care sistemul nu schimba caldura cu exteriorul
Q
|
pV = const, TV(-1) =
const, p(1-)T = const
: exponent adiabatic
( = Cp/Cv, Cp,
Cv : coeficienti
calorici ( caldura molara izobara/ izocora
Cp = 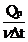 , Cv = , Cv = 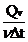
Qp, QV :cadura schimbata de cantitatea de gaz ,izobar/ izocor, pentru a produce o
variatie a temperaturii cu T.
|
Principiile termodinamicii
Principiul zero al
termodinamicii
Pentru orice sistem termodinamic se poate defini un
parametru de stare intensiv, numit temperatura empirica, a carei
valoare este aceeasi in toate starile de echilibru termodinamic
aflate in relatie de echilibru termic.
Parametru de stare : marime fizica ce
descrie starea sistemului termodinamic.
Parametru de stare intensiv : parametru ce poate avea valori distincte in puncte diferite din sistem.
Echilibru termodinamic: parametrii de stare ai
sistemului se mentin constanti in timp atunci cand
sistemul este izolat (sistem ce nu face nici schimb de substanta si nici de energie cu mediul
mediul exterior
Relatie de echilitru termic : daca in urma contactului termic a doua sisteme, contact realizat astfel
incat sa nu se produca schimb de substnta si de lucru
mecanic, acestea nu isi schimba starea initiala, atunci
sistemele sunt intr-o relatie de echilibru termic.
Principiul I al termodinamicii
In orice transformare variatia energiei interne a
unui sistem termodinamic(U), depinde numai
de starea initiala si cea finala intre care evolueaza
sistemul, nedepinzind de starile intermediare.
U (energia interna a
sistemului ) este o functie de stare a sistemului.
Valoarea energiei interna a sistemului termodinamic este
data de suma dintre energia cinetica interna datorata
miscarii moleculelor si energia
potentiala interna (datorata interactiunii dintre molecule).
Ecuatia principiului I al
termodinamicii :
U = Qprimit
-Lefectuat
U :
variatia energiei interne a
sistemului termodinamic
Qprimit : caldura primita de sistem ( prin conventie Qprimit >0)
Lefectuat : lucrul mecanic efectuat de sistem asupra unui sistem
exterior ( prin conventie Lefectuat >0)
Q, L :
forme ale schimbului de energie, fiind marimi
fizice de proces
[U]SI=J, [Q}SI = J, [L]SI = J
Primul principiu al
termodinamicii contine legea conservarii energiei sistemelor izolate.
Pentru un sistem izolat, Q = 0, L = 0, rezultind din ecuatia principiului I : U = 0, Ui
= Uf >> U = const
Nu este posibila construirea unui perpetuum
mobile de speta I .
Perpetuum mobile de speta I : masina care ar produce lucru mecanic
fara sa consume energie din exterior
Principiul al II lea al
termodinamicii
1. Randamentul ciclului Carnot reversibil depinde
numai de temperaturile termostatelor ( surselor cu care sistemul schimba
caldura) fiind independent de natura substantei de lucru.
2. Randamentul oricarui proces ciclic este mai
mic decat randamentul ciclului Carnot reversibil care functioneaza
intre aceleasi temperaturi extreme . (Formularea
Carnot)
Proces ciclic : procesul in care starea initiala
coincide cu cea finala.
Ciclul Carnot
: proces ciclic format din doua
izoterme (T1 fiind temperatura sursei calde cu care sistemul
schimba caldura, iar T2, temperatura sursei reci)
si doua adiabate.
Randamentul oric[rui motor
termic se defineste astfel :
= 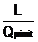 =
= 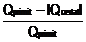 = 1-
= 1- 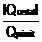 , randamentul fiind
o marime adimensionala,
subunitara.
, randamentul fiind
o marime adimensionala,
subunitara.
Randamentul ciclului Carnot :
C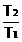
Un sistem termodinamic nu poate efectua lucru
mecanic asupra mediului inconjurator printr-o transformare ciclica
monotema Q ≤ 0, L ≤ 0). Daca transformarea ciclica
monoterma este si ireversibila, mediul exterior efectueaza
lucru mecanic asupra sistemului (Q< 0, L < 0) (Formularea
Thomson)
Transformare monoterma : transformarea in care sistemul schimba caldura cu un
singur termostat.
Transformare reversibila:
transformarea care se poate desfasura identic in ambele sensuri,
sistemul evoluand prin aceleasi stari intermediare (de
echilibru).
Transformarea care nu
indeplineste aceste conditii de reversibilitate se numeste
ireversibila.
Nu este posibila construirea unui perpetuum mobile de
speta a II a .
Nu este posibila nici o transformare care sa
aiba ca rezultat trecerea de la sine a
caldurii de la un corp cu temperatura data la un corp cu
temperatura mai mare. Formularea
Clausius
Exista o functie de stare ( care nu este
unica ) , numita entropie si a carei valoare ramane
constanta in procesele izentrope (procese adiabatice reversibile)
Pentru un proces reversibil se defineste
relatia :
S = 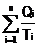
Qi :caldurile schimbate cu surse
termostatate
Ti
:
temperaturile termostatelor
S variatia entropiei ([S]SI
= J/K
In procese adiabatice
reversibile entropia sistemului se mentine constanta:S
= 0.
In procese adiabatice ireversibile entropia sistemului
creste:S ≥ 0.
In procese ciclice ireversibile, suma
rapoartelor dintre caldurile schimbate de sistemul termodinamic cu surse
termostatate si temperaturile acelor termostate este negativa
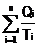 < 0
< 0
In procese ciclice reversibile, suma
rapoartelor dintre caldurile schimbate de sistemul termodinamic cu surse
termostatate si temperaturile acelor termostate este negativa
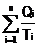 = 0
= 0
Principiul al III lea al termodinamicii
Temperatura de 0K este principial inaccesibila (
M.Planck).
Temperatura de 0 K reprezinta acea stare in care sistemul nu mai poate ceda
caldura, intr-o astfel de
stare energia sa fiind minima.
Entropia oricarui sistem termodinamic
tinde catre o valoare constanta finita atunci cand temperatura
absoluta tinde catre zero.

