TOPIREA
CRISTALELOR
Topirea cristalelor este un fenomen complex.
De-a lungul anilor s-au elaborat mai multe teorii care au incercat sa
explice topirea. Fiecare au avut deficiente ne reusind sa
explice satisfacator unele fenomene care insotesc topirea cum ar
fi: inceputul topirii la o temperatura fixa, absorbtia de caldura
latenta, dilatarea volumica la topire, etc.
a.
Teoria
topirii bazata pe teoria atomilor dislocati.
Conform acestei teorii, topirea se
explica prin cresterea numarului de atomi dislocati si
de vacante cu cresterea temperaturii.
Intr-un cristal exista totdeauna atomi a
caror energie depaseste energia medie. Atomii care
poseda energie de activare pot invinge fortele care ii retin in
pozitia de echilibru, parasind aceasta pozitie. Locul
parasit de atomul activat ramane liber, devenind vacant. Atomii
activati pot ocupa pozitii noi in retea, in noduri libere sau
intre noduri. La ocuparea unei noi pozitii de echilibru sau
pseudoechilibru acestia pierd energia in exces, ramanand pe aceste
pozitii in jurul carora executa mici oscilatii pana la
acumularea unor noi energii de activare care sa le permita sa
migreze pe alte pozitii. Atomii dislocati si vacantele
difuzeaza astfel in masa aliajului ajungand la suprafata acestuia
si de aici in mediul invecinat.
Numarul de dislocatii si de
vacante creste cu cresterea temperaturii, deoarece creste
energia medie a atomilor. Prin aparitia unui numar mare de atomi
dislocati si vacante, ordinea cristalina se
deranjeaza, iar la un moment dat intreg cristalul se dezintegreaza in
atomi dislocati. Acest moment corespunde topirii. Conform acestei teorii
numarul de vacante la temperatura de topire este de 1%, acesta fiind
suficient pentru a asigura o mobilitate mare a atomilor in intregul volum.
Aceasta teorie explica sublimarea,
transformarile de faza in stare solida in metale si aliaje,
dar nu poate explica totusi toate fenomenele care insotesc topirea
cum ar fi: absorbtia caldurii latente, constanta temperaturii de
topire, dilatarea la topire, coexistenta fazei solide si lichide.
b.
Teoria topirii bazata pe energia libera de
suprafata.
Considerand un atom de pe suprafata unui
cristal care are in vecinatate un nod liber acesta poate atrage un alt
atom de acelasi fel din mediul inconjurator, apropiindu-l la
distanta ls, corespunzatoare pozitiei de echilibru. In acest mod el
efectueaza un lucru mecanic datorita fortelor de
legatura. Deci un atom care nu are ocupate pozitiile de
echilibru invecinate poseda o energie potentiala datorata
campului de forte de legatura, energie care poate fi
eliberata, adica transformata in lucru mecanic. Aceasta
energie care poate fi eliberata prin ocuparea pozitiilor vacante din
vecinatatea unui atom se numeste energie libera.
Atomii aflati in interiorul unui cristal
au ocupate toate pozitiile (nodurile) invecinate, deci nu poate atrage
alti atomi. Atomii din interiorul retelei cristaline nu poseda
energie libera. In schimb atomii de la suprafata cristalului pot fixa
alti atomi in vecinatate avand legaturi neocupate. Energia
libera corespunzatoare tuturor atomilor de pe suprafata unui
cristal reprezinta energia libera de suprafata a
cristalului.(ES=nES1, unde n=numarul de atomi de la
suprafata unui cristal, ES1=energia libera a unui atom de
pe suprafata cristalului in stare solida). Rationamentul poate
fi aplicat si starii lichide. Un atom de pe suprafata unui
lichid poate atrage din mediul invecinat un alt atom, fixandu-l pe
suprafata lichidului la distanta lL. In acest caz se elibereaza o energie EL1.
Deoarece lL >lS rezulta ca EL1<ES1.
Deci energia libera de suprafata in stare lichida este mai
mica decat energia libera de suprafata in stare
solida.
Cand un atom se desprinde de pe
suprafata unui cristal solid, parasind cristalul el trebuie
sa consume o energie echivalenta Es1 pentru a invinge
campul de forte care-l retine in reteaua cristalina. Analog
pentru a parasi suprafata unui lichid , un atom va trebui
sa consume o energie EL1.
La trecerea unui atom de pe suprafata
unui cristal solid, in faza lichida, acesta va consuma mai multa
energie pentru iesirea din faza solida, decat energia pe care o
elibereaza la intrarea in campul de forte al fazei lichide. De aceea
la trecerea din faza solida in faza lichida este necesar sa se
consume energie pentru acoperirea diferentei de energie libera a
celor doua faze. Atomii trebuie sa primeasca aceasta
energie din afara, ceea ce explica necesitatea absorbtiei
caldurii latente de topire. Astfel se explica de ce absorbtia de
caldura in timpul topirii nu determina cresterea
temperaturii.
In baza acestor consideratii teoria
topirii pe baza energiei libere de suprafata se enunta
astfel: Topirea este un fenomen atomic care se desfasoara la
interfata solid-lichid. Atomii trec din faza solida in faza
lichida individual, unul cate unul, pe masura ce energia lor de
activare este suficienta pentru a compensa diferenta de energie libera
de suprafata a celor doua faze la interfata solid-lichid.
Conform acestei teorii, paralel cu trecerea
atomilor de la suprafata cristalului in faza lichida, are loc si
o trecere inversa, din faza lichida in solid, deoarece in
conformitate cu legea repartitiei energiilor la orice temperatura
exista atomi cu energii mari care depasesc pragul de activare
si care pot invinge fortele de atractie care ii retin in
structura lichidului.
Cand numarul de atomi care trec in cele
doua sensuri este egal, faza solida se afla in echilibru cu faza
lichida. Cand numarul atomilor care trec dinspre lichid spre solid
este mai mare are loc solidificarea.
c.
Teoria topirii bazata pe echilibrul fortelor interatomice.
Aceasta teorie reprezinta o
explicare mai plauzibila a fenomenului de topire si a fenomenelor
care insotesc topirea (de exemplu temperatura de topire constanta).
Aceasta teorie ia in considerare echilibrul fortelor de atractie
si de respingere si deplasarea pozitiei de echilibru a atomilor
cu temperatura.
Legile de variatie a fortelor de
atractie si de respingere cu distanta si cu temperatura nu
sunt pe deplin clarificate. Efectuand ipoteze rezonabile asupra formei acestor
legi se pot explica rezonabil starile de agregare ale materiei si
trecerea de la o stare la alta.
Fortele de respingere. Expresia lor se deduce pornind de la
ipoteza ca presiunea unui gaz pe peretii vasului in care este inchis
se datoreaza fortelor de respingere dintre atomi si extinzand
valabilitatea relatiei asupra starii solide si lichide. Se
considera o incinta cubica de latura l, in care se
afla un mol de gaz cu distanta dintre atomi medie l . Numarul de atomi pe o
latura a incintei este n (asa cum este reprezentat in figura 1.3).
Daca se noteaza cu Fr-forta de respingere dintre doi
atomi, atunci forta totala exercitata asupra unei suprafete
a incintei este F=n2Fr, (n2 este numarul
de atomi de pe o suprafata a cubului). Aria unei suprafete a
cubului este A=(nl) Presiunea exercitata de gaz pe
o suprafata a incintei este:
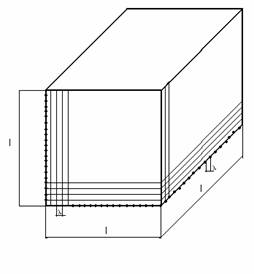
Figura 1.3 Dispunerea atomilor intr-un volum
p=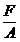 =
=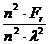 =
=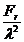 (1.6)
(1.6)
Pe de alta parte presiunea gazului este data de ecuatia
de stare a lui Clapeyron-Mendeleev:
p=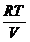 =
=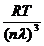 =
=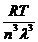 =
=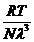 =k
=k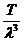 (1.7)
(1.7)
S-a notat N=n3=numarul
total de atomi din incinta egal cu numarul lui Avogadro, iar k = R/N
este constanta lui Boltzman.
Egaland cele doua relatii ale
presiunii gazului se obtine:
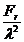 =k
=k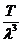 , de
unde Fr=
, de
unde Fr=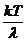 (1.8)
(1.8)
Deci forta de respingere dintre atomi
este proportionala cu T si invers proportionala cu l
Fortele de atractie. Despre aceste forte se poate
afirma ca isi au originea in nucleu, fiind de natura
gravitationala si ca intensitatea lor scade de asemenea cu
distanta, dar nu depinde de temperatura. Fortele de orientare
sunt forte de origine magnetica. Ele au valori mici si se
exercita numai pe distante foarte mici in jurul atomilor. La
distante mici ele se insumeaza cu fortele de atractie care
au raza mare de actiune.
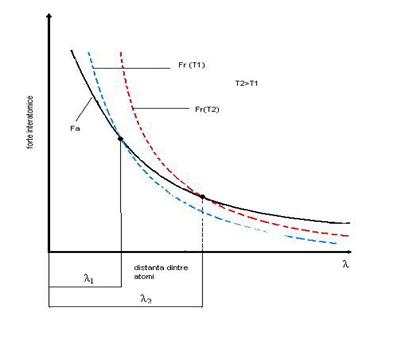
Variatia
fortelor de atractie si de respingere dintre atomi cu
temperatura (T2>T1)
Fortele de respingere cresc cu
cresterea temperaturii T. Ca urmare echilibrul Fr = Fa
se realizeaza la valori mai mari ale lui l, asa cum se observa in
figura 1.4. Cand l devine egal cu l , atomii ies de sub influenta
fortelor de orientare si ordinea cristalina se strica.
Datorita miscarii oscilatorii a atomilor, acestia se pot
apropia local, in timpul oscilatiilor la distante mai mici, reintrand
in sfera de actiune a fortelor de orientare. Ca urmare ordinea
cristalina se deterioreaza si se reface local, periodic, ceea ce
asigura o mobilitate mare atomilor.
Temperatura la care are loc deteriorarea
ordinii cristaline indepartate, reprezinta temperatura de topire. Ea
este constanta, fiind corelata cu o anumita distanta
interatomica.



