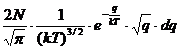STRUCTURA
STARII SOLIDE, LICHIDE SI GAZOASE
Obtinerea pieselor din aliaje metalice
prin turnare implica topirea aliajelor, turnarea acestora in forme avand
cavitati corespunzatoare geometriei piesei, urmata de solidificarea
si racirea pieselor. Structura primara a pieselor turnate e
influentata de structura si proprietatile aliajelor in
stare lichida si chiar de structura in stare solida
existenta anterior topirii, fenomen cunoscut sub denumirea de ereditate
structurala. Acest fenomen se explica prin caracteristicile
structurii in stare lichida si mecanismul formarii acesteia in
procesul de topire.
a.
Structura starii solide a
metalelor si a aliajelor este o structura cristalina. Metalele
si aliajele sunt constituite dintr-un numar mare de cristale de
dimensiuni mici (de ordinul 10-100mm) orientate la intamplare. In interiorul cristalelor,
atomii sunt dispusi intr-o ordine bine definita numita
retea cristalina. Intre atomii din reteaua cristalina se
exercita trei tipuri de forte: forte de atractie,
forte de respingere si forte de orientare. Existenta
acestor forte este demonstrata de rezistenta opusa de
cristale la intindere, la compresiune si de asezarea ordonata a
atomilor. Fortele de atractie si de respingere se exercita
pe distante relativ mari, in timp ce fortele de orientare au o
raza mica de actiune. Daca distanta dintre atomi se
mareste cu 2,5-3%, ordinea cristalina se deterioreaza, ceea
ce pune in evidenta iesirea atomilor din sfera de actiune a
fortelor de orientare.
Cristalele
au dimensiuni mari comparativ cu dimensiunile atomilor. Numarul de atomi
asezati ordonat de-a lungul unei directii intr-un cristal este
foarte mare. De exemplu, considerand latura unui cristal l=10mm, iar parametrul
retelei cristaline l 10-8mm =2,5A, numarul de atomi
orientati pe o directie este n = l/l 105. Din
aceasta cauza se considera ca structura cristalina a
starii solide se caracterizeaza printr-o ordine indepartata
(adica ordinea de aranjare a atomilor se mentine pe distante
mari in raport cu marimea parametrului retelei cristaline).
Fortele de atractie si de
respingere scad cu cresterea
distantei dintre atomi. Variatia acestor forte cu distanta
dintre atomi este diferita. Pozitia de echilibru din nodurile
retelei cristaline corespunde echilibrului dintre fortele de
atractie si de respingere. La distante mai mici sunt mai
puternice fortele de respingere, iar la distante mai mari sunt mai
puternice fortele de atractie. Variatia fortelor
interatomice de atractie si de respingere cu distanta dintre
atomi este reprezentata in figura 1.1. De asemenea este reprezentata
si variatia energiei potentiale a atomilor determinata de
campul de forte din jurul lor.
Atomii
din reteaua cristalina nu stau in pozitii fixe in nodurile
retelei. Datorita perturbatiilor mediului inconjurator
si a transmiterii acestor perturbatii in masa cristalului de la un
atom la altul, atomii executa mici oscilatii in jurul pozitiei
de echilibru. Aceste oscilatii sunt determinate de faptul ca asupra
unui atom scos din pozitia de echilibru actioneaza forta
rezultanta dintre forta de atractie si forta de
respingere ( F= Fr + Fa ) care intotdeauna este
orientata spre pozitia de echilibru. Se poate aprecia ca
forta rezultanta este proportionala cu distanta "x"
fata de pozitia de echilibru ( F=kx ) si este deci de tip
cvasielastic.
In
timpul miscarii oscilatorii a atomilor in jurul pozitiei de
echilibru , atomii poseda energie cinetica (Ec), cat si
potentiala (Ep). Energia totala a unui atom reprezinta suma
celor doua forme de energie. Energia medie a unui atom care executa
oscilatii in trei directii (avand trei grade de libertate), este qm
= (3/2)kT, unde k este constanta lui Boltzman.
Energia
termica (energia totala) a unui cristal reprezinta suma energiei
totale a atomilor cristalului. Energia
termica a unui cristal nu este repartizata uniform intre atomi.
Datorita interactiunii dintre atomii invecinati, energia
fiecarui atom se schimba permanent. Astfel, energia unui atom poate
avea valori foarte mici sau foarte mari.
Repartitia
energiei intre atomi la un moment, se poate stabili pe baza legii lui Maxwell.
Aceasta lege a fost stabilita pentru repartitia energiei
cinetice intre moleculele unui gaz si este exprimata de relatia:
dN=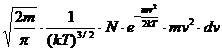 (1.1)
(1.1)
In
aceasta relatie N reprezinta numarul total de molecule, dN
este numarul de molecule avand viteza cuprinsa intre "v" si
"v+dv"; m-masa moleculelor; T-temperatura gazului.
Aceasta
relatie poate fi extinsa si asupra starii solide pentru a reda repartitia energiei
termice la atomii unui cristal. In acest scop este necesar ca dN sa se
exprime in functie de energia totala a atomilor q si de
variatia acestei energii dq. Se are in vedere considerentul ca in
cazul gazelor, energia totala corespunde cu energia cinetica a
particulelor, deoarece fortele de atractie sunt neglijabile. Ca
urmare in relatia (1.1) se fac urmatoarele inlocuiri:
q=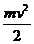 , v=
, v=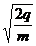 , dv=
, dv=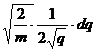 , (1.2)
, (1.2)
Se
obtine:
dN=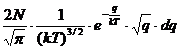 (1.3)
(1.3)
Curba reprezentativa a solutiei acestei
ecuatii diferentiale are forma din figura 1.
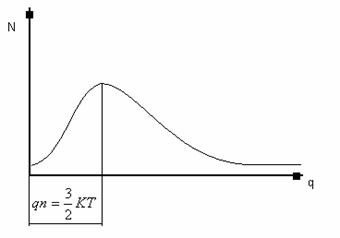
Figura 1.2 Reprezentarea energiei
la atomii din reteaua cristalina a unui cristal
Din
aceasta reprezentare rezulta ca in reteaua cristalina
exista in orice moment atomi care au energii peste valoarea medie, care
pot sa invinga fortele de orientare si sa
paraseasca pozitiile de echilibru. Ei pot sa ocupe
alte pozitii de echilibru in noduri invecinate, sau pozitii instabile
in ochiuri ale retelei, cu conditia sa existe astfel de locuri.
Energia necesara pentru a trece intr-o alta pozitie se
numeste energie de activare, iar atomii care poseda aceasta
energie se numesc atomi activati. La trecerea intr-o noua stare de
echilibru, atomii activati cedeaza energia de activare altor atomi
invecinati.
Energia
de activare poate fi obtinuta de la ceilalti atomi pe baza
repartitiei neuniforme a energiei intre atomi sau prin cresterea
energiei medii a atomilor (qm) prin incalzire.
b.
Structura starii gazoase este mult diferita de cea a
corpurilor solide. Gazele nu au nici volum nici forma proprie, avand
proprietatea de a curge foarte usor ca urmare a diferentelor de
presiune. Au compresibilitate foarte mare. Modelul teoretic ideal al gazelor
presupune ca acestea sunt constituite din particule (molecule)
punctiforme, intre care nu se exercita forte de interactiune,
distanta dintre molecule fiind mare comparativ cu raza de actiune a
fortelor interatomice. Moleculele se ciocnesc perfect elastic intre ele
sau cu peretii incintei, iar intre doua ciocniri se deplaseaza
rectiliniu uniform. Parametrii de stare ai gazelor ideale respecta legea
Clapeyron Mendeleev:
pV=nRT
(1.4)
In
cazul gazelor reale apar deosebiri de comportament deoarece volumul moleculelor
nu mai este neglijabil comparativ cu volumul ocupat de gaz, iar fortele de
interactiune nu mai sunt nici ele neglijabile. In cazul gazelor reale
ecuatia de stare are forma:
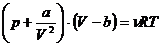 (1.5)
(1.5)
Unde
"b" este covolumul moleculelor , iar "a" constanta dependenta de
fortele interatomice.
c.
Structura starii lichide
este situata intre structura starii solide si a
starii gazoase. Lichidele au volum
propriu dar nu au forma proprie. Ele curg sub greutatea proprie, ceea ce
pune in evidenta existenta unor forte de atractie mult
mai reduse decat in starea solida. In schimb compresibilitatea lichidelor
este mica, asemanatoare corpurilor solide. Ca urmare a acestor
caracteristici, lichidele au fost considerate la inceput ca avand o structura
mai apropiata de structura gazelor, fiind considerate gaze cu densitate
mare. Ulterior s-a demonstrat ca structura lichidelor este mult mai
apropiata de structura corpurilor solide, ele fiind caracterizate printr-o
ordine apropiata de aranjare a atomilor . Mai recent structura starii
lichide se explica pe baza functiilor de corelatie.
Se
considera ca lichidele se caracterizeaza printr-o ordine
apropiata de aranjare a atomilor care se formeaza si se
deterioreaza intr-un timp de relaxare "to". De asemenea
numarul atomilor invecinati ordonati in jurul unui atom este mai
mic decat in stare solida.
La
topirea metalelor si aliajelor volumul creste cu 3-5%. Aceasta
corespunde unei cresteri a distantei dintre atomi cu 1-1,5%.
Aceasta crestere a distantei face ca atomii sa ajunga
la limita de manifestare a fortelor de orientare. In timpul
oscilatiei atomilor in jurul pozitiei de echilibru intre unii atomi
distanta creste peste limita de exercitare a fortelor de
orientare, in timp ce intre alti atomi distanta se mentine mai
mica, iar fortele de orientare isi mentine efectul. In
locurile unde distanta dintre atomi este mai mare decat raza de
actiune a fortelor de orientare, ordinea cristalina se
deterioreaza. Astfel ordinea cristalina se pastreaza pe
distante mici, comparabile cu distantele interatomice. Datorita
oscilatiei atomilor, distantele dintre atomii invecinati se
maresc si se micsoreaza periodic. In locurile unde momentan
distantele scad sub valoarea razei de actiune a fortelor de
orientare, ordinea cristalina se reface.
In
lichide se exercita de asemenea forte interatomice de atractie
si de respingere ca in starea solida. Fortele de atractie
sunt insa mult mai mici ceea ce determina deformabilitatea si
capacitatea de curgere a acestora. Cercetarile efectuate cu raze X asupra
structurii lichidelor a pus in evidenta aceste ipoteze si anume
distanta mai mare dintre atomi si numarul de coordinatie
mai mic.


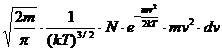
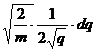 ,
,