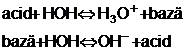SOLUTII LICHIDE (I)
pH -ul si aplicatiile lui;
prepararea solutiilor
pH -ul solutiilor apoase.
Datorita caracterului sau
acido-bazic (moleculei polare), apa poate desface legaturile chimice ale
moleculelor substantelor pe care le dizolva, fenomen numit disociere
electrolitica si care poate fi descris schematic prin
relatia:
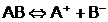 [
[
Disocierea electrolitica este un
fenomen reversibil care decurge conform actiunii maselor: viteza cu care
se produce o transformare chimica, la o temperatura data, este
proportionala cu produsul maselor, deci, implicit, al
concentratiilor substantelor care se transforma.
Fenomenul se va produce, astfel:
in sensul disocierii, cu viteza 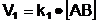 ; [
; [
in sensul recompunerii substantei, cu
viteza 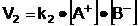 [
[
in care:
k1 si k2 sunt constante de
proportionalitate care depind de temperatura sistemului;
[AB], [A+] si [B-] sunt
concentratiile molare ale sistemului in substanta AB si ionii A+,
respectiv B-.
La echilibrul dinamic (V1 = V2),
rezulta:
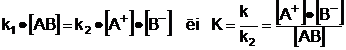 [
[
Constanta K - constanta de disociere
electrolitica - poate fi determinata prin masurarea
conductivitatii electrice a solutiei si, in functie de
aceasta, substantele se caracterizeaza ca:
electroliti tari, care in
solutii apoase disociaza complet (HCl; H2SO4;
HNO3; Ca(OH)2; NaCl; Na2SO4 etc.);
electroliti mijlocii (H3PO4;
H2SO3 etc.);
electroliti slabi (H2S; H2SiO3;
H2CO3 etc.).
Apa pura sufera
disociere electrolitica, avand constanta K = 1,8 x 10-16.
Cum molaritatea apei este 55,5
si concentratiile ionilor rezultati (H+ si OH-)
sunt egale, se poate scrie:
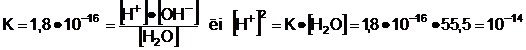 ;
;
de unde rezulta ) 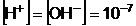 [
[
Pentru usurinta exprimarii,
s-a apelat la valoarea logaritmului zecimal, cu semn schimbat, a
concentratiei protonilor H+, rezultati in urma disocierii
electrolitice, valoare numita puterea, sau exponent al activitatii,
ionilor de hidrogen ).
pH = - lg [H+]
[
Pentru pH = 7, cazul apei pure, rezulta
ca solutiile sunt neutre, intrucat
[H+]=[OH-].
Cand in apa se dizolva un
electrolit, disocierea electrolitica se produce conform urmatoarelor
scheme:
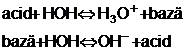
In solutiile apoase diluate H3O+
este cel mai tare acid, iar HO- este cea mai tare baza, incat,
corespunzator modificarii raportului intre concentratiile
protonilor de hidrogen si gruparilor oxidril, valoarea pH -ului se
modifica.
pentru pH < 7, [H+] >
[OH-], solutia avand caracter acid;
pentru pH > 7, [H+] <
[OH-], solutia avand caracter bazic.
2. Determinarea
pH -ului solutiilor.
PH -ul solutiilor se poate determina
prin metode colorimetrice, folosind indicatorii de pH, sau prin metode
electrice.
Indicatorii de pH sunt substante organice care, prin
ionizare / schimbari structurale, isi modifica
culoarea. Modificarea culorii (virajul) se produce in domenii de valori ale pH
-ului specifice indicatorilor (Tabel 1.). numite domenii de viraj sau intervale
de tranzitie.
Tabelul 1.
Principalii indicatori de pH
|
|
Indicator pH
|
Culoarea, in mediu:
|
Domeniul pH
|
|
acid
|
bazic
|
de viraj
|
|
Fenolftaleina
|
incolora
|
rosie
|
|
|
Turnesol
|
rosie
|
albastra
|
|
|
|
galbena
|
albastra
|
|
|
Rosu de metil
|
rosie
|
galbena
|
|
|
Metiloranj
|
rosie
|
galbena
|
|
|
Metilviolet
|
verde
|
violeta
|
|
Indicatorii
se pot folosi sub forma de solutii (de regula alcoolice), din
care se introduc 1 - 3 picaturi in solutia de analizat, sau
sub forma de hartie de filtru impregnata, care se umezeste cu
solutia de analizat. Valoarea pH -ului se stabileste prin compararea
culorii obtinute cu scala etalon de culori ale indicatorului folosit.
Determinarea pH -ului prin metode
electrice, numite metode potentiometrice, se bazeaza pe
masurarea tensiunii electromotoare a unei pile galvanice formata, in
solutia de analizat, dintr-un electrod de referinta (cu
potential cunoscut) si un electrod de masura al carui
potential variaza in functie de concentratia ionilor H+
din solutia de analizat.
Electrodul de masura este
alcatuit dintr-un balon de sticla semipermeabila, in interiorul
caruia se introduce o solutie de concentratie precis
cunoscuta si un electrod metalic de contact. Tensiunea electromotoare
ce ia nastere, ca urmare a dezechilibrului de potential intre
electrozi, prin tranzitarea peretelui balonului de catre ionii H+,
in tendinta de egalare a concentratiilor solutiilor (din balon,
respectiv de analizat), amplificata de sistemul electronic al aparatului
(numit pH-metru sau potentiometru) este masurata pe scala
etalonata in unitati pH.
Aplicatii
ale pH -ului solutiilor. Titrarea.
Ionii de hidrogen sunt prezenti in
toate mediile apoase. Toate procesele chimice care au loc in astfel de medii
sunt influentate de acesti ioni, fie direct, cand acestia
participa nemijlocit in proces, fie indirect. Din aceasta cauza
pH -ul trebuie considerat ca un parametru important in numeroase procese
de laborator, industriale sau naturale.
Metoda colorimetrica fiind
expeditiva, pH -ul lichidelor (apelor) este primul parametru care
poate avertiza asupra impurificarii acestora si nivelului de
agresivitate chimica.
Pe baza relatiei de definitie,
cunoscand natura solutului si constanta de disociere electrolitica a
acestuia, in functie de pH se poate calcula molaritatea
solutiilor apoase diluate.
In tehnica de laborator, metoda colorimetrica
poate fi aplicata in operatia de titrare, pentru determinarea
concentratiei unei solutii, folosind o alta solutie de
concentratie precis cunoscuta.
La titrare, intr-un volum cunoscut de
solutie cu concentratie necunoscuta (solutie titrata),
in care s-au introdus 1 - 3 picaturi de solutie de
indicator, se adauga, din biureta, (picatura cu
picatura), o alta solutie (solutie de titrare)
cu concentratia cunoscuta.
Conditiile de realizare a
titrarii sunt:
solutul din solutia titrata
sa reactioneze cu solutul din solutia de titrare, reactie
in urma careia amestecul de solutii sa se neutralizeze;
sa se cunoasca precis
concentratia uneia dintre solutii;
sa se utilizeze indicatorul care
vireaza in domeniul pH -ului pe care il determina produsul de
reactie;
pe intreaga durata a titrarii
solutia titrata sa fie agitata pentru a se asigura
reactionarea solutilor.
Titrarea este terminata cand se
ajunge la momentul de echivalenta, adica atunci cand cei doi
soluti au reactionat in proportii echivalente. Acest moment este
evidentiat de obtinerea culorii corespunzatoare pH -ului
determinat de concentratia solutiei in produsul de reactie a
celor doi soluti.
Cunoscand legea echivalentilor
chimici, conform careia substantele reactioneaza intre ele
in numar egal de echivalenti si exprimand concentratiile
solutiilor prin normalitati, in momentul de
echivalenta se poate considera realizata egalitatea:
V1 Cn1 = V2Cn2 , din care rezulta 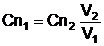 [
[
in care:
V1 si V2 sunt volumele
solutiilor amestecate, in momentul de echivalenta;
Cn1 si Cn2 sunt
normalitatile solutiilor (Cn1 necunoscuta).
In
lucrarea practica se vor executa:
determinari,
cu indicatori pH, pentru cazurile prevazute in tabelul 2.
titrari
demonstrative cu solutii de NaOH, HCl, si (COOH)2, cu
concentratiile indicate de
conducatorul lucrarii.
Reactiile
specifice titrarilor sunt:
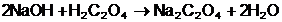 [
[
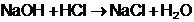 [
[
|
Tabel 2. Rezultate practice
|
|
SOLUTIA
|
Indicatorul (solutie)
|
Culoarea
|
Caracterul solutiei
|
PH -ul, cu hartie
|
Observatii
|
|
Apa distilata
|
|
|
|
|
|
|
Apa potabila
|
|
|
|
|
|
|
Solutie de NaOH
|
|
|
|
|
|
|
Solutie de HCl
|
|
|
|
|
|
|
Solutie de (COOH)2
|
|
|
|
|
|
|
Apa de var
|
|
|
|
|
|
|
Suspensie de ciment
|
|
|
|
|
|
4. Reguli
minimale de protectie a muncii.
Substantele chimice pot fi caustice.
In consecinta, se impun urmatoarele reguli:
Nu se vor mirosi substantele chimice.
Nu se vor face amestecuri de
substante decat in conformitate cu indicatiile conducatorului
lucrarii.
Recipientele ce contin solutii
sau substante chimice vor fi inchise si se vor manipula cu
grija, pentru evitarea spargerii.
Se va evita contactul substantelor
chimice cu pielea sau cu imbracamintea. In cazul contactului
accidental, se va proceda la tamponarea rapida a zonei cu vata
imbibata cu solutie diluata cu caracter electrochimic opus
(pentru neutralizare) si la spalarea cu apa.
Deversarea solutiilor la canalizare
se face numai dupa diluarea si neutralizarea lor.
Dupa terminarea lucrarilor,
vasele si aparatura se vor spala cu apa potabila.
5. Prepararea solutiilor
In tehnica de laborator, pentru prepararea
solutiilor cu anumite concentratii, apar urmatoarele probleme
principale:
eliminarea din solvent a unor substante
continute de acesta si care pot reactiona cu solutul formand
substante impurificatoare pentru solutia care se prepara;
dozarea corecta a solutului;
verificarea concentratiei
obtinute pentru solutia preparata prin determinarea
concentratiei exacte realizate;
obtinerea unei solutii cu concentratie
impusa, prin amestecarea a doua solutii cu concentratii
diferite.
Purificarea solventilor
In cazul solutiilor apoase, prima
problema se rezolva prin folosirea ca solvent a apei distilate,
proaspat fiarta. Prin distilare se elimina sarurile iar
prin fierbere se elimina gazele eventual dizolvate.
Totodata, intreaga aparatura de
laborator folosita la prepararea solutiei se va spala cu
apa potabila, apoi cu apa distilata, iar recipientul in
care se va pastra solutia, respectiv aparatura folosita pentru
dozarea solutiei se va spala, in final, cu solutia pe care o va
primi.
Recipientele de pastrare a solutiilor
trebuie inchise ermetic.
In cazul solventilor care nu pot fi
distilati se adauga substante chimice care
reactioneaza cu substantele impurificatoare dand noi
substante care, fie ca nu reactioneaza cu solutul, fie
ca precipita si pot fi separati prin filtrare sau
decantare.
Dozarea solutului
In ceea ce priveste dozarea
corecta a solutului, problema se rezolva diferit, in functie de
starea acestuia (pura sau impura, solid sau in solutie, stabil
sau instabil in conditiile de depozitare).
Situatiile care se pot intalni pot fi
exemplificate, in principiu, prin urmatoarele patru cazuri:
Cazul I: Solutul este pur si stabil
in conditiile de depozitare.
In acest caz, cantitatea necesara de solut se
dozeaza cit mai precis (cu balanta analitica, cu biureta sau cu
pipeta) si se introduce intr-un volum mai mic de solvent, dupa totala
dizolvare urmand a se completa volumul de solutie prin adaugare de
solvent.
Cazul
II: Solutul
este stabil in conditiile de depozitare, dar se prezinta in stare
impurificata cu alte substante chimice.
Cazul se exemplifica prin prepararea
unei solutii de acid oxalic in apa, cu concentratia 0,1n.
Acidul oxalic este un acid organic cu
compozitia chimica redata de formula (COOH)2. Se
prezinta sub forma cristalizata cu doua molecule de
apa, stare in care este stabil fata de gazele atmosferice.
In starea in care urmeaza a fi dozat,
acest solut va avea, deci, formula chimica (COOH)2 2H2O.
Pentru prepararea unui litru de
solutie 0,1n este necesara o cantitate de 0,1 val de acid oxalic
chimic pur, adica o cantitate de 0,1 x 45,019 = 4,5019 grame.
La cantarirea acestei
cantitati, se introduce, insa, si apa de cristalizare (care
la dizolvare va deveni solvent), incat este necesara suplimentarea
cantitatii de solut cristalin cu cantitatea de apa de
cristalizare pe care o contine.
Tinand seama de formula chimica,
rezulta ca fiecare val de acid oxalic chimic pur va contine 2
val de apa.
Pentru prepararea solutiei trebuie,
deci dozata cantitatea de acid oxalic cristalin de:
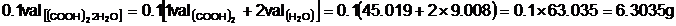
Cazul
III: Solutul
este instabil in conditiile de depozitare
Cazul se exemplifica prin prepararea
unei solutii de hidroxid de sodiu in apa, cu concentratia 0,1n.
Hidroxidul de sodiu reactioneaza
usor cu bioxidul de carbon (atmosferic), carbonatandu-se conform
ecuatiei:
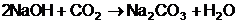
Intrucat carbonatarea granulelor de
hidroxid este variabila, nu se poate doza cantitatea exacta de 0,1
val (4 g) de hidroxid de sodiu pur.
Pentru rezolvarea problemei, se
prepara o solutie cu concentratia usor superioara,
careia urmeaza a i se determina precis concentratie si a i
se corecta, prin diluare, pana la concentratia ceruta.
Practic, se cantareste o
cantitate mai mare (5-7) g de granule de hidroxid de sodiu, carbonatat
superficial, se spala cu apa distilata (pentru indepartarea
stratului carbonatata) si se dizolva in apa distilata
pentru a obtine 1 litru de solutie.
Concentratia solutiei astfel
obtinute se va determina prin titrare cu solutie de acid oxalic 0,1n,
in prezenta fenolftaleinei:
se masoara V1=20 cm3
de solutie de acid oxalic, cu concentratia Cn1=0,1n, se
introduce intr-un vas Erlenmeyer, se incalzeste la temperatura de
(60-70)oC, pentru eliminarea eventualului bioxid de carbon dizolvat,
se raceste la temperatura de 20oC si i se adauga
2 picaturi de solutie alcoolica de fenolftaleina 2% T solutia ramane incolora, intrucat fenolftaleina este
incolora in mediu acid;
Se umple (la marca 0) o biureta cu
solutia de NaOH, careia trebuie sa i se determine
concentratia Cn2;
se introduce, in picaturi, din biureta,
solutia de NaOH in solutia de acid oxalic, pana la
obtinerea culorii slab-roza, persistenta (momentul de echivalenta);
se citeste, pe biureta, volumul V2
de solutie de NaOH consumat.
Pe toata durata titrarii, vasul
Erlenmeyer trebuie agitat pentru a se uniformiza concentratia produsului
de reactie.
In timpul titrarii se produce urmatoarea
reactie chimica de formare a oxalatului de sodiu:
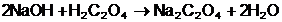
Se calculeaza normalitatea Cn2
, a solutiei de NaOH, cu relatia:
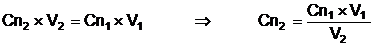
Pentru a corecta normalitatea la valoarea
Cn=0,1n, un volum initial (Vini) de solutie cu
normalitatea Cn2 trebuie adus, prin diluare cu apa
distilata, la volumul final (Vfin), calculat cu relatia:
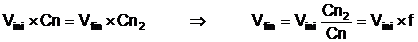 [ [
[ [
unde f este numit factorul solutiei.
Volumul de apa (Vapa ) cu
care trebuie diluat volumul de solutie Vini, in sensul
mentionat, va fi:
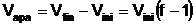
Cazul
IV: Solutul
este instabil in conditiile de depozitare si se afla in
solutie cu concentratia aproximativ cunoscuta.
Cazul se exemplifica prin prepararea
unei solutii 0,1n, de acid clorhidric.
Acidul clorhidric este gazos in
conditii normale. Pentru utilizare, se dizolva in apa, fiind
fabricat (ca reactiv de laborator) in solutie cu concentratia de 37%
(m/m) si densitatea r=1,19 g/cm3 (date marcate pe
eticheta flaconului).
Volumul de solutie ce ar trebui
dozat, pentru a obtine 0,1 val de acid clorhidric pur, rezulta din
urmatorul rationament:
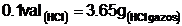
Pentru concentratia de 37%, cele 3,65
g de acid clorhidric se vor regasi in masa (msol) de
solutie:
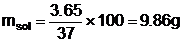
ceea ce corespunde unui volum Vsol de
solutie:
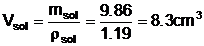 [19]
[19]
Intrucat nu se poate conta pe
concentratia solutiei ),
se procedeaza in mod similar cazului III: se prepara o solutie
cu concentratie usor superioara celei cerute (folosind un volum
mai mare de solutie de acid clorhidric), se determina
concentratia exacta a solutiei preparate (prin titrare) si
se dilueaza pentru a obtine concentratia impusa.
Titrarea se executa, in cazul
acidului clorhidric, cu solutie de hidroxid de sodiu 0,1n ),
in prezenta indicatorului metil-orange.
Intr-un vas Erlenmeyer se introduc 20 cm3
solutie de NaOH si 1-2 picaturi de metil-orange Tsolutia se va colora in galben;
Se titreaza cu solutie de HCl
(conform indicatiilor de la cazul III), pana la obtinerea
culorii portocalie (culoarea cojii de ceapa uscata).
In timpul titrarii, se produce
reactia de obtinere a clorurii de sodiu:
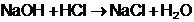 [20]
[20]
Se calculeaza normalitatea
solutiei de acid clorhidric si volumul de apa cu care trebuie
diluata, pentru a fi adusa la normalitatea impusa, in mod
similar cazului III.
5. Reguli
minimale de protectie a muncii.
In cadrul lucrarilor practice se vor
respecta regulile de protectia muncii, indicate la pct. 4., completate cu
urmatoarele:
Pentru diluarea solutiilor de acizi,
se va proceda la introducerea solutiei in apa, pentru evitarea
fierberii acidului (datorita caldurii de hidratare) si stropirea
cu acid concentrat.
Agitarea vasului Erlenmeyer, in cadrul
operatiei de titrare se va realiza cu grija (pentru evitarea spargerii),
prin miscari circulare (pentru evitarea stropirii).
La incalzire vasele vor fi manipulate cu
clestele de laborator si vor fi agitate permanent deasupra
flacarii, fiind tinute in pozitie usor inclinata
spre exterior


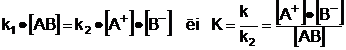
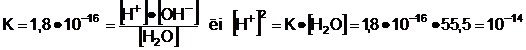 ;
;