Proiect
de chimie
Clasa : a IX-a profil
matematica - informatica
Disciplina: Chimie
Tema:
Structura invelisului electronic
Titlul
lectiei: Structura
invelisului de electroni
Configuratia
electronica a atomului
Timp
de lucru: 2 ore
Tipul lectiei:
Insusire de noi cunostinte
Obiective
operationale:
Elevii trebuie sa fie capabili sa:
I: sa defineasca notiunile de nitrare de spin, orbital
atomic, strat electronic;
II: sa clasifice orbitalii in functie de energia, forma si
orientarea lor.
Structura invelisului electronic:
1. orbital atomic;
2. substrat;
3.
miscare de spin;
4. strat;
5. configuratie
electronica;
6. element
reprezentativ;
7. element
tranzitional;
8. principiul
stabilitatii;
9. principiul lui Pauli;
10. regula lui Hund.
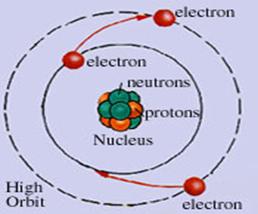
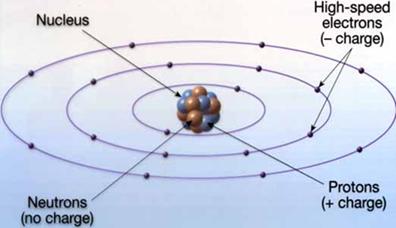
Materia are o structura
discontinua; ea este alcatuita din particule mici care nu pot fi
observate cu ochiul liber numite atomi.
- atomul este cea mai mica particula care prin procedee chimice
obisnuite nu mai poate fi
divizata, dar care participa la reactiile chimice;
- particule elementare sunt electronul, protonul si neutronul;
- atomul este caracterizat de numarul
atomic (z) si numarul de masa (a);
- invelisul electronic
este totalitatea electonilor care graviteaza in jurul nucleului;
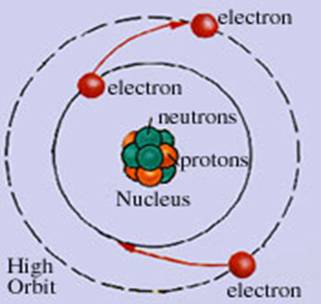
Figura
1.
Configuratia
electronica a atomului:
structura invelisului
electronic este comportarea chimica a atomilor si reactivitatea
substantelor;
miscarea electronului in
jurul nucleului poate fi comparata cu un nor electronic, incarcat
negativ;
orbitalul
atomic este zona
din jurul nucleului in care exista probabilitatea maxima de a
gasi electronul;
miscarea
de spin este miscarea pe care o efectueaza
electronul in jurul axei sale.
Miscarea
de spin este in sensul acelor de ceasornic sau in sens invers.
Figura 2.
Tipuri de orbitali:
Sunt 4
tipuri de orbitali si anume:
orbitali de tip s;
orbitali de tip p;
orbitali de tip d;
orbitali de tip f.
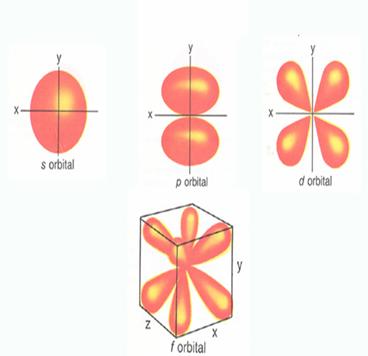
Figura
3. Orbitali
Orbital de tip s are forma sferica
adica nucleul este situat in
centrul sferei si 1 orbital / strat.

Figura
4. Orbitalul de tip s
Orbitali
de tip p au forma bilobara
adica lobii sunt orientati de-a lungul axelor de simetrie si
3 orbitali / strat.

Figura
5. Orbitalul de tip p
Orbitali de tip d au forma complicata si 5 orbitali / strat

Figura
6. Orbitalul de tip d
Orbitali de tip f au forma complicata si 7
orbitali / strat

Figura
7. Orbitalul de tip f
Orbitalii
se deosebesc:
forma;
energie;
orientare spatiala.
Exercitiu:
Noteaza in tabelul de mai jos numarul de orbitali
corespunzatori fiecarui substrat
|
substrat
|
s
|
p
|
d
|
f
|
|
Nr. orbitali
|
|
|
|
|

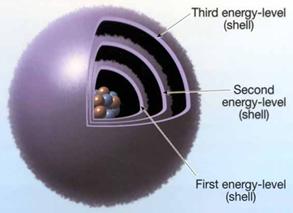
Strat
7 straturi de la 1.7; KQ;
fiecare strat electronic are unul
sau mai multe substraturi;
substratul are totalitatea orbitalilor de acelasi tip.

Figura 8.
Modul
de notare al stratului, substratului si al numarului de electroni:
1. 4p2;
2.
4 este numarul stratului;
3.
p este tipul substratului;
4.
2 este numarul de electroni din
orbital.
Figura
9.
III:
sa enunte principiul Pauli si regula Hund;
IV:
sa modeleze configuratia electronica a elementelor din perioadele 1,2,3.
Configuratia electronica a atomului:
- repartizarea electronilor pe straturi
si substraturi
- ocuparea cu electroni a orbitalilor
atomici are la baza:
a) principiul stabilitatii;
b)
principiul de excluziune al lui Pauli;
c)
regula lui Hund.
Principiul stabilitatii sau al
minimei energii:
In atomii multielectronici, electronii se
plaseaza in orbitali in ordinea succesiva a cresterii energiei
lor.
Altfel spus, electronul distinctiv tinde sa ocupe orbitalul vacant cu
energia cea mai scazuta.
Principiul de excluziune al lui Pauli:
Un orbital atomic poate fi ocupat cu maximum
doi electroni cu spin opus.
Regula lui Hund:
Completarea orbitalilor aceluiasi
substrat cu electroni are loc astfel incat numarul de electroni
necuplati (impari) sa fie maxim.
Dupa semiocuparea orbitalilor
aceluiasi substrat urmeaza cuplarea cu al doilea electron de spin
opus
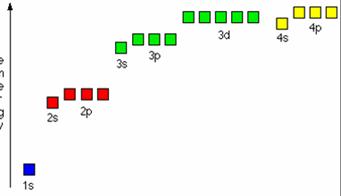
Ordinea ocuparii
cu electroni a orbitalilor atomici pentru primele 4 straturi:
Figura
10.
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4 p6 5s2 4d10
5 p6 6s2 5d10 4f14 6
p6 7s2 6d10 5 f14
Configuratia electronica a atomilor
din perioadele 1, 2 si 3
Perioada 1
|
H (Z = 1)
|
1s1
|
|
He (Z = 2)
|
2s2 = [He]
are configuratie stabila
de dublet
|
Perioada 2
|
Li (Z = 3)
|
[He] 2s1
Electronul distinctiv se afla intr-un
orbital s
|
|
Be (Z = 4)
|
[He] 2s2
|
|
B (Z = 5)
|
[He] 2s2 2p1
Electronul distinctiv se afla
intr-un orbital p
|
|
C (Z = 6)
|
[He] 2s2 2p2
|
|
N (Z = 7)
|
[He] 2s2 2p3
|
|
O (Z = 8)
|
[He] 2s2 2p4
|
|
F (Z = 9)
|
[He] 2s2 2p5
|
|
Ne (Z = 10)
|
[He] 2s2 2p6 = [Ne]
|
Perioada 3
|
Mg (Z = 12)
|
[Ne] 3s2
|
|
Al (Z = 13)
|
[Ne] 3s2 3p1
|
|
Si (Z = 14)
|
[Ne] 3s2 3p2
|
|
P (Z = 15)
|
[Ne] 3s2 3p3
|
|
S (Z = 16)
|
[Ne] 3s2 3p4
|
|
Cl (Z = 17)
|
[Ne] 3s2 3p5
|
|
Ar (Z = 18)
|
[Ne] 3s2 3p6 = [Ar]
|
Metode didactice: instruirea
programata, descoperirea dirijata, modelarea, explicatia.
Materiale didactice utilizate:
informatii pe CD, fise de lucru, manual de chimie clasa a IX-a.
Desfasurarea
lectiei:
I. captarea atentiei se
realizeaza prin reactualizarea cunostintelor despre structura
atomului (vizualizare pe CD) ;
Materia
are o structura discontinua; ea este alcatuita din particule
mici care nu pot fi observate cu ochiul liber numite atomi.
- atomul este cea mai
mica particula care prin procedee chimice obisnuite nu mai
poate fi divizata, dar care participa la reactiile chimice;
- particule elementare sunt electronul, protonul si
neutronul;
- atomul este caracterizat de numarul
atomic (z) si numarul de masa (a);
- invelisul electronic
este totalitatea electonilor care graviteaza in jurul nucleului .
Figura
11.
II. enuntarea obiectivelor
la nivelul elevilor:la sfarsitul celor doua ore elevii trebuie
sa fie capabili sa modeleze configuratia electronica a
elementelor din perioadele 1,2 si 3.
(Acest scop va fi atins prin insusirea
notiunilor).
Despre ce vom
invata in acest capitol:
orbital atomic;
substrat;
miscare de spin;
strat;
configuratie electronica;
element reprezentativ;
element tranzitional;
principiul stabilitatii;
principiul lui Pauli;
regula lui Hund.
III. reactualizarea cunostintelor se
face printr-o discutie cu elevii despre:
a) miscarea electronilor cu viteze foarte mari , in jurul nucleului;
b) asezarea ordonata a
electronilor in straturi electronice in functie de energia electronilor.
IV. stabilirea ideii ancora:
Ocuparea cu electroni a straturilor,
substraturilor si orbitalilor se face cu respectarea anumitor reguli.
V. conducerea invatarii:
Se
propune urmarirea materialului pe suport CD.
Se
definesc orbitalul atomic cu vizualizare, miscare de spin si cele
patru tipuri de orbitali cu vizualizare. Li se cer elevilor sa rezolve
exercitiul propus pe fisa de lucru.
Orbitalii
se deosebesc:
forma;
energie;
orientare spatiala.
Exercitiu:
Noteaza in tabelul de mai jos numarul de orbitali
corespunzatori fiecarui
substrat
|
substrat
|
s
|
p
|
d
|
f
|
|
Nr. orbitali
|
|
|
|
|

Se defineste
substratul si se explica modul de notare a stratului electronic.
Strat:
7 straturi de la 1.7; KQ;
fiecare strat electronic are unul
sau mai multe substraturi;
substratul
este totalitatea orbitalilor de acelasi tip.
Figura
12.
Modul
de notare al stratului, substratului si al numarului de electroni:
1. 4p2;
2. 4 este numarul stratului;
3. p este tipul substratului;
4. 2 este numarul de electroni din orbital.
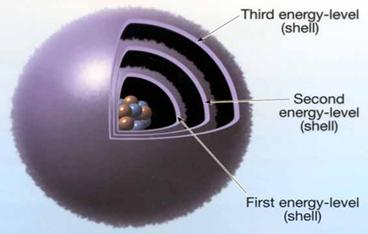
Figura
13.
Se trece la partea a doua a
lectiei: "Configuratia
electronica a atomului"
Se
enunta :
1. principiul stabilitatii;
2. principiul de excluziune al
lui Pauli;
3. regula Hund.
Se prezinta ordinea de
ocupare cu electroni a orbitalilor
atomici pentru primele patru straturi electronice, tinand cont de principiul
stabilitatii(sau al minimei energii).
VI. evaluarea performantei se
realizeaza prin urmatoarea activitate independenta a elevilor:
a) li se cere sa completeze, in
fisa de lucru, configuratia electronica a elementelor din
perioadele 1, 2 si 3;
b) li se cere sa confrunte propriile
rezultate cu tabelul de pe suportul CD si sa se autoevalueze din
oficiu 1punct, fiecare substrat notat corect 0,3 puncte.
Configuratia
electronica a atomilor din perioadele 1, 2 si 3.
Perioada
1
|
H (Z = 1)
|
1s1
|
|
He (Z = 2)
|
2s2 = [He]
are
configuratie stabila de dublet
|
Perioada
2
|
Li (Z = 3)
|
[He]
2s1
Electronul
distinctiv se afla intr-un orbital s
|
|
Be (Z = 4)
|
[He]
2s2
|
|
B (Z = 5)
|
[He]
2s2 2p1
Electronul
distinctiv se afla intr-un orbital p
|
|
C (Z = 6)
|
[He]
2s2 2p2
|
|
N (Z = 7)
|
[He]
2s2 2p3
|
|
O (Z = 8)
|
[He]
2s2 2p4
|
|
F (Z = 9)
|
[He]
2s2 2p5
|
|
Ne (Z = 10)
|
[He]
2s2 2p6 = [Ne]
|
Perioada
3
|
Na
(Z = 11)
|
[Ne]
3s1
|
|
Mg
(Z = 12)
|
[Ne]
3s2
|
|
Al
(Z = 13)
|
[Ne]
3s2 3p1
|
|
Si
(Z = 14)
|
[Ne]
3s2 3p2
|
|
P (Z
= 15)
|
[Ne]
3s2 3p3
|
|
S (Z
= 16)
|
[Ne]
3s2 3p4
|
|
Cl
(Z = 17)
|
[Ne]
3s2 3p5
|
|
Ar
(Z = 18)
|
[Ne]
3s2 3p6 = [Ar]
|
VII. intensificarea retentiei si
asigurarea feed-backului:
Se realizeaza prin rezolvarea
temei pentru acasa : ex. 7/ pag.22

















