TESTE
CHIMIE FIZICA. PARTEA I
SUBIECTUL I:
Alegeti raspunsul corect din cele cinci varante
1. Despre nivelul microscopic de studiu al materiei, este
corecta afirmatia:
- studiaza materia cu ajutorul microscopului optic
- studiaza materia prin metodele specifice mecanicii cuantice,
corespunzatoare particulelor atomice si subatomice, cu dimensiuni
mai mari de 10-8cm
- studiaza materia cu ajutorul microscopului electronic
D.
studiaza materia prin metodele specifice
mecanicii cuantice, corespunzatoare particulelor atomice si
subatomice, cu dimensiuni mai mici de 10-8cm
- studiaza materia prin metode clasice la baza carora stau
observatiile microscopice
2. Fortele Keesom se manifesta intre:
A.
doua molecule nepolare; B. O molecula polara si o
molecula nepolara;
C).
intre doua molecule polare; D. intre doi ioni de acelasi semn; E.
intre doi ioni de semn contrar.
3. Unitatea de masura pentru presiune, in SI,
este:
A.
atmosfera ( 1 atm = 105Pa); B. barrul (1 barr = 105Pa);
C. pascalul (1Pa= 1 N/m2)
D. barul
(1 barr = 10-5Pa); E. atmosfera (1 atm = 101325 Pa)
4. Studiul gazelor perfecte, in conditii izobare se
realizeaza cu relatia:
A.P1V1 =
P2V2; B. P1 = Po(1 + bT); C. V1T1 = V2T2; D.V1T2 = T1V2; E. V2/V1 =
T1/T2
5. Intr-un vas cu volumul de 10 m3 se
afla un amestec de N2 si CH4 in raport molar de
1:4.
Cunoscand: AN = 14; AH = 1; AC
= 12; R = 0,082 l.atm/mol.K, fractia molara a amestecului este:
A. 0,4
N2 si 0,6CH4;
B. 0,6 N2 si 0,4CH4;
C. 0,2 N2 si 0,8CH4;
D. 0,8 N2 si 0,2CH4;
E. 0,1 N2 si 0,9CH4;
6. Despre doi polimorfi este adevarata
urmatoarea afirmatie:
A. au
aceeasi stare de cristalizare; B. au aceeasi compozitie
chimica; C. au aceleasi puncte de topire
D. au
aceeasi solubilitate; E. au aceasi activitate terapeutica
7. Care dintre grupurile de mai jos contin numai molecule
intre care se manifesta legaturi de hidrogen:
A. apa,
azot, amoniac; alcool etilic
B.
carbamazepina; apa; clorura de sodiu; acid acetic
C.
α-alanina; acid benzoic, alcool etilic; γ-globulina
D.
γ-globulina; carbamazepina; acetat de etil; alcool etilic
E. oxigenul;
etilamina; alcoolul propilic; α-alanina
8. Spectrele UV-VIZ se datoreaza:
A.
saltului electronilor de pe nivelele exterioare
B.
miscarii de rotatie-vibratie a moleculelor
C.
saltului electronilor de pe nivelele interioare
D.
miscarii de rotatie a electronului
E.
miscarii de rotatie a nucleului
Sistemele termodinamice adiabatice
sunt:
A. sistemele
care nu schimba nici energie si nici masa cu mediul exterior;
B. sistemele
care realizeaza numai schimb de masa cu mediul exterior;
C. sistemele
care nu schimba energie sub forma de caldura cu mediul
exterior;
D. sistemele
care schimba numai energie cu mediul exterior;
E. sistemele
la care proprietatile sunt identice in orice element de volum din
interiorul sau.
10. Sistemele
termodinamice omogene sunt:
A. sistemele la care
proprietatile sunt identice in elementul de volum din interiorul
fazei continue.
B. sistemele la care
proprietatile inregistreaza salturi valorice la nivelul
suprafetelor interfazice;
C. sistemele la care
proprietatile sunt identice in orice element de volum din interiorul
sau
D. sistemele care schimba numai
energie cu mediul exterior;
E. sistemele care nu schimba
energie sub forma de caldura cu mediul exterior;
11. Variabilele termodinamice care nu depind de
cantitatea de substanta, se numesc:
A. functii omogene de gradul
intai; B. variabile dependente.; C. variabile extensive;
D. variabile independente,; E.
variabile intensive;
12. Diferenta dintre capacitatea calorica
molara la presiune constanta,  si cea la volum
constant,
si cea la volum
constant, 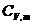 , pentru un gaz ideal este egala cu:
, pentru un gaz ideal este egala cu:
A. 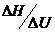 ; B. Zero; C.
; B. Zero; C. 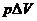 ; D. 2/3R ; E.
R.
; D. 2/3R ; E.
R.
13. Care din afirmatiile urmatoare
reprezinta formularea corecta a principiului III al termodinamicii?
A.
starea standard a unui solid este starea
pura a solidului la presiunea de 1 atm., cu activitatea egala cu
unitatea;
B.
entropia tuturor solidelor pure, cristaline
la temperatura de 0K este unitara;
C.
procesele spontane sunt insotite de
cresteri de entropie, respectiv de cresterea dezordinii sistemului;
D.
la temperatura de 0K toate substantele
au entropia diferita de zero.
E.
entropia tuturor solidelor pure, cristaline
se considera zero la temperatura de zero absolut
14. Variatia potentialelor termodinamice in
functie de gradul de avansare a reactiei (l), se
numeste:
A. reactivitate chimica; B. fugacitate; C.
activitate chimica; D. afinitate chimica; E. potential chimic.
15. Un sistem termodinamic monocomponent poate fi :
A.
monovariant, daca este alcatuit
dintr-o singura faza;
B.
bivariant, daca este alcatuit din
dintr-o faza in echilibru,
C.
invariant, daca este alcatuit din
doua faze in echilibru;
D.
monovariant, daca se pot modifica
arbitrar doua variabile intensive fara sa aiba loc o
transformare de faza;
E.
invariant, daca este alcatuit
dintr-o singura faza.
16. Pentru o solutie
binara ideala, legea lui Raoult se exprima prin urmatoarea relatie:
A.
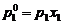 ; B.
; B. 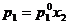 ; C.
; C.  ; D.
; D. 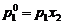 ; E.
; E.  .
.
17. Daca x1 si x2
reprezinta fractiile molare ale solventului (component volatil)
si solvitului (component nevolatil), p0 este presiunea
de vapori a solventului pur si peste presiunea de vapori a
solventului deasupra solutiei, atunci conform legii lui Raoult, este
corecta urmatoarea relatie:
B.  ; B.
; B. 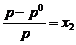 ; C.
; C. 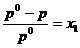 ; D.
; D. 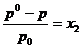 ; E.
; E. 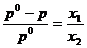
18. Presiunea osmotica a
unei solutii apoase care contine 12g/L uree (M=60; R=0,082 l atm mol-1 K), la temperatura
de 27 o C este:
A. 224 atm; B. 4,92 atm; C. 2,46 atm; D. 27,3 atm; E. 2,24 atm.
19. Caldura
necesara ridicarii temperaturii unui sistem in care nu au loc
transformari de faza si reactii chimice cu un grad, se
numeste:
A. capacitate calorica;
B. joule;
C. calorie;
D. entalpie;
E. entalpie libera.
20. Dizolvarea in apa a clorurii de
sodiu are loc cu consum de caldura. In acest caz este corecta afirmatia:
A. energia
de retea este mai mica decat energia de solvatare
B. energia
de solvatare este mai mare decat energia de retea
C. procesul
este favorizat de cresterea temperaturii
D. procesul
este favorizat de scaderea temperaturii
E. procesul
nu este favorizat de variatia temperaturii
21.Despre nivelul mezoscopic de studiu al materiei, este
corecta afirmatia:
F. studiaza
materia cu ajutorul microscopului optic
G. studiaza
materia prin metode clasice la baza carora stau observatiile
microscopice ale particulelor cu dimensiunea de ordinul nanometrilor
H. studiaza
materia prin metodele specifice mecanicii cuantice, corespunzatoare
particulelor atomice si subatomice, cu dimensiuni mai mici de 10-8cm
I. studiaza
materia cu ajutorul microscopului electronic
J.
studiaza materia prin metodele specifice
mecanicii cuantice, corespunzatoare particulelor atomice si
subatomice, cu dimensiuni mai mari de 10-8cm
22. Fortele Debye se manifesta intre:
A. doua molecule nepolare; B.
intre doua molecule polare; C). intre doi ioni de semn contrar; D. intre
doi ioni de acelasi semn; E. O molecula polara si o
molecula nepolara.
23. Care dintre conditiile de mai jos nu corespunde
starii de gaz perfect:
A.
diametrul moleculelor este mult mai mic decat distanta dintre molecule
B. intre
molecule se manifesta numai interactiuni slabe
C.
moleculele sunt considerate punctiforme, cu volume neglijabile
D.
presiunea gazului este f. Mica
E.
moleculele sunt intr-o continua miscare haotica
24. Despre temperatura este falsa
urmatoarea afirmatie:
A. este
o masura a energiei termice a unui corp
B. se
poate masura in grade Celsus, grade Kelvin si in alte scari de
temperatura
C. un
grad Kelvin este egal cu 273 grade Celsus
D. este
o masura a transferului de caldura de la un corp cald la un
corp rece
E.
un grad Kelvin este egal cu un grad Celsus
25. Intr-un vas cu volumul de 10 m3 se
afla un amestec de N2 si CH4 in raport molar de
1:4.
Cunoscand: AN = 14; AH = 1; AC
= 12; R = 0,082 l.atm/mol.K, procentul gravimetric al amestecului, este:
A.
30,43%N2 si 69,57% CH4; B. 24,36%N2
si 75,64% CH4; C. 33,43%N2 si 66,57% CH4;
D.
40,57%N2 si 59,43% CH4; E. 36,43%N2
si 63,57% CH4
26. Despre substantele amorfe este falsa
urmatoarea afirmatie:
A. au
particulele aranjate in mod dezordonat; B. au proprietati
anizometrice,
C.
nu au puncte de topire ca valori constante; D. prin incalzire se inmoaie
si curg; E. au proprietati izometrice
27. Nu este molecula nepolara:
A. iodul; B. Acidul maleic; C.
p-dihidroxibenzen; D. Dioxidul de carbon; E. etanul
28. Spectrele IR se datoreaza:
A.
miscarii de rotatie a moleculelor; B. miscarii de
rotatie-vibratie a moleculelor
C.
miscarii de rotatie a nucleului; D. miscarii de
rotatie a electronului
E.
saltului electronilor de pe nivelele exterioare
29. O portiune
din univers, marginita imaginar sau real, in interiorul careia
au loc transformari fizice si chimice, se numeste:
A. proces termodinamic; B. functie
termodinamica; C. sistem termodinamic; D. parametru termodinamic;
E.
variabila termodinamica.
30. Un sistem termodinamic poate fi separat de mediul
inconjurator prin:
A.
frontiera (suprafata)
adiabatica, care permite transferul de energie sub forma de
caldura;
B.
frontiera (suprafata) diatermica,
care nu permite transferul de energie sub forma de caldura;
C.
frontiera(suprafata) termoelestica,
care nu permite transferul de energie sub forma de lucru mecanic,
D.
frontiera(suprafata) diatermica
prin care se realizeaza transferul de caldura;
E.
frontiera(suprafata) curba, pe care
Psistem= Pmediu ext..
31. Sistemele termodinamice inchise sunt:
- sistemele care nu
schimba nici energie si nici masa cu mediul exterior;
- sistemele care
realizeaza numai schimb de masa cu mediul exterior;
- sistemele care
schimba numai energie cu mediul exterior;
- sistemele care nu
schimba energie sub forma de caldura cu mediul
exterior;
E.
sistemele la care proprietatile
sunt identice in orice element de volum din interiorul sau.
32. Trecerea unui sistem termodinamic dintr-o stare
initiala in starea finala, prin stari de echilibru, se numeste:
- functie
termodinamica de stare;
- functie
termodinamica de proces;
- proces termodinamic
ireversibil;
- proces termodinamic
reversibil;
- proces termodinamic
izocor.
33. Marimea termodinamica  , definita de relatia:
, definita de relatia:
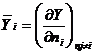 , se numeste:
, se numeste:
A.
marime termodinamica de exces; B. marime termodinamica de
amestecare; C. marime molara partiala;
D. marime molara aparenta; E. marime
molara relativa.
34. Energia interna cuprinde suma energiilor
caracteristice miscarilor de translatie, rotatie,
vibratie si a electronilor. Despre energia interna, U,
afirmatia corecta este:
- U, este o
marime termodinamica de proces si variaza cu
parametrii: T, p, ni ;
- U, este o marime
termodinamica de stare si variaza cu parametrii: T, p, ni
;
- U, este o
marime termodinamica de proces si variaza cu
parametrii: T, V, ni ;
- U, este o
marime termodinamica de stare si variaza cu
parametrii: T, V, ni ;
E.
U, este o marime
termodinamica intensiva.
35. Caldura necesara ridicarii
temperaturii unui gram de apa cu un
grad, in conditii de p = 1 atm si T= 288K, se numeste:
A.
calorie; B. joule; C. capacitate calorica; D. capacitate termica; E.
capacitate electrica.
36. Energia libera Helmholtz F a unui sistem
termodinamic se defineste prin relatia:
A. 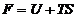 ; B.
; B. 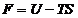 ; C.
; C. 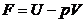 ; D.
; D. 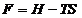 ; E.
; E. 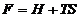 .
.
37. Entalpia libera molara partiala
in conditii izoterm-izobare si la compozitie constanta, se
numeste:
A.
afinitate chimica; b. activitate chimica; c. reactivitate
chimica; D. fugacitate; E. potential chimic.
38. O solutie care contine 10 g de
substanta X dezolvate in 100 g de apa fierbe la 100, 149 oC.
Stiind constanta ebulioscopica a
apei Ke(apa) = 0,51, masa moleculara a substantei X este:
A.
244 g/mol; B. 348 g/mol; C. 342 g/mol; D. 366 g/mol; E. 278 g/mol.
39. Trecerea unei substante din stare lichida
in stare de vapori are loc cu:
A.
crestere de entropie si eliberare de caldura; B. scadere de entropie si
eliberare de caldura;
C.
scadere de entropie si consum de caldura; D. crestere de entropie
si consum de caldura;
E.
fara modificare de entropie si caldura.
40. Un sistem
termodinamic bicomponent este:
A. univariant, daca contine o singura
faza;
B. bivariant, daca contine doua faze in
echilibru;
C. trivariant, daca contine trei faze in
echilibru;
D. invariant, daca contine trei faze in echilibru;
bivariant, daca
contine trei faze in echilibru.
41. Sistemele termodinamice izolate sunt:
- sistemele care
realizeaza numai schimb de masa cu mediul exterior;
- sistemele care
schimba numai energie cu mediul exterior;
- sistemele care nu
schimba nici energie si nici masa cu mediul exterior;
- sistemele care nu
schimba energie sub forma de caldura cu mediul
exterior;
- sistemele la care
proprietatile sunt identice in orice element de volum din
interiorul sau.
42. Care dintre conditiile de mai jos corespunde
starii de gaz perfect:
A. intre
molecule se exercita interactiuni hidrofobe
B. diametrul moleculelor este mult
mai mare decat distanta dintre molecule
C. intre
molecule se manifesta numai interactiuni slabe van der Waals
D.
moleculele sunt considerate punctiforme, cu volume neglijabile
E.
presiunea gazului este f. mare
41. Potentialul van der Waals (Uw),
manifestat intre doua molecule considerate in vid, este:
A. Uw
> 0; B. Uw < 0; C. Uw = 0; D. Depinde de concentratie; E. depinde de
presiune
42. Care dintre conditiile de mai jos corespunde
starii de gaz perfect:
A.
diametrul moleculelor este mult mai mare decat distanta dintre molecule
B. intre
molecule se manifesta numai interactiuni slabe van der Waals
C.
moleculele sunt considerate punctiforme, cu volume neglijabile
D.
presiunea gazului este f. mare
E. intre
molecule se exercita interactiuni hidrofobe
43. Care dintre grupurile de mai jos contin si
molecule intre care nu se manifesta legaturi de hidrogen:
A. apa,
acetat de etil; alcool etilic, dimetileter
B.
carbamazepina; apa; alcool etilic; acid acetic
C. -alanina; acid benzoic, alcool etilic;
γ-globulina
D.
γ-globulina; carbamazepina; glicerina; alcool benzilic
E. alcoolul
propilic; etilamina; alcoolul n-butilic; -alanina
44. Studiul gazelor reale se realizeaza cu ajutorul
ecuatiei:
A.
(P+a/V2)(V + b) = RT; B. (P+a/V2)V = RT; C. P(V - b) = RT; D. PV = RT; E. (P+a/V2)(V
- b) = RT
45. Intr-un vas cu volumul de 10 m3 se
afla un amestec de N2 si CH4 in raport molar de
1:4.
Cunoscand: AN = 14; AH = 1; AC
= 12; R = 0,082 l.atm/mol.K, presiunea totala a gazului , la temperatura
270C, daca amestecul contine 2 kmoli de azot, este:
A. 18,4
atm; B. 246 barr; C. 24,6 atm; D. 22,4 atm; E. 14,3 atm
46. Temperatura Boyle reprezinta:
A.
temperatura la care un gaz ideal se comporta ca un gaz real
B.
temperatura critica a unui gaz
C.
temperatura la care un gaz se afla in stare supercritica
D.
temperatura la care un gaz real se comporta ca un gaz ideal
E.
temperatura la care apare prima picatura de lichid in procesul de
lichefiere
47. Nu este molecula polara:
A. dioxidul de carbon; B. Acidul fumaric; C.
o-dihidroxibenzenul; D. Dioxidul de sulf; E. etanolul
48. Spectrele RMN se datoreaza:
A.
miscarii de rotatie a electronului
B.
saltului electronilor de pe nivelele exterioare
C.
miscarii de rotatie a moleculelor
D.
miscarii de rotatie a nucleului
E.
miscarii de rotatie-vibratie a moleculelor
49. Sistemele termodinamice izolate
sunt:
- sistemele care nu
schimba nici energie si nici masa cu mediul exterior;
- sistemele care
realizeaza numai schimb de masa cu mediul exterior;
- sistemele care
schimba numai energie cu mediul exterior;
- sistemele care nu
schimba energie sub forma de caldura cu mediul exterior;
- sistemele la care
proprietatile sunt identice in orice element de volum din
interiorul sau.
50. Procesele termodinamice care au loc cu cresterea
entropiei sunt:
A. procese reversibile; B. procese ireversibile; C.
procese quasistatice; D. procese izocore; E. procese izobare
51. Procesele termodinamice exoterme se
caracterizeaza prin:
A. au loc fara modificarea entalpiei libere; B. Sunt
favorizate de cresterea temperaturii; C. sunt favorizate de scaderea
temperaturii; D. Nu sunt influentate de temperatura; E. sunt favorizate de
cresterea presiunii.
52. Variabilele termodinamice care nu depind de
cantitatea de substanta, se numesc:
A.
functii omogene de gradul intai; B. variabile extensive; C. variabile
intensive; D. variabile independente,; E. variabile dependente.
53. Se numeste entalpie, functia
termodinamica de stare definita prin relatia:
A. ; B.
; B. ; C.
; C.  ; D.
; D. 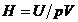 ; E.
; E. 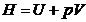 ;
;
54. Entropia
este:
A. O marime
termodinamica definita prin relatia: dS = dQ/dW
B. O
marime termodinamica ce exprima schimbul de lucru mecanic cu
exteriorul
C. O
marime termodinamica ce exprima gradul de ireversibilitate al
unui proces
D. O
marime termodinamica ce are ca unitate de masura Kj/mol
E. O
marime termodinamica definita prin relatia: S = Q/W
55. La p si T constante, criteriul de
spontaneitate este:
A. 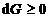 ; B.
; B. 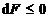 ; C.
; C.  ; D.
; D. 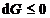 ; E.
; E. 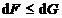 .
.
56. Stiind ca
presiunea de vapori a apei pure la fierbere este de 1 atm, presiunea de vapori
a unei solutii formate prin dizolvarea a 18 g glucoza in 180 g apa este:
A. 1,001
atm; B. 0,99atm; C. 1,01 atm; D. 9,9 atm; E. 1,1 atm
57. Un sistem termodinamic monocomponent este:
E. univariant, daca contine o singura
faza;
F. bivariant, daca contine doua faze in
echilibru;
G. trivariant, daca contine trei faze in
echilibru;
H. invariant, daca contine trei faze in
echilibru;
I. bivariant, daca contine trei faze in
echilibru.
58. Efectul hipsocrom, reprezinta:
A.
scaderea intensitatii absorbantei; B. cresterea intensitatii
absorbantei;
C.
deplasarea maximului de absorbtie spre lungimi de unda mai mari;
D.
deplasarea maximului de absorbtie spre lungimi de unda mai mici;
E.
scaderea intensitatii absorbantei si deplasarea maximului de
absorbtie spre lungimi de unda mai mari;
59. Despre substantele amorfe este falsa
urmatoarea afirmatie:
A. prin
incalzire se inmoaie si curg; B. au
particulele aranjate in mod dezordonat; C. au proprietati anizometrice; D. au
proprietati izometrice; E. nu au puncte de topire ca valori
constante;;
60. Temperatura maxima la care se poate masura presiunea vaporilor aflati
in echilibru cu lichidul se numeste:
A. Temperatura de fierbere; B. temperatura critica,; C. Temperatura de sublimare; D. Temperatura
de congelare; E. Temperatura de topire
61. Studiul gazelor reale se realizeaza cu ajutorul
ecuatiei:
A.
(P+a/V2)V = RT; B. P(V - b) =
RT; C. PV = RT; D. (P+a/V2)(V - b) = RT; E. (P+a/V2)(V +
b) = RT;
62. Intr-un vas cu volumul de 10 m3 se
afla un amestec de N2 si CH4 in raport molar de
1:4.
Cunoscand: AN = 14; AH = 1; AC
= 12; R = 0,082 l.atm/mol.K, presiunea totala a gazului , la temperatura
270C, daca amestecul contine 2 kmoli de azot, este:
A. 16,4
atm; B. 246 barr; C. 28,4 atm; D. 24,6 atm; E. 14,3 atm
63. Temperatura Boyle reprezinta:
A.
temperatura la care un gaz ideal se comporta ca un gaz real
B.
temperatura la care un gaz real se comporta ca un gaz ideal
C.
temperatura la care un gaz se afla in stare supercritica
D.
temperatura critica a unui gaz
E.
temperatura la care apare prima picatura de lichid in procesul de
lichefiere
64. Nu este molecula polara:
A. Etanolul, B. Acidul fumaric; C. dioxidul de carbon; D.
o-dihidroxibenzenul; E. Dioxidul de sulf;
65. Spectrele RMN se datoreaza:
A.
miscarii de rotatie a electronului
B.
saltului electronilor de pe nivelele exterioare
C.
miscarii de rotatie a moleculelor
D.
miscarii de rotatie-vibratie a moleculelor
E.
miscarii de rotatie a nucleului
66. Potentialul van der Waals (Uw),
manifestat intre doua molecule considerate in vid, este:
A. Uw
> 0; B. Uw = 0 ; C. Uw
< 0; D. Depinde de
concentratie; E. depinde de presiune
67. La V si T constante, criteriul de
spontaneitate este:
A. 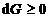 ; B.
; B. 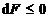 ; C.
; C.  ; D.
; D. 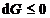 ; E.
; E. 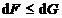
68. Procesele termodinamice exoterme se
caracterizeaza prin:
A. au loc fara modificarea entalpiei libere; B. Nu sunt
influentate de temperatura; C. Sunt
favorizate de cresterea temperaturii; C. sunt favorizate de scaderea
temperaturii; E. sunt favorizate de cresterea presiunii.
69. Care dintre grupurile de mai jos contin si
molecule intre care nu se manifesta legaturi de hidrogen:
A. γ-globulina; carbamazepina; glicerina;
alcool benzilic
B.
carbamazepina; apa; alcool etilic; acid acetic
C. -alanina; acid benzoic, alcool etilic;
γ-globulina
D. apa,
acetat de etil; alcool etilic, dimetileter
E. alcoolul
propilic; etilamina; alcoolul n-butilic; -alanina
70. Variabilele termodinamice care nu depind de
cantitatea de substanta, se numesc:
A.
functii omogene de gradul intai; B. variabile dependente. C. variabile
independente D. variabile extensive; E.
variabile intensive;
71. Se numeste entalpie, functia
termodinamica de stare definita prin relatia:
A. ; B.
; B. 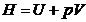 ; C.
; C.  ; D.
; D. 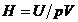 ; E.
; E.  ;
;
72. Entropia
este:
A. O marime
termodinamica definita prin relatia: dS = dQ/dW
B. O
marime termodinamica ce exprima schimbul de lucru mecanic cu
exteriorul
C. O
marime termodinamica definita prin relatia: S = Q/W
D. O
marime termodinamica ce are ca unitate de masura Kj/mol
E. O
marime termodinamica ce exprima gradul de ireversibilitate al
unui proces
73. Procesele termodinamice care au loc cu cresterea
entropiei sunt:
A. procese reversibile; B. procese quasistatice; C. procese ireversibile D. procese izocore; E.
procese izobare
74. Efectul hipocrom, reprezinta:
A.
scaderea intensitatii absorbantei; B.
Cresterea intensitatii absorbantei; C. deplasarea maximului de
absorbtie spre lungimi de unda mai mari, D. deplasarea maximului de absorbtie spre
lungimi de unda mai mici;
E. Scaderea intensitatii absorbantei si deplasarea
maximului de absorbtie spre lungimi de unda mai mari;
75. La presiunea de 1 atm, apa pura ingheata la 00C.
O solutie formata din 18 g de glucoza si 180 g de apa va ingheta la (Kc
= 1,86):
A. - 0,
10C; B. - 0,010C; B. - 0,1860C; D. - 0,01860C; E. - 1,860C
76. Substantele in moleculele carora exista atomi cu
electroni neimperecheati sunt:
A.
paramagnetice; B. diamagnetice; C. Feromagnetice; D. Nu au propietati
magnetice; E. sunt numai molecule polare;
77. Spectrele de rezonanta electronica de spin (
RES) se datoreaza:
A.
saltul electronilor de pe nivele interioare
B.
saltul electronilor de pe nivele exterioare
C.
miscarii de rotatie a electronilor;
D.
miscarii de rotatie a nucleelor
E.
saltul electronilor de tipul 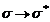
78. Este o marime termodinamica intensiva:
A.
entalpia; B. potentialul chimic, C. entalpia libera; D. Lucrul mecanic; E. energia
interna


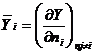 , se numeste:
, se numeste: