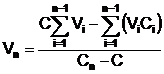NOTIUNI DE CHIMIE
masuri chimice, concentratia
solutiilor
1. Unitati de masura folosite in chimie.
Atomii si moleculele, fiind particule materiale, au
masa. Exprimarea maselor absolute
(in grame) este dificila pentru calcule, fapt pentru care in chimie s-a
recurs la exprimarea maselor relative (in unitati atomice de
masa - u.a.m.), care reprezinta a douasprezecea parte
din masa absoluta a izotopului 12C.
Se definesc astfel:
masa atomica (relativa) a unui
element chimic, ca raport intre masa absoluta a atomului respectiv si
a douasprezecea parte din masa absoluta a izotopului 12C;
masa moleculara (relativa) a unei
substante, ca raport intre masa absoluta a moleculei substantei
respective si a douasprezecea parte din masa izotopului 12C.
Practic, masa moleculara se calculeaza prin
sumarea maselor atomice ale atomilor din care se compune molecula
respectiva.
Pentru a exprima in grame cantitatile de
substante, se definesc:
atom-gram - ul unui element chimic,
care reprezinta cantitatea, exprimata in grame, numeric egala cu
masa atomica (relativa) a elementului respectiv;
molecula-gram (mol - ul) de substanta, care reprezinta cantitatea,
exprimata in grame, numeric egala cu masa moleculara
(relativa) a substantei
respective;
echivalent-gram -ul (val -ul) reprezinta cantitatea
dintr-o substanta, exprimata in grame, numeric egala cu
echivalentul chimic al substantei respective.
Echivalentul chimic (Ech).reprezinta
cantitatea dintr-un element, radical sau substanta, care se
combina / se substituie unui atom de hidrogen
In cazul reactiilor in care substantele
nu-si modifica valentele, echivalentii chimici se
calculeaza prin urmatoarele rapoarte:
pentru
elemente chimice  ;
;
pentru acizi  ,
,
prin bazicitatea
acidului intelegandu-se numarul protonilor H+
continuti de molecula acidului;
pentru baze 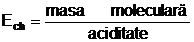 ,
,
prin aciditatea
bazei intelegandu-se numarul gruparilor oxidril (OH-)
continute de molecula bazei;
pentru
saruri 
Concentratia solutiilor
Concentratia
solutiei
reprezinta valoarea raportului intre numarul de parti de
solut si numarul de parti de solutie, uneori de
solvent.
In functie de necesitati,
partile pot fi exprimate in unitati de masa, de volum,
in moli sau vali, definindu-se corespunzator concentratiile
procentuala, molara, molala, valara.
Concentratia
procentuala (C%) exprima numarul de parti de
solut dizolvat in 100 parti de solutie, partile putand
fi exprimate in:
unitati
de masa (C% g/g);
unitati
de volum (C% v/v);
combinatii
de unitati (C% g/v ; C% v/g).
Ca varianta la concentratia procentuala,
cind valorile acesteia sunt prea mici se poate exprima concentratia promile
(C0/00).
Concentratia
molara (molaritatea) - Cm-
exprima numarul de moli de solut dizolvat intr-un litu (1000 ml) de
solutie.
Cand 1 litru de solutie contine 1 mol de solut,
solutia se numeste solutie molara,
concentratia ei notandu-se 'm' sau '1m'.
Submultiplii si multiplii molaritatii se
noteaza prin fractii zecimale (0,1m; 0,01m etc.) sau fractii
ordinare (m/10; m/100 etc.), respectiv 10m; 100m etc.
Concentratia
molala (molalitatea) - Cmolal-
exprima numarul de moli de solut dizolvat in 1000|g de solvent.
Concentratia
valara (normalitatea) -Cn- exprima
numarul de vali de solut dizolvat in 1000 ml de solutie.
Similar molaritatii, normalitatea se
noteaza 0,01n; 0,1n; 1n; 10n; 100n etc., solutia cu concentratia
1n numindu-se solutie normala.
In cadrul
lucrarii practice, pe baza datelor din tabelul 1., se vor efectua
calculele necesare completarii tabelului Elementele calculate vor fi folosite in
lucrarile urmatoare.
Tabelul 1.
|
Elem. chimic
|
H
|
C
|
O
|
Na
|
Mg
|
Cl
|
K
|
Ca
|
P
|
S
|
|
Valenta
|
|
|
|
|
|
|
|
|
|
|
|
Masa atomica
|
|
|
|
|
|
|
|
|
|
|
3. Calculul
concentratiei amestecurilor de solutii
Daca doua sau mai multe solutii ale
aceluiasi solut, dar cu concentratii diferite, se amesteca, se
va obtine o solutie cu concentratia cuprinsa intre valorile
concentratiile celor doua solutii amestecate.
Astfel, daca Vi si Cni sunt, respectiv volumele
si concentratiile solutiilor, concentratia rezultanta
C se calculeaza pe baza relatiei:
 ,
,
relatie care
rezulta din faptul ca fiecare solutie va introduce, in
solutia finala, o cantitate de solut corespunzatoare volumului
si concentratiei sale.
Relatia 5 poate fi aplicata pentru:
calculul
concentratiei ce rezulta prin amestecare,

calculul
volumului necesar dintr-o solutie (n), celelalte (n-1) volume fiind
impuse,

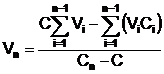
Tabelul
|
Nr. crt.
|
Solut
|
Masa moleculara (u.a.m.)
|
Echiva-
lent
chimic
|
Cantitate
|
CONCENTRATII
|
|
solut dizolvat
(g/l solutie)
|
procen- tuala
|
molari-tatea
|
normali-tatea
|
|
HCl
|
|
|
|
|
|
|
|
H2SO4
|
|
|
|
|
|
|
|
(COOH)2
|
|
|
|
|
|
|
|
H2O
|
|
|
|
|
|
|
|
NaOH
|
|
|
|
|
|
|
|
Ca (OH)2
|
|
|
|
|
|
|
|
CaCO3
|
|
|
|
|
|
|
|
CaSO4
|
|
|
|
|
|
|
|
CaCl2
|
|
|
|
|
|
|
|
MgCl2
|
|
|
|
|
|
|
|
Ca (HCO3)2
|
|
|
|
|
|
|
|
Mg (HCO3)2
|
|
|
|
|
|
|
|
Na2CO3
|
|
|
|
|
|
|
|
CaO
|
|
|
|
|
|
|