Metoda combustiei
Reactii
redox auto-propagate
In anul 1967, la Institutul de Chimie Fizica
al Academiei Uniunii Sovietice din Chernogolovka, un colectiv de
cercetatori aflat sub conducerea profesorului A.G. Merzhanov, din care mai
faceau parte I.P. Borovinskaya si V.M. Shkiro, in timp ce studiau
comportarea la incalzire a unor probe presate din diverse amestecuri de
pulberi metalice si bor, carbon respectiv siliciu, au descoperit
fenomenul SHS (Self-propagating
High-temperature Synthesis) [70,71]. Procesul care sta la baza
acestei noi metode de sinteza, a fost denumit initial 'Solid Flame Phenomenon' si inregistrat sub
titulatura de 'The Phenomenon of Wave Localization of Autoretarding
Solid-Phase Reactions'.
La originea acestei metode poate fi
considerata 'reactia termitului' descoperita
si patentata in 1895 de catre chimistul german Hans Goldschmidt.
In varianta simpla a acesteia, caldura eliberata din procesul
redox puternic exoterm era folosita
pentru topirea fierului si sudarea metalelor [72].
2Al+Fe2O3→Al2O2+2Fe
In faza incipienta a cercetarilor, o
terminologie frecvent utilizata pentru a
desemna metoda SHS, a fost 'metoda combustiei' ('Combustion
Synthesis' - CS). Ulterior, odata cu diversificarea conditiilor,
aplicatiilor si nu in ultimul rand, a gamei de sisteme in care se pot
desfasura reactii de combustie auto-propagate, a devenit
necesara realizarea unei diferentieri intre CS si SHS, care s-a materializat intr-o directie independenta
de cercetare.
In cadrul SHS, amestecul de materii prime este de cele mai multe ori peletizat iar declansarea procesului de
combustie se face prin initierea locala, de regula la
partea superioara a probei. Frontul de combustie se deplaseaza spre
partea inferioara a probei consumand amestecul de materii prime si
lasand in urma produsul de
reactie (fig. 2.7).
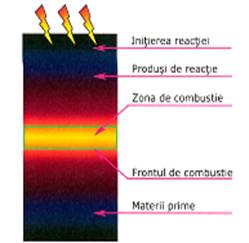
Fig.2.7 Reprezentarea schemica a unui proces
SHS
In prezent se cunosc cateva sute de reactii de
tipul SHS. Exista reactii de sinteza direct din elemente, situatie in care ambele, metalele
(Ti, Ta, Zr, Hf, W, Mo, etc.) si
nemetalele (B, C, Si, N, H, etc.) se folosesc ca reactanti, precum si
cazuri in care reactiile au loc
in sisteme de tip multi-componente, unde reactiile se
desfasoara intre compusi chimici si elemente native [73]
In anii care au urmat, echipa de cercetatori
a profesorului Merzhanov s-a ocupat cu elucidarea
fenomenelor care au loc in procesele de tip
SHS, dezvoltand totodata mai multe
tehnici si echipamente necesare implementarii acestora la scara industriala, fiind
obtinute primele piese cu geometrie precisa si acoperiri cu diferite grosimi.
Ordonand intr-o maniera cronologica evolutia
cercetarilor din cadrul SHS se disting urmatoarele etape:
1967 descoperirea proceselor de tip SF si SHS
in vid, atmosfera inerta sau in mediul cu reactant gazos.
adaptarea proceselor SHS in atmosfera reducatoare, realizarea unor
straturi de acoperire prin metoda SHS, combinarea proceselor SHS cu procedee de
turnare-centrifugare.
1976 sudarea materialelor refractare prin SHS.
1978 combinarea proceselor SHS cu sintetizarea la
inalta presiune ( Pgaz >108 Pa).
1980 combinarea proceselor SHS cu aplicarea unor
unde de soc.
1981 combinarea proceselor SHS cu fasonarea prin
extrudare.
1986 combina proceselor SHS cu utilizarea unui
mediu gazos ca vector de transport.
Anul 1988 a marcat un punct de cotitura in metoda
combustiei,datorita aparitiei unei noi variante, in care combustibilul sau
agentul reducator un compus organic iar agentul reducator este un compus
organic iar agntul oxidant este reprezentat de azotati ai metalelor dorite. La fel ca si in cazul SHS, si
aceasta a fost rezultatul unei descoperiri accidentale,
al carui protagonist a fost K.C. Patil, din India [74].
In principiu,
aceasta noua varianta presupune desfasurarea unei
reactii redox puternic exoterme intre un agent oxidant, reprezentat cel
mai adesea de azotati ai
metalelor dorite si diversi agenti reducatori, sau
combustibili de natura organica.
Initierea procesului de combustie se realizeaza de regula prin incalzirea rapida a solutiei
continand amestecul de materii prime la temperaturi relativ joase, sub 500°C, de unde si numele
dat acestei variante LCS (Low-temperature
Combustion Synthesis). Caracterul puternic exoterm al reactiei asigura pe de-o parte evolutia acesteia
in varianta auto-propagata [75,76], iar pe de alta parte, datorita temperaturii ridicate care se atinge
in sistemul reactant, peste 1.000
°C, favorizeaza formarea compusului dorit.
Lasand la o parte
caracterul extrem de spectaculos, specific metodei combustiei, este de remarcat
faptul ca intervalul de timp dintre initierea reactiei de
combustie si respectiv finalizarea acesteia este de numai cateva secunde.
O modalitate extrem de
sugestiva de a reprezenta schematic aceasta varianta a metodei
combustiei o constituie triunghiul
focului [77], prezentat in fig. 2.8
Fig.2.8Triunghiul
focului
In colturile
acestuia se afla cele trei elemente esentiale, necesare pentru desfasurarea
oricarui proces de combustie: combustibilul sau agentul reducator, agentul oxidant si
o sursa de energie, cel mai frecvent energie termica, menita sa asigure
initierea reactiei. Elementele principale care se formeaza in
urma reactiei de combustie sunt: caldura, incandescenta sau radiatia luminoasa (flacari)
si cenusa sau reziduul, care reprezinta de fapt produsul dorit.
Pentru a evita pe cat posibil aparitia unor
confuzii intre SHS si varianta mai
recent descoperita, LCS, in care se utilizeaza azotati metalici
si combustibili organici,
s-a pus problema diferentierii lor. In aceasta directie, cel mai
uzual criteriu luat in discutie pentru a face aceasta departajare a
fost cel al temperaturii de
initiere, adica temperatura minima la care reactia
odata declansata
evolueaza intr-o maniera auto-propagata. Conform acestui
criteriu in cadrul metodei
combustiei se disting doua directii majore: SHS si LCS.
In cazul sintezei de temperatura ridicata prin reactii
auto-propagate, SHS, temperatura de
initiere are valori destul de ridicate, de regula peste 1.000 °C, iar temperatura maxima, reala, care
poate fi atinsa in timpul combustiei, inregistreaza valori de
pana la 3.800°C[70]. In varianta sintezei prin metoda combustiei la temperaturi joase, LCS, temperatura
de initiere are valori relativ scazute, de cele mai multe ori sub 500
°C, iar temperatura maxima, reala, care poate fi atinsa in timpul combustiei rar
depaseste 1600°C [75,78].
In plus, un alt criteriu, destul de frecvent
utilizat pentru a face distinctie intre multiplele variante ale proceselor LCS, este cel al naturii sau al
starii de agregare a amestecului
de reactanti din momentul initierii reactiei de combustie, in functie de acest criteriu se disting trei
versiuni ale LCS: solution combustion synthesis (SCS), gel combustion synthesis (GCS) si respectiv emulsion combustion synthesis (ECS).
In functie de modul in care decurge procesul de combustie, respectiv
in functie de viteza de propagare a
interfetei de reactie exista
trei situatii
Arderea inabusita sau ardere mocnita, cand amestecul reactant ajunge cel mult la incandescenta iar
fenomenul de aparitie al flacarilor este practic inexistent. Rareori temperatura atinge 1.000 °C viteza de deplasare a frontului de combustie este
mica iar reactia dureaza
cateva minute.
Arderea cu prezenta flacarilor cand
temperatura maxima poate atinge valori de pana la 1.500-1.600°C. In
acest caz se poate observa cu
usurinta initierea locala si ulterior propagarea
frontului de combustie, reprezentat de o zona puternic
incandescenta care strabate intreg amestecul reactant realizand
conversia acestuia in produsi de reactie, situatie comparabila cu varianta SHS. Asa se
explica faptul ca. de multe ori in literatura de specialitate,
acest caz particular al variantei LCS este incorect declarat ca fiind SHS, prin
aceasta facand aluzie exclusiv la fenomenul de aparitie si
deplasare vizibila a
interfetei de reactie. Viteza de propagare a frontului de combustie
este de ordinul cm/sec, reactia este insotita de aparitia vizibila a flacarilor iar
transformarea reactantilor in produsi de reactie necesita
cateva secunde.
Explozie se manifesta mai ales
atunci cand se opereaza cu viteze mari
de incalzire, in aceasta situatie
nu se poate vizualiza cu ochiul liber
aparitia frontului de combustie
deoarece, spre deosebire de cazurile precedente,
reactia se declanseaza simultan in intreg volumul amestecului de
materii prime. Acesta este motivul pentru care acest caz particular al LCS este
cunoscut sub numele de volume
combustion synthesis,VCS, sau combustie in volum. Procesul decurge foarte repede, energic si
violent, masuratorile utilizate
punand in evidenta viteze de deplasare ale frontului de
combustie de pana la 8000 m/s. Datorita cresterii foarte rapide
a temperaturii si presiunii o alta denumire frecvent utilizata
pentru a desemna acest regim al reactiei este cel de explozie termica
Un element foarte important in clasificarea reactiilor redox auto-propagate este viteza cu care acestea se
desfasoara. Din acest punct de vedere se disting patru tipuri de
reactii [81]:
reactii
de imbatranire;
reactii
de combustie;
reactii
de explozie prin deflagratie:
reactii
de explozie prin detonare.
Reactii de imbatranire. Reactii de
combustie
In general, reactiile de imbatranire se produc chiar la temperatura ambianta si se caracterizeaza prin
viteze foarte mici de reactie, astfel ca, pentru a atinge un grad de transformare integral timpul necesar este de ordinul anilor. Datorita
vitezelor foarte mici de desfasurare, in cele mai multe cazuri, in
urma unui simplu control vizual nu pot fi observate modificari evidente
ale probei, conversia avand valori foarte
scazute
Din punct de vedere fenomenologic, aceste reactii, ca si restul
reactiilor auto-propagate de altfel, au drept consecinte eliberarea
de energie, modificari ale
proprietatilor mecanice si degajarea in timp a unor mari
cantitati de gaze.
In anumite conditii, auto-incalzirea
probei datorita exotermicitatii reactiei
propriu-zise poate determina modificarea regimului de reactie, cu tranzitia acestuia dintr-o reactie
lenta, de imbatranire, intr-o reactie de combustie, care decurge mult mai repede. In acest
sens, un rol foarte important revine principalelor caracteristici ale probei
care influenteaza transferul termic [81]: viteza de generare a
caldurii, caldura specifica, conductivitatea termica,
dimensiunea probei etc. In cazul amestecurilor pirotehnice, principalii factori
responsabili pentru reactiile de imbatranire sunt temperatura si
umiditatea, deoarece in aceste conditii agentii reducatori care
se folosesc, de exemplu Mg sau Ti, participa la o serie de reactii
concurente, rezultatul final fiind alterarea stoechiomctriei
amestecului reactant si diminuarea efectului scontat.
Urmatorul tip de reactii auto-propagate,
care se deosebesc de reactiile de imbatranire prin faptul ca
viteza de reactie este cu cateva ordine de marime mai ridicata, sunt reactiile de combustie. Specific acestor
reactii sunt deplasari ale frontului
de combustie cu viteze de pana la cativa
metrii pe secunda [81].
O conditie esentiala pentru ca o reactie de combustie
sa poata avea loc este ca amestecul de reactanti sa fie
incalzit cu o viteza corespunzatoare la o temperatura cel
putin egala cu temperatura la care reactia respectiva
devine auto-propagata. Aceasta temperatura minima la care
reactia odata declansata evolueaza
in varianta auto-propagata se numeste temperatura de
initiere, Ti. In principiu,
combustia presupune desfasurarea
unor interactiuni chimice cu caracter
puternic exoterm, energia necesara avansarii procesului fiind
asigurata de reactia in
sine.
Datorita caldurii degajate, gazelor fierbinti si
particulelor foarte fine care rezulta
in prima faza a reactiei, in multe cazuri reactia evolueaza
si in faza gazoasa,
fiind de multe ori insotita de emisii de radiatii in domeniul
vizibil si nu numai. Desi
la o prima vedere aceasta afirmatie pare oarecum ciudata,
ea este usor de inteles daca se tine cont de dimensiunile mici ale particulelor
rezultate precum si de probabilitatea ridicata ca aceste particule
sa fie antrenate in gazele care rezulta din abundenta, in
functie de modul in care se realizeaza transferul de caldura dinspre zona unde are loc
reactia si regiunile mai reci ale probei se disting doua situatii extreme [81]:
transferul
termic se realizeaza prin conductie;
transferul termic este unul de tip convectiv.
Transferul de caldura prin conductie
depinde la randul lui de o serie de factori,
dupa cum s-a aratat deja in cazul reactiilor de
imbatranire, incercarile de modelare ale acestui
tip de reactii trebuie sa tina cont de faptul ca in
urma frontului de combustie se produc
modificari importante ale acestor parametrii, care nu sunt deloc de neglijat. Odata
initiata, reactia de combustie din amestecul de
reactanti se produce din aproape in aproape, strat dupa strat,
similar unei unde care se propaga cu
viteza constanta sau variabila. Aceasta regiune care se deplaseaza si in care are loc
reactia propriu-zisa este frecvent denumita front de combustie si ea este zona cu cea mai
ridicata temperatura. Pe masura ce creste distanta de la frontul de combustie se
inregistreaza o scadere a temperaturii.
Viteza de deplasare a frontului de combustie este
dictata pe de-o parte de
viteza de generare a caldurii ca urmare a reactiei exoterme dintre
reactanti iar pe alta parte
de eficienta transferului de caldura dinspre regiunea frontului
de combustie catre zona imediat
urmatoare din amestecul de materii prime care trebuie sa atinga, eventual sa
depaseasca valoarea temperaturii de initiere, un rol foarte important revenind pierderilor de
caldura. Daca creste presiunea din jurul amestecului de materii prime si daca gazele fierbinti nu au
posibilitatea de a parasi
sistemul reactant atunci transferul de caldura este mult mai eficient
iar viteza procesului de combustie exprimata prin distanta
liniara parcursa de frontul de
combustie in unitatea de timp este sensibil mai mare.
Situatia este cu totul alta atunci cand
transferul de caldura se realizeaza preponderent
prin convectie. Acest tip de reactii este mult mai dificil de controlat deoarece aceste fenomene au loc intre
particule cu valente explozive si care reactioneaza
foarte repede, in plus, mai intervin porii prezenti care modifica suprafata specifica astfel
incat este practic imposibil de descris prin ecuatii matematice transferul termic prin convectie. Daca
amestecul de reactanti are un potential exploziv ridicat
si se afla in stare fin dispersa, datorita suprafetei specifice foarte mari exista
pericolul ca reactia de combustie sa treaca intr-un alt stadiu:
cel al exploziilor.
Reactii de explozie prin
deflagratie/detonatie
In cazul exploziilor prin deflagratie, viteza
de deplasare a interfetei de reactie
inregistreaza valori de cateva
sute de metrii pe secunda. Aceste reactii fac de fapt trecerea de la reactiile de combustie la cele mai violente
reactii: exploziile prin detonare [81].
In anumite conditii termodinamice si cinetice, legate in
principal de potentialul exploziv
(factorul termodinamic) si suprafata specifica a amestecului reactant (factorul cinetic), o
reactie de combustie poate evolua sub forma unei explozii prin
deflagratie. In acest caz, viteza de deplasare a interfetei de
reactie poate atinge uneori chiar viteza sunetului specifica
materialului respectiv. Mecanismul prin care se produce aceasta schimbare
radicala a regimului dupa care are loc reactia nu este unul
dintre cele mai simple, dar in principal el consta in aparitia in
sistemul reactant a unor unde de soc care strabat amestecul de reactie.
Reactiile care decurg prin explozie cu deflagratie sunt foarte
dificil de controlat deoarece, din punct de
vedere fizic, aceste reactii sunt instabile. Exista astfel doua variante:
in prima varianta, este
posibil ca reactia sa fie accelerata la viteze supersonice, aceasta degenerand intr-o explozie
prin detonare;
in varianta a doua,
exista posibilitatea ca viteza de reactie sa scada suficient de mult astfel incat sistemul sa revina la stadiul unei
reactii de combustie.
Asa dupa cum nu orice reactie chimica poate evolua in
maniera auto-propagata, tot asa nu orice reactie
auto-propagata poate ajunge in stadiul de explozie prin detonare, modul in care se va comporta fiecare amestec de
materii prime depinzand in primul rand de factorii termodinamici
(potentialul exploziv) si cinetici (suprafata
specifica).
Spre deosebire de reactiile de combustie si cele de tipul
exploziilor prin deflagratie, care au la baza initierii si
propagarii reactiei fenomene de transfer termic, reactiile de
explozie prin detonare au ca principiu de initiere si ulterior
propagare aparitia si deplasarea cu viteze supersonice a unei unde de
soc. In consecinta, reactiile de explozie prin detonare
sunt cele mai rapide reactii, viteza de deplasare a interfetei de
reactie fiind de ordinul miilor
de metrii pe secunda. Pana in prezent, cea mai mare viteza
masurata a fost de 9.280 m/s [81].
Pentru o detonatie stabila, viteza acestei unde de
soc corespunde unui regim stationar, in care energia consumata
ca urmare a atenuarii undei de soc este
compensata de energia eliberata din reactia chimica.
Cantitatea de energie disponibila
pentru a asigura propagarea undei de soc depinde foarte mult de viteza de
reactie a amestecului reactant. Astfel, s-a constatat ca numai energia
eliberata dupa cel mult 0.1 μs de la trecerea undei de soc
contribuie efectiv la viteza procesului de detonare. La randul ei, viteza de
reactie in sine depinde intr-o
masura decisiva de omogenitatea chimica a sistemului de
reactie. Cu cat sistemul este mai eterogen eu atat viteza de
reactie este mai mica si o cantitate mai mare de energie se pierde datorita atenuarii undei de
soc,
Deoarece viteza sunetului pentru un anumit material depinde foarte mult de densitatea acestuia, este de inteles
ca densitatea amestecului de materii prime joaca un rol important in
ceea ce priveste viteza de deplasare a undei de soc. De aceea,
substantele explozive caracterizate prin viteze mari de deplasare ale undei de soc trebuie sa fie cat mai
bine omogenizate iar valorile densitatii si ale entalpiei de reactie trebuie atent optimizate
[82].
In concluzie, analogia proceselor care au loc in cadrul unei reactii
de combustie auto-propagate cu comportarea
amestecurilor pirotehnice, propelantilor sau explozibililor nu este
deloc exagerata si nici intamplatoare daca se au in vedere similitudinile frapante care exista
intre comportarea acestor amestecuri. Dupa cum s-a aratat
deja, in cazul tuturor substantelor cu caracter exploziv, indiferent
daca este vorba de explozibili propriu-zisi, propelanti sau
amestecuri pirotehnice, natura reactiei chimice care sta la baza
utilizarii acestor compusi este riguros aceeasi, fiind vorba
despre reactii redox, puternic
exoterme, care asigura
desfasurarea proceselor si fenomenelor in maniera auto-propagata [80,82].
Factori
care influenteaza reactiile de combustie
Obtinerea unor nano-pulberi cu reactivitate
ridicata prin metoda combustiei presupune
stabilirea in prealabil a conditiilor optime de lucru. Aceasta
implica la randul ei parcurgerea mai multor etape, la finalul carora
se vor putea alege acele valori ale principalilor parametrii de operare, care
sa permita obtinerea
produsului de reactie cu caracteristicile si proprietatile
dorite.
In acest sens, sunt vizate in principal: puritatea, gradul de
cristalinitate, forma si dimensiunea
granulelor, suprafata specifica, distributia granulometrica
si nu in ultimul rand reactivitatea pulberii obtinute.
Cercetarile efectuate in ultimii ani au scos in evidenta faptul
ca reactiile de tipul combustiei auto-propagate sunt procese complexe, care depind de o serie de factori.
De alt fel, interesul crescut pentru aceasta metoda
neconventionala de sinteza
se datoreaza in mare parte gamei
diversificate de variabile prin intermediul
carora procesele de combustie pot fi conduse si dirijate astfel
incat caracteristicile produsului de reactie obtinut prin
aceasta metoda se pot regla in limite largi. Din multitudinea acestor parametrii care, intr-un
fel sau altul, isi exercita
influenta asupra unei reactii de combustie, un loc aparte il
ocupa
natura
agentului oxidant si a combustibilului;
raportul
molar combustibil/oxidant;
prezenta
unor adaosuri, de tipul NH4NO3 sau NH4CH3COO;
temperatura
de initiere si viteza de incalzire;
volumul
amestecului de materii prime;
cantitatea
de solvent (apa) din amestecul de materii prime;
presiunea.
Cunoasterea modului in care toti
acesti factori influenteaza desfasurarea proceselor de combustie si nu in ultimul rand caracteristicile
produsului finit este de cea mai mare importanta si
reprezinta punctul de plecare in etapa de optimizare. De exemplu, prin
temperatura mai scazuta sau mai ridicata din timpul reactiei,
care depinde in primul rand de tipul combustibilului utilizat, de raportul
combustibil/oxidant si de prezenta unor eventuale adaosuri, se poate
actiona atat asupra gradului de cristalinitate al produsului, putandu-se
obtine compusi in stare amorfa sau compusi cristalini, cat
si asupra dimensiunii granulelor. In plus, prin cantitatea mai mica
sau mai mare de gaze care se degaja in
timpul combustiei se poate interveni asupra dimensiunii si morfologiei granulelor produsului de
reactie.
In general, un volum mai mare de gaze degajate, combinat cu o
temperatura mai joasa, are ca rezultat obtinerea unor particule
mai fine, cu dimensiuni nanometrice, a
caror reactivitate este pusa in valoare in procesele de sinterizare si recristalizare care au loc in
vederea obtinerii unor piese cu forma, dimensiuni si proprietati bine definite.
Kingsley si Patil [85] au atras atentia asupra importantei
pierderilor de caldura, care depind in mare masura de raportul
dintre cantitatea de amestec reactant
si volumul recipientului in care are loc reactia. La randul lor, Mukasyan
[86] si colaboratorii sai au aratat ca temperatura
maxima atinsa in timpul reactiei si durata reactiei
sunt doua elemente cheie care controleaza proprietatile pulberii rezultate, in special caracterul amorf
sau cristalin si dimensiunea granulelor produsului de reactie.
Stabilirea celor mai favorabile conditii
de sinteza in vederea obtinerii
compusului dorit se face experimental, deoarece
aceste conditii difera de la un caz la altul.
Natura combustibilului
Daca in privinta alegerii agentului
oxidant nu se pun probleme deosebite, in majoritatea
cazurilor utilizandu-se azotatii metalelor dorite, nu acelasi lucru se poate spune si in
cazul agentului reducator. In conditiile in care combustibilul
este cel care determina pe de-o parte temperatura maxima atinsa in timpul combustiei iar pe de alta parte
volumul de gaze degajate, este evident ca alegerea
rationala a unui anumit tip de combustibil reprezinta o
problema foarte serioasa.
Caracterul de maxima importanta care revine alegerii combustibilului
reiese si din faptul ca, utilizand diversi combustibili in
sinteza unuia si aceluiasi compus
se poate actiona atat asupra gradului de cristalinitate, cat si
asupra dimensiunii granulelor rezultate, in general, un bun combustibil trebuie sa indeplineasca
urmatoarele cerinte [83,87,89]:
sa
prezinte caracter reducator;
sa
nu reactioneze violent;
sa
nu genereze gaze toxice;
sa
actioneze ca agent de chelatizare in raport cu cationii metalici.
Aceasta ultima conditie, de a forma combinatii complexe
cu cationii metalici, este impusa din
considerente de omogenitate, special pentru a preveni fenomenul de
dezamestecare, datorat cristalizarii individuale a componentilor din
amestec in faza de eliminare a solventului, fiind bine cunoscut faptul ca
formarea unor combinatii complexe ale cationilor metalici contribuie la
cresterea solubilitatii acestora [89,90]. Din acest punct de
vedere, glicina, si aminoacizii in
general, se evidentiaza prin usurinta cu care formeaza
combinatii complexe cu diversi cationi metalici.
Stabilirea raportului combustibil/agent oxidant
Dupa alegerea agentului oxidant si a combustibilul,
urmatoarea etapa o reprezinta
stabilirea stoechiometriei reactiei de combustie dintre azotatii metalelor
dorite si agentul reducator, stoechiometrie care sta la baza
dozarii efective a reactantilor.
La fel ca si in cazul amestecurilor pirotehnice, propelantilor
si explozibililor, stabilirea raportului stoechiometrie sau a
echivalentei dintre componenta oxidanta si cea reducatoare
este de o importanta decisiva
si in metoda combustiei.
Rolul hotarator al stoechiometriei reactiei este ilustrat nu doar
prin faptul ca o serie de reactii chimice de
tipul combustiei practic nu au loc daca nu este respectat acest
raport optim dintre reactanti, ci si prin impactul pe care
stoechiometria utilizata il are
asupra caracteristicilor produsului de reactie, in special asupra dimensiunii granulelor [91,92].
Egalarea unei reactii de combustie presupune initial stabilirea proceselor
de oxidare si de reducere care au loc in sistemul reactant,
echilibrarea balantei electronice iar in cele din urma stabilirea
bilantului de masa. Indiferent de azotatul metalic care se
foloseste, procesul de reducere a N5+ din azotati este acelasi
In cazul combustibililor care contin N-3,
asa cum este cazul ureei, glicinei, alaninei sau altor compusi,
oxidarea N-3 la N0 se realizeaza conform ecuatiei
N-3
→ N0 + 3e-
Situatia
se complica putin in cazul combustibililor care isi
manifesta caracterul reducator nu
doar prin N-3 (cazul ureei), ci si prin carbonul aflat la o cifra de oxidare diferita de +4 (C+1
- glicina, C0 - alanina), procesele de oxidare fiind descrise de relatiile:
Glicerina : C+1 → C+4 +
3e-
Alanina :
C0 → C+4 + 4e-
Raportul molar azotat metalic/combustibil
In proiectarea sau elaborarea retetelor avand ca principal scop
sinteza prin metoda combustiei a unui anumit compus chimic, o foarte mare
atentie trebuie acordata nu doar alegerii materiilor prime adecvate
ci si stabilirii raportului molar
optim dintre combustibil si agentul oxidant. In aceste conditii, un
rol fundamental revine determinarii si respectiv optimizarii
raportului molar dintre componenta oxidanta si cea
reducatoare. Referitor la modul in care raportul
molar combustibil/oxidant influenteaza temperatura maxima din sistemul
reactant (temperatura de combustie, Tc), la ora actuala in
literatura de specialitate nu exista un
consens, parerile fiind impartite.
Autori ca Jung [93] sau McKittrick [83] declara ca temperatura
din amestecul de reactie este cu atat mai ridicata cu cat valoarea
raportului molar combustibil/oxidant este mai mare, argumentand prin faptul
ca utilizarea unei cantitati mai mari de combustibil atrage
dupa sine cresterea temperaturii de combustie dezvoltata in
timpul reactiei. Conform acestor autori, ar exista o relatie de
directa proportionalitate intre valoarea raportului molar combustibil/oxidant si temperatura din
sistemul reactant.
De cealalta parte a taberei se situeaza autori precum Mimani [77],
Segadaes [94], Aruna [95] sau Jayalakshmi [96]
care sustin ca energia eliberata intr-un proces de
combustie este maxima pentru un raport molar combustibil/oxidant
corespunzator celui stoechiometric, φ. Cu alte cuvinte, temperatura maxima care se poate atinge in
cursul unei reactii de combustie, Tc, corespunde utilizarii unor retete in
care combustibilul si agentul oxidant se afla in raport molar
riguros stoechiometric. Prin urmare, intre temperatura din amestecul de reactie si raportul molar
combustibil/oxidant nu exista o dependenta proportionala, ci una
parabolica (fig. 2.9).
 Fig. 2.9 Variatia temperaturii de combustie cu
raportul molar combustibil/oxidant
Fig. 2.9 Variatia temperaturii de combustie cu
raportul molar combustibil/oxidant
Prezenta unor adaosuri cu rol auxiliar
De multe ori pentru a obtine produsul de reactie dorit, cu
anumite caracteristici, se utilizeaza
un amestec de combustibili sau/si se practica introducerea unor adaosuri in sistemul reactant.
Prin intermediul acestor adaosuri
operatorul poate actiona asupra diversilor parametrii:
viteza
de reactie;
cantitatea
de gaze de combustie;
temperatura
din sistemul reactant;
continutul
de carbon rezidual;
dimensiunea
granulelor rezultate.
O problema de mare importanta in cazul utilizarii combustibililor care contin
carbon la o alta cifra de oxidare decat cea maxima, +4,
(glicina, alanina, acid citric, etc.) o reprezinta impurificarea
produsului de reactie cu carbon rezidual, provenit din degradarea
partiala a acestora [83,97,98,100,101].
O solutie la aceasta problema o
reprezinta introducerea in amestecul de materii prime a unor adaosuri, care prin descompunere
sa asigure un surplus de oxigen, pentru oxidarea integrala, sau cat
mai avansata a carbonului rezidual. In aceasta directie, cel mai des utilizat furnizor
de oxigen este NH4NO3 (azotatul de amoniu), care nu este un combustibil in sine,
dimpotriva, este un slab agent oxidant [101,102,103]. Prin
incalzire rapida la temperaturi mai mari de 170 °C acesta se
descompune cu explozie in apa, azot si oxigen, conform reactiei.
De altfel, pe langa utilizarea sa ca ingrasamant, cea mai
cunoscuta aplicatie a azotatului
de amoniu vizeaza obtinerea explozibililor si a amestecurilor pirotehnice.
NH4NO3 → 2H2O
+ N2 + 1/2O2;
In procesele de combustie, in special atunci cand
se lucreaza cu un exces de
combustibil (care contine carbon la o cifra de oxidare diferita
de +4), deci in absenta unei cantitati
stoechiometrice de agent oxidant - in particular azotati metalici, prin
cantitatea de oxigen pe care o elibereaza in urma descompunerii sale,
azotatul de amoniu poate asigura oxidarea surplusului de combustibil, evitand astfel impurificarea produsului de
reactie cu carbon rezidual.
Desi prezenta carbonului rezidual este cea mai importanta
problema pentru a carei rezolvare se recurge la introducerea unor
adaosuri auxiliare in amestecul de materii
prime, ea nu este singura. Astfel, in unele cazuri, asa cum se
intampla, de exemplu, la obtinerea prin metoda combustiei a
tialitului, TiO2 ∙ Al2O3, pornind de la
azotatii respectivi si uree, in ciuda exotermicitatii
ridicate a reactiei de combustie, temperatura maxima care se
dezvolta in sistemul reactant este insuficienta pentru a asigura
formarea titanatului de aluminiu, in
aceasta situatie se doreste ridicarea temperaturii din amestecul
de reactie pentru a asigura formarea fazei dorite. Prin introducerea unor
adaosuri controlate de NH4NO3
reactia devine mai energica, temperatura maxima
atinsa in amestecul de materii prime creste suficient de mult
astfel incat formarea Al2TiO5
decurge fara probleme [100].
Nu de fiecare data insa, se doreste
ridicarea temperaturii din amestecul de reactie,
stiut fiind faptul ca in conditii de temperatura
ridicata, suprafata specifica
a pulberilor rezultate scade ca urmare a proceselor de recristalizare, crestere a granulelor si sinterizare.
De exemplu, in sinteza unor materiale nano-compozite de tipul Al2O3-ZrO2
folosirea ureei pe post de combustibil conduce la obtinerea unor
pulberi cu suprafata specifica de 2.6 m2/g si granule
cu dimensiuni de 37 nm [101]. Prin utilizarea unui amestec de combustibili
si introducerea unor adaosuri suplimentare de acetat de amoniu si
azotat de amoniu se obtin pulberi cu
suprafata specifica de 7.7 m2/g si granule de 9
nm [101]. Aceasta diferenta este justificata prin
folosirea acestui amestec de combustibili,
dar mai ales prin introducerea acetatului de amoniu in amestecul de
materii prime, menit sa reduca exotermicitatea procesului si
deci sa contribuie la scaderea
temperaturii.
Temperatura de initiere a reactiei
Influenta temperaturii de initiere este scoasa in
evidenta de faptul ca alaturi de combustibil si
agentul oxidant, aceasta constituie unul din cele trei elemente indispensabile unei reactii de combustie fig 2.8. Cu toate acestea, in cadrul metodei combustiei se opereaza curent
cu trei temperaturi importante:
temperatura
adiabatica, Tad;
temperatura
de combustie, Tc;
temperatura
de initiere, Ti.
Relatia dintre cele trei temperaturi este
descrisa de inegalitatea:
Tad >Tc >>Ti
Temperatura adiabatica, Tad, reprezinta temperatura
maxima care se poate atinge in
timpul reactiei de combustie, daca aceasta s-ar desfasura
in conditii adiabatice,
fara pierderi de caldura. Utilizarea acestei temperaturi
este in directa legatura
cu regula empirica, potrivit careia o reactie chimica
exoterma poate evolua in
maniera auto-propagata numai daca temperatura adiabatica corespunzatoare reactiei respective
depaseste 1.800 K.
Se poate afirma ca, intr-adevar o
reactie auto-propagata este in mod obligatoriu si una exoterma, in schimb
reciproca nu este valabila si nu are acoperire in practica, Tad
este criteriul utilizat la unison
pentru aprecierea teoretica a posibilitatii de
desfasurare a reactiilor
de combustie in varianta auto-propagata. Pentru o reactie
chimica data, temperatura
adiabatica se poate calcula cu ajutorul relatiei cunoscand
caracteristicile fizice si termodinamice ale reactantilor si
produsilor de reactie [83,87]:
Δr
H0298 = 
unde ΔrH0298
reprezinta entalpia
standard de reactie, vi este numarul de moli din compusul
i, iar cp este capacitatea calorica la presiune constanta
a produsului de reactie i.
Cu toate acestea, in literatura se
utilizeaza o varianta simplificata (2.51):
ΔHf,r - ΔHf,p
 Tad = 298 +
Tad = 298 +
cp
unde Hf,r si Hf,p reprezinta
entalpiile de formare ale reactantilor si produsilor de reactie, iar cp
este suma capacitatilor calorice la presiune constanta ale produsilor de
reactie.
Temperatura adiabatica este o temperatura pur teoretica,
care in practica nu poate fi atinsa. Motivul il constituie pierderile
de caldura prin convectie
si radiatie, combustia partiala si/sau
desfasurarea unor reactii concurente. Asa se explica
faptul ca de fiecare data temperatura reala, masurata cu diverse instrumente (termocupluri, pirometre de
radiatie, sau, cel mai eficient cu ajutorul camerelor cu
termoviziune), este mai mica decat temperatura adiabatica calculata.
Temperatura de combustie, Tc,
reprezinta temperatura maxima reala, masurata, care caracterizeaza o reactie de combustie
ce se desfasoara intr-un set de conditii dat.
Aceasta ultima precizare este cu atat mai importanta cu
temperatura de combustie este determinata de conditiile de lucru:
natura si cantitatea de materii prime, viteza de incalzire si
temperatura de initiere, etc. Cea mai mica modificare a
conditiilor de operare se va regasi intr-o valoare diferita a temperaturii de combustie.
Valoarea temperaturii de combustie este cu adevarat importanta
prin prisma faptului ca de ea depinde formarea compusului dorit. Daca
se ia in discutie, de exemplu, cazul compusilor oxidici sau cel al
solutiilor solide oxidice, este bine
cunoscut faptul ca formarea acestora se realizeaza prin reactii in stare solida,
reactii care la randul lor sunt puternic influentate de
temperatura.
Din calculul variatiei de entalpie libera se poate determina
temperatura minima la care formarea
compusului oxidic dorit devine termodinamic posibila, in
aceasta situatie o conditie esentiala pentru
obtinerea compusului dorit este aceea ca temperatura de combustie
specifica reactiei respective sa fie cel putin egala,
daca nu mai mare decat acea temperatura minima, la care formarea
compusului proiectat este termodinamic
posibila.
Temperatura de initiere, Ti, este temperatura
minima la care reactia odata declansata evolueaza
in maniera auto-propagata. Altfel spus, initierea unui proces de combustie se produce in momentul in
care o cantitate mica, dar semnificativa, de amestec de
reactanti este rapid incalzita
la o temperatura superioara temperaturii la care viteza reactiei
chimice este suficient de ridicata pentru a rezulta o cantitate de
caldura mai mare decat caldura care se pierde prin transfer
termic [104]. Spre deosebire de temperatura adiabatica, Tad,
care, dupa cum s-a aratat deja, poate fi destul de usor
calculata, atat temperatura de combustie,
Tc, cat si temperatura de initiere, Ti,
nu pot fi determinate decat pe cale experimentala.
In timp ce cunoasterea temperaturii de
combustie prezinta importanta prin prisma asigurarii
temperaturii minime necesare formarii compusului dorit, rolul temperaturii
de initiere se evidentiaza prin aceea ca la valori prea
mici ale temperaturii, reactia de combustie nu se produce. Altfel spus,
pentru activarea unei reactii de combustie amestecul de materii prime
trebuie sa fie incalzit la o temperatura cel putin
egala cu temperatura de initiere, in caz contrar procesul neavand
loc. Importanta cunoasterii temperaturii de initiere reiese
si din faptul ca, cu cat temperatura la care are loc initierea
reactiei este mai ridicata - si mai mare decat
temperatura de initiere - cu atat suprafata specifica a
pulberii rezultate va fi mai mare.
Viteza de incalzire a amestecului reactant
Viteza de incalzire este un alt factor care exercita o
puternica influenta asupra modului de desfasurare a
reactiei de combustie si implicit asupra caracteristicilor produsului
de reactie, in functie de particularitatile fizice ale
sistemului in care se lucreaza si de viteza de incalzire se
disting doua situatii majore:
- daca viteza de incalzire este redusa exista
pericolul ca o parte din reactanti sa participe la alte procese
fizice si chimice concurente, ceea ce conduce
la alterarea stoechiometriei reactiei de combustie. Un exemplu tipic in aceasta directie il constituie
comportarea amestecurilor de azotat de magneziu si uree. In urma
incalzirii lente, treptate, a unui amestec stoechiometric format din azotat de magneziu, uree si
apa distilata, s-a constat ca reactia de combustie mult
asteptata practic nu are loc [105]; pentru ca cea mai mare parte
a ureei se consuma in reactia de hidroliza, astfel ca la
atingerea temperaturii de initiere a reactiei de combustie in
amestecul de materii prime exista un deficit considerabil de agent
reducator. In schimb daca un amestec identic este supus incalzirii cu viteza mare, o parte din
uree hidrolizeaza si in acest caz, dar intr-o cantitate mult mai mica, astfel ca
reactia de combustie decurge in mod normal.
Rezultate similare au obtinut si
Santiago [106] si colaboratorii sai, de data aceasta in sinteza LiCoO2,
acestia constatand ca reactia de combustie apare doar in acele probe in care s-a lucrat cu un exces de uree. Explicatia este
foarte simpla: datorita acestui exces, chiar si in urma
reactiei de hidroliza, in amestecul de reactie mai exista o
cantitate suficienta de combustibil care la atingerea temperaturii de
initiere reactioneaza cu azotatii respectivi. Este de la sine
inteles ca in cazul consumului combustibilului inainte de
initierea reactiei de combustie, obtinerea compusului cu
caracteristicile dorite este pusa sub semnul intrebarii, azotatul sau
azotatii metalici prezenti
in amestec avand o comportare
independenta la incalzire.
- daca viteza de incalzire este foarte mare, asa cum se
intampla in cazul initierii reactiilor de combustie prin intermediul
microundelor [107,108,109], nu se poate
realiza o incalzire locala a probei, ci aceasta se va incalzi
uniform, in intreg volumul ei.
Datorita particularitatilor incalzirii cu microunde (flux
termic ridicat si incalzire uniforma), la un moment dat
intreaga cantitate de proba va atinge temperatura de initiere, astfel
ca reactia de combustie se va declansa simultan in intreg
volumul probei, frontul de combustie ne-putand ti sesizat, in acest caz,
reactia de combustie este practic o explozie, care de cele mai multe ori
conduce la pierderea produsului de reactie datorita antrenarii
acestuia in gazele de ardere, fenomenul
fiind cunoscut sub numele de explozie
termica, sau combustie in volum.
In concluzie, din punct de vedere al initierii reactiei de
combustie, este de dorit ca viteza de incalzire sa se realizeze la
valori intermediare: nici prea mici - pentru a evita pe cat posibil consumul
reactantilor ca urmare a participarii acestora la reactii sau
procese concurente, nedorite, dar nici
prea ridicate - pentru a evita desfasurarea reactiei de
combustie in varianta VCS, cand se pune
problema recuperarii produsului de reactie. Asa se
justifica faptul ca initierea reactiilor de
combustie nu se realizeaza printr-o incalzire lenta, treptata, ci se recurge la:
-introducerea recipientului continand amestecul de materii prime
intr-un cuptor
adus in prealabil la temperatura dorita, de regula sub 500°C [77];
- amplasarea recipientului respectiv pe o plita sau un cuib electric incalzit in prealabil [101];
- utilizarea microundelor, care asigura viteze reglabile
de incalzire [110,111].
Volumul amestecului de materii prime
Fiind procese controlate in mare masura de eficienta
transferului termic, reactiile
redox auto-propagate sunt puternic
influentate de cantitatea amestecului
de materii prime, sau de volumul ocupat de amestecul reactant. Din acest
punct de vedere, Kingsley si Patil [112] au meritul de a fi printre primii
care au sesizat importanta pierderilor
de caldura din aceste procese.
De exemplu, daca se iau in considerare doua probe formate
dintr-un azotat metalic si
un combustibil adecvat si care difera intre ele numai prin masa amestecului
de materii prime, se constata ca in urma masurarii
temperaturii de combustie care se atinge in fiecare caz in parte, in cazul
probei mai mare cantitativ temperatura
maxima masurata este mai ridicata decat in cazul celeilalte probe si mai apropiata
de valoarea temperaturii adiabatice. Altfel spus,
utilizarea unor cantitati mai mari de proba creeaza
premisele apropierii de conditiile
termodinamice de lucru.
Aceasta evolutie a temperaturii de combustie cu cantitatea de
amestec de materii prime se poate explica prin modul in care se realizeaza
pierderile de caldura, pierderi care la randul lor depind in
principal de volumul gazelor generate in
urma reactiei si de suprafata efectiva a probei prin care
se realizeaza transferul termic. Cu cat cantitatea de proba cu
care se lucreaza este mai mare, cu atat volumul gazelor rezultate este mai
mare dar suprafata specifica a amestecului
reactant va fi mai mica si deci fluxul termic unitar va fi mai mic.
Rezultanta acestor factori se regaseste in cresterea
temperaturii de combustie a probei odata cu cresterea
cantitatii de proba luata in lucru, in aceasta
directie, un aspect foarte important, care nu trebuie pierdut din vedere, se refera la faptul ca unele reactii sunt accelerate
pana la explozie chiar si atunci cand se folosesc
cantitati mici de amestec de materii prime [105], motiv pentru care
atunci cand se doreste obtinerea unor cantitati mai mari de
produs finit se impune o atentie sporita si luarea unor
masuri suplimentare de protectie a muncii.
Cantitatea de apa din amestecul reactant
Asa cum se practica si in alte
metode de sinteza, pentru a atinge un grad maxim
de omogenitate, care sa favorizeze formarea compusului dorit, dupa
dozare, materiile prime sunt dizolvate intr-o cantitate minima de solvent,
cel mai frecvent folosindu-se apa distilata, in metoda combustiei,
varianta LCS, solutia astfel obtinuta este ulterior supusa
incalzirii in vederea initierii reactiei de combustie.
Urmarind modul in care decurg o serie de reactii dintre
azotati metalici si diferiti combustibili organici s-a constatat
existenta unor deosebiri majore. Asa de exemplu, uneori
initierea reactiei de combustie se realizeaza abia dupa ce
marea majoritate a apei s-a evaporat, proba avand o consistenta
vascoasa, in timp ce, alteori initierea reactiei de combustie
apare inca din faza de solutie.Cu
toate ca studiile din literatura
de specialitate care trateaza influenta acestui factor asupra reactiilor de combustie
si mai ales asupra particularitatilor
produsului de reactie sunt destul de putine si uneori contradictorii,
se poate afirma ca, intr-adevar, caracteristicile produsului de reactie
sunt influentate de cantitatea
de apa existenta in amestecul de materii prime din momentul
initierii procesului de combustie, in spijinul acestei afirmatii pledeaza cel putin
doua elemente semnificative, in primul rand, volumul de gaze care
impiedeca desfasurarea
proceselor de aglomerare si sinterizare este cu atat mai mare cu cat cantitatea de apa din momentul
initierii reactiei de combustie este mai mare. In al
doilea rand, prezenta unei anumite cantitati de apa in
momentul initierii reactiei de combustie va contribui la reducerea
temperaturii de combustie datorita
consumului de caldura in vederea evaporarii apei.
Analizand rezultatul cumulativ al celor doua cai de actiune
a cantitatii de apa din
precursor in momentul initierii
reactiei de combustie se poate concluziona
ca, cu cat aceasta e mai ridicata cu atat pulberea rezultata va
avea o suprafata specifica mai mare si granule mai
mici.
Presiunea
Unul dintre parametrii mai putin studiat, dar care s-a dovedit a avea
o influenta majora asupra caracteristicilor produsului
obtinut, in principal asupra suprafetei specifice si gradului de
cristalinitate, il reprezinta presiunea din momentul initierii
reactiei de combustie. Ideea ca
presiunea ar putea juca un rol important in aceste reactii a pornit
de la natura fizica a produsilor secundari de reactie (CO2, H2O si N2), care se afla in stare gazoasa.
Dupa cum s-a aratat deja, in literatura de specialitate
dimensiunea redusa a granulelor obtinute este explicata de cele
mai multe ori prin volumul mare de gaze care se degaja si care provoaca
expandarea probei impiedicand desfasurarea proceselor de sintetizare
si crestere a granulelor. Tinand cont de aceasta, Ozun [112] si
colaboratorii sai au emis ipoteza ca, presiunea din amestecul de
materii prime cu cat este mai mare, cu atat pulberea rezultata va avea o
suprafata specifica mai mare, mizand pe caracterul exploziv al
reactiei de combustie.
Sinteza
unor compusi oxidici prin metoda combustiei
Avand in vedere rezultatele obtinute anterior, rezultate care
atesta existenta unei predilectii a azotatilor metalici
pentru anumiti combustibili, s-a incercat valorificarea acestora in
sinteza unor compusi oxidici de interes practic:
MgO∙Al2O3, 3CaO∙Al2O3,
CaO∙6Al2O3, 2MgO∙2Al2O3∙5SiO2.
Obtinerea compusilor oxidici de tipul celor anterior
mentionati prin metoda combustiei
este un subiect amplu tratat in literatura. Deficienta majora a
acestor abordari consta in faptul ca se utilizeaza un
singur combustibil, in marea majoritate a cazurilor fiind vorba despre
uree sau glicina, fara a tine cont de faptul ca azotatii metalelor respective
au o afinitate diferita in raport cu unul si acelasi combustibil.
Prin urmare, in majoritatea cazurilor obtinerea compusului oxidic
dorit este conditionata de
aplicarea unor tratamente termice costisitoare, similar altor metode neconventionale de sinteza.
Elementul de noutate al sintezelor consta in utilizarea unor
amestecuri de combustibili, amestecuri alese in functie de reactivitatea individuala a fiecarui
azotat metalic in raport cu diferiti combustibili, care
asigura formarea compusului dorit direct din reactia de combustie, fara a mai necesita
tratamente termice suplimentare.
Sinteza aluminatului tricalcic, 3CaO∙Al2O3
Sistemul binar CaO-Al2O3 reprezinta unul dintre cele mai intens
studiate sisteme oxidice. Aceasta se datoreaza in primul rand proprietatilor
hidraulice pe care le manifesta unii
dintre compusii oxidici prezenti in acest sistem - CaO∙Al2O3 (CA),
CaO∙2Al2O3 (CA2), 12CaO∙7Al2O3
(C12A7) - valorificate in obtinerea
cimentului aluminos. Ceilalti doi compusi - CaO∙6Al2O3
(CA6,) si 3CaO∙Al2O3
(C3A) - nu prezinta importanta pentru chimia
cimentului aluminos.
Daca in cazul hexaaluminatului de calciu
aceasta se explica prin absenta proprietatilor
hidraulice, in cazul aluminatului tricalcic aceasta se datoreaza
reactivitatii sale exagerate in raport cu apa. Cu toate acestea,
proprietatile hidraulice ale C3A sunt valorificate la
obtinerea cimentului Portland, unde aluminatul
tricalcic este unul din cei patru constituentii mineralogici de baza.
Recent a fost luata in discutie abilitatea C3A de a
forma solutii solide prin diverse substitutii [113,114] precum
si influenta acestuia asupra biocompatibilitatii
si bioactivitatii implanturilor de tesut osos cu continut
de CA [115]. Una dintre particularitatile care apar la
obtinerea aluminatului tricalcic prin metoda clasica, bazata pe
calcinarea unor amestecuri mecanice de oxizi si/sau
saruri, o constituie faptul ca formarea acestuia este precedata
de formarea altor aluminati de
calciu, in special C12A7 [].
Referitor la fazele intermediare, premergatoare formarii
aluminatului tricalcic prin metoda ceramica, rezultatele din
literatura sunt destul de contradictorii, in sensul ca, daca
asupra formarii C12A7 ca si faza
tranzitorie in obtinerea C3A exista un consens, nu
acelasi lucru se poate afirma si despre formarea intermediara a altor aluminati de calciu, de tipul
CA.
Astfel, unii autori - ca de exemplu, Ghoroi [116]
si Suresh - au aratat ca prima si singura
faza intermediara care apare la incalzirea unui amestec stoechiometric de CaCO3 si A1(OH)3
destinat obtinerii C3A este C12A7, care se formeaza la 967,9 °C.
Aceeasi autori cu constatat ca, in compozitia fazala a probelor calcinate la 1.300 °C cu un palier de 3
ore, pe langa C3A (~ 70 %) inca se mai afla
cantitati importante de C12A7 (~ 30 %).
Alti autori - ca de exemplu, Mohamed [117] si Sharp - au semnalat
in sinteza C3A prin metoda clasica, pe langa formarea
intermediara a C12A7 si a CA. Cu sau
fara formarea intermediara a CA, un lucru este cert: in metoda
clasica formarea C3A este de fiecare data precedata
de formarea C12A7. Mai mult
decat atat, obtinerea aluminatului tricalcic pur necesita tratamente
termice costisitoare chiar si atunci cand de utilizeaza multe
dintre metodele neconventionale de
sinteza, rezultatele obtinute de diversi autori indicand faptul ca
formarea acestuia decurge greu, in sensul ca si in aceste cazuri
apare ca si faza intermediara
C12A7.
Pentru a obtine C3A folosind alaturi de azotatii
de calciu si aluminiu alcool polivinilic, Lee si colaboratorii sai au recurs la
calcinarea precursorului timp de o l ora la 1.000 0C, chiar si in aceste conditii autorii semnaland prezenta CaO alaturi de C3A Rezultate
similare au obtinut Douy [119]
si Gervais, care au aratat ca in cazul pirolizei unei
solutii apoase de azotat de calciu si aluminiu
formarea C3A este precedata de cristalizarea CaO.
Date fiind rezultatele excelente inregistrate in sinteza altor compusi
oxidici, una dintre metodele
neconventionale de sinteza de la care s-ar fi asteptat ca
formarea C3A sa se realizeze fara aparitia fazelor
intermediare nedorite a fost metoda sol-gel. Cu toate acestea, diversi autori au ajuns la acelasi rezultat: prin calcinarea
gelului la 900 °C cu palier de 2 ore
se obtine un amestec polifazic de C3A, C12A7 si CaO. Utilizand o
varianta a metodei sol-gel Geetha [122] si colaboratorii sai au
aratat ca pentru obtinerea C3A
pur este necesar un tratament termic de 4 ore la 1.200 °C.
Dintre toate metodele neconventionale utilizate pana in prezent in sinteza C3A,
rezultatele cele mai bune pot fi consemnate in dreptul metodei bazate pe descompunerea termica a unor
combinatii complexe obtinute pornind de la azotatii de Ca2+ si Al3+ pe de-o parte si etilenglicol [123] sau trietanolamina [124] pe de alta parte. Prin
calcinarea glioxilatului de calciu
si de aluminiu la 1.000 °C timp de o ora se obtine C3A pur [123]. Avantajul major al acestei
metode este acela ca formarea C3A are loc la temperaturi mai
joase comparativ cu metoda clasica si chiar cu unele metode
neconventionale de sinteza si in mod direct, fara
formarea in prealabil a CaO sau a altor aluminati de calciu, de tipul C12Al7
sau CA. Rezultate similare au prezentat Pati [124] si colaboratorii sai, care prin calcinarea unor
combinatii complexe continand Ca2+, Al3+ si trietanolamina la 1.000 °C au obtinut C3A pur.
Autori precum Kingsley [125] sau Tas [126] au descris rezultatele lor
experimentale referitoare la sinteza aluminatului tricalcic prin metoda
combustiei. Cercetarile experimentale efectuate de Tas [126] au scos
in evidenta faptul ca prin
calcinarea pulberilor rezultate prin utilizarea unui singur combustibil (uree, glicina sau
carbohidrazida) la temperaturi de pana la 525 °C timp de 48 de ore se obtine un amestec de C3A C12Al7 si CA. Conform aceluiasi autor, obtinerea C3A pur este conditionata de aplicarea
unui tratament termic de 48-72 de ore la 1050 °C. Rezultate similare
sunt consemnate si de catre Lazau si colaboratorii sai, care au aratat ca
prin calcinarea pulberilor obtinute utilizand
ureea sau β-alanina ca si combustibil la 900 °C cu palier de 2 ore se
obtine un amestec de C3A C12Al7 si CaO.
Pe baza rezultatelor proprii [71,105]
care au aratat faptul ca Ca(NO3)2 si Al(NO3)3 prezinta o
comportare diametral opusa in reactie cu ureea, glicina sau β-alanina
s-a elaborat o noua varianta a metodei combustiei, varianta care
presupune utilizarea unor amestecuri de
combustibili. Spre deosebire de varianta traditionala a
metodei combustiei, care nu tine cont de afinitatea diferita a azotatilor metalici in raport
cu diversi combustibili si deci utilizeaza un singur combustibil, varianta propusa
permite obtinerea C3A
roentgenografic pur [130] direct din reactia de combustie,
fara intermediari si fara calcinare ulterioara.
Particularitati ale formarii
CaO∙6Al2O3
Spre deosebire de restul compusilor oxidici din sistemul CaO-Al2O3,
hexaaluminatul de calciu, CaO∙6Al2O3, cunoscut sub
numele de hibonit nu are activitate hidraulica. Pe de alta parte,
CaO∙6Al2O3
poate fi considerat ca un membru al familiei de β-alumine. Acesta
poseda o structura de tip magneto-plumbit formata din blocuri
spinelice si straturi de conductie dispuse succesiv astfel incat
formeaza o structura stratificata [131]. Datorita acestei
structuri, hexaaluminatul de calciu prezinta o serie de
proprietati optice si electrice interesante, fiind uzual folosit
ca retea gazda in vederea obtinerii materialelor luminofore [132,133].
O alta aplicatie majora este
legata de proprietatile refractare ale CaO∙6Al2O3,
care se topeste incongruent la 1.885 °C cu formarea unui amestec de
α-Al2O3 si faza topita. Recent, s-a
demonstrat faptul ca refractarele pe baza de hexaaluminat de calciu
poseda o comportare foarte buna la
atacul topiturii de aluminiu [134]. Pabbruwe si colaboratorii
sai au aratal faptul ca prezenta CaO∙6Al2O3
in implanturile pe baza de alumina arc efecte pozitive asupra stimularii activitatii osteoclastice
la interfata os-implant ceramic [135].
In plus, Maschio si Pezzotti au prezentat
faptul ca materialele compozite formate din alumina si o
mica parte de CaO∙6Al2O3 isi mentin
intacte proprietatile chiar
si dupa ce acestea au fost in contact timp de 30 de zile cu
ser fiziologic la o temperatura de 35 °C [136]. Alte aplicatii
ale hexaaluminatului de calciu sunt: suport pentru catalizatori [137], fibre
si straturi de protectie
materiale compozite Datorita numarului mare de aplicatii pe care
CaO∙6Al2O3 il prezinta, exista un interes deosebit in ceea ce priveste sinteza si caracterizarea
acestui compus oxidic.
Dupa cum se cunoaste, obtinerea hexaaluminatului de calciu
prin intermediul metodei ceramice
necesita tratamente termice lungi si la temperaturi ridicate,
insotite de macinari intermediare. Spre exemplu, pornind de la
un amestec stoechiometric de alumina si carbonat de calciu,
Sanchez-Herencia si colaboratorii au aratat ca obtinerea
hexaaluminatului de calciu ca faza unica are loc doar in urma
calcinarii la 1.650 °C cu palier
de 3 ore [14l].
Datorita dificultatilor legate de
sinteza CaO∙6Al2O3 ca
faza monominerala exista un permanent interes pentru
dezvoltarea unor noi metode de sinteza, care sa permita formarea
hexaaluminatului de calciu in urma
unor tratamente termice mai putin costisitoare. Asa se explica
faptul ca o serie de autori au abordat
aceasta problema, propunand diverse metode neconventionale de
sinteza. Callender si colaboratorii sai au aratat faptul
ca prin calcinarea carboxilatului-alumoxan
de calciu la 1.400 °C se obtine CaO∙6Al2O3
roentgenografic pur [142].
Studiind formarea CaO∙6Al2O3 dintr-un gel de alumina cu continut
de acetat de calciu, Cinibulk si
Hay au constatat ca produsul
rezultat in urma calcinarii la 1.400 °C
este un amestec de CaO∙6Al2O3, α-Al2O3 si
CaO∙2Al2O3 [141].
Pe de alta parte, folosind metoda polimerilor organici, Cinibulk a
reusit sa obtina CaO∙6Al2O3 ca faza cristalina unica prin calcinarea amestecului precursor la 1.300 °C timp de o ora [142].
Lazau si colaboratorii sai au sintetizat CaO∙6Al2O3
pur prin calcinarea la 1.000 °C cu palier
de o ora a unui glioxilat de calciu
si aluminiu obtinut in
prealabil prin oxidarea 1,2-etadiolului cu azotati de calciu si aluminiu [123].
Patil si colaboratorii sai au demonstrat faptul ca, in
anumite conditii, metoda combustiei
permite obtinerea compusului oxidic dorit direct din reactia de
combustie, fara a mai recurge la alte tratamente termice [75,78]. Formarea
compusului oxidic are loc pe seama valorificarii efectului puternic
exoterm asociat reactiei de combustie auto-propagata care are loc
intre azotatii metalici doriti
si diversi combustibili.
Initierea reactiei de combustie
se realizeaza prin incalzirea
rapida a solutiei amestecului de materii prime la temperaturi sub
500 °C. In timpul desfasurarii reactiei de combustie
temperatura dezvoltata poate depasi 1.000 °C, facilitand
formarea compusului oxidic dorit si deci eliminarea etapei de calcinare, indispensabila celor mai
multe metode de sinteza.
In pofida acestor atribute de exceptie, Tas afirma ca
utilizand ca si combustibil ureea,
glicina sau carbohidrazida, formarea CaO6∙Al2O3
pur are loc doar in urma
calcinarii pulberii obtinute prin metoda combustiei la 1.200 °C
cu palier de 48 de ore [126].
Din acest punct de vedere, scopul acestor determinari experimentale [142]
este acela de a prezenta o varianta inedita a metodei combustiei,
variata ce permite obtinerea hexaaluminatului de calciu ca faza
unica direct din reactia de combustie: utilizarea unui amestec de
combustibili, care sa contina cel mai potrivit combustibil pentru flecare azotat metalic.






